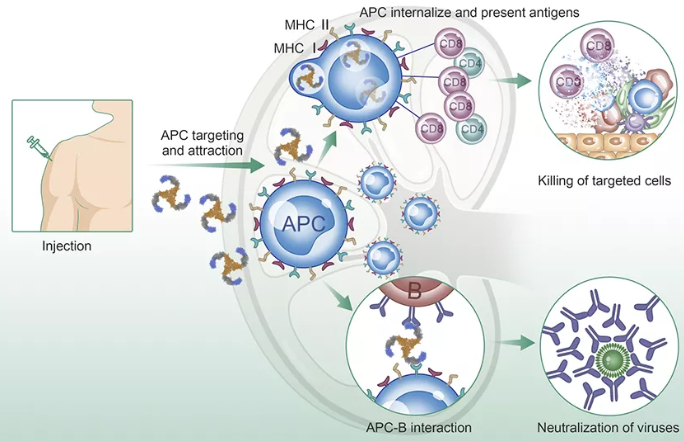
任何一家公司,都很少能有机会了解其研发实践和企业文化的内部运作方式。如果一家制药公司提供这样透明的信息,那就更加不同寻常,因为这个行业向来严密保护和扞卫其知识产权而着称。阿斯利康公司(AstraZeneca)的科学家们选择了这种不同寻常的做法,公开发表了一份描述该公司研发部门内部运作方式的调查报告。这份报告名为《从阿斯利康储备研发项目的命运中汲取教训:五维框架》(Lessons learned from the fate of AstraZeneca's drug pipeline: a five-dimensional framework),文章透露了丰富的细节,展现了不同寻常的坦诚,披露了极为糟糕的科学管理与监督。
当马丁·麦凯(Martin Mackay)来到阿斯利康公司负责研发部门时,他开始改革这家公司的经营战略。作为这项举措的一部分,他委托科学家进行研究,以了解化合物从实验室到临床试验的过程中为什么有如此高的失败率。按照作者的描述:“研究的目标是确定有可能影响研发部门良好运作的最主要因素,提升化合物进入三期临床试验阶段的成功率,最终推出新的药物。”
为了实现这个目标,他们详尽地回顾了阿斯利康的142个药物发现和开发项目。这项审查包括2005年到2010年间活跃的项目,涵盖了从临床前研究到二期临床试验结束的各个阶段。正如文件所说:“这项审查的关键目的是了解药物项目终止的主要原因,确定与成功结果存在关联的项目特点。”
项目失败的原因可以分为四类。首先是化合物的安全性,参与过药物发现的人对此应该不会感到奇怪。如果一个团队确定某种化合物具有在患者身上试验的价值,需要先进行动物研究,以证明这种药物的长期服用不会造成伤害。按照监管部门的要求,这些研究通常持续30天到90天,用药剂量要超过预期的有效人用剂量。如果这些研究发现安全性问题,那么该化合物将被放弃,人们会寻找不产生这种副作用的合适替代方案。但是在阿斯利康公司出现了多个案例,尽管发现存在某些安全性问题,“这个项目依然向前推进,因为有理由相信这些信号在疾病适应症的范围内是可接受和可控的。”换句话说,这个团队希望这种化合物代表这种疾病治疗方法的突破,其效益风险将证明是可以接受的。遗憾的是,这种结果很少出现。临床前研究暴露出的安全性问题,通常注定了化合物在一期或二期临床试验中的失败命运。
项目失败的第二大原因是实验药物在临床试验中没有发挥足够的疗效。而且,这不是阿斯利康公司独有的问题。医药研发的作用就是通过发现化合物来检验学术界提出的理论,以此证明或者反驳医学理论。然而,阿斯利康的大量失败案例归结于一个事实,“团队缺乏数据来证明药物靶标与疾病之间,或与这种疾病经过充分验证的动物模型之间,存在明确联系。”在这些失败的项目中,实验团队没有很好地理解药物靶标对基础疾病的病理生理所起到的作用。这些化合物在临床阶段的失败也不令人奇怪。从本质上讲,这些研发团队对于他们项目的潜力过于乐观。
在阿斯利康公司的分析中,另一个让人震惊的原因是,有些化合物在没有表现出任何疗效的情况下仍向前推进。“造成项目失败的一个令人惊讶的因素是,在没有足够强大的数据支持下,项目就进入下一个阶段。比如说,在由于缺乏临床疗效于二期临床阶段失败的项目中,有18%的项目是根据薄弱的临床证据进入到这个阶段的,这表明项目管理工作做的不到位。”如果一种化合物推进到二期临床阶段,消耗的资源会大量增加。相比大家都会以为,如果有化合物启动了二期临床试验,那么其证明文件应该是在公司内部得到过全面审查才对。显而易见,在过去十年中,这种严谨的态度不是阿斯利康企业文化的一部分。
最后,阿斯利康公司的分析表明,许多失败的化合物曾是“备用品”。当团队推进一种令人兴奋的原型药物进入开发阶段,这个团队通常会把第二候选药物作为“备用品”,如果原型药物失败,则作为替代品来开发。大多数后备药物的问题在于,这些药物都是合成的,在推进的过程中人们并不真正清楚到底是什么原因最终导致原型药物失败。通常来说,后备药物可能具有和原型药物相同(依然还未发现)的缺陷。因此,如果原型药物失败,后备药物通常也会出于同样的原因失败。尽管用心良苦,但是后备药物是项目失败的主要因素。有趣的是,作者指出:“在写这篇文章的时候,阿斯利康公司大约50%的药物组合都是由后备药物构成的。”
所有类型的失败都可以归结为科学管理和领导力的缺位。科学家们自然会展示他们项目的良好表现,相信他们发现了重大的突破。但是管理层的作用是向研发团队提出质疑,如果需要的话,还要做出终止项目的艰难决定。最终,正是管理层的决定让具有安全性问题、科学依据不足的化合物进入到临床试验阶段;正是管理层的决定让化合物继续推进研发,尽管没有数据证明进展;正是管理层的决定造成“备用品”的泛滥。如果有正确的领导,许多项目的失败本来可以避免。
作者指出:“我们在此发布我们的数据和分析,希望可以全面帮助制药行业解决这个关键的挑战。”这是一项崇高的事业,他们的贡献应该得到称赞。然而,人们希望大多数企业认识到了这些问题,并且予以纠正。如果不是这样的话,研发项目的高失败率将继续出现在整个行业。
来源:福布斯中文网
为你推荐
 资讯
资讯 京津冀持续暴雨,蚂蚁集团AQ上线专区提供健康科普及线上义诊服务
近日,华东、华北、东北等地持续强降雨,引发洪涝和地质灾害,社会各界紧急响应。为了方便受强降雨影响的群众获得一站式的信息及服务,7月29日,蚂蚁集团旗下AI健康应用AQ推出“...
2025-07-29 20:25
 资讯
资讯 讯飞医疗亮相WAIC,牵头《医疗健康行业智能体标准体系》10项核心子标准
7月26日,以“智能时代、同球共济”为主题的2025世界人工智能大会暨人工智能全球治理高级别会议(WAIC)在上海开幕。大模型在医疗领域的应用正从概念验证走向产业化落地,如何建...
2025-07-29 17:50
 资讯
资讯 Cytiva推出全新一次性超滤系统 ÄKTA readyflux TFF 500,赋能先进疗法研发与小规模生产
以更灵活、多元的ÄKTA 产品组合,满足行业在先进治疗药物开发领域
2025-07-29 16:39
 资讯
资讯 爱尔眼科联合行业多方发起“三正规”倡议 对假货“零容忍”
儿童青少年近视防控已成为关乎国家未来的重要民生课题。然而,当前市场上假冒伪劣近视防控产品屡见不鲜,不仅无法起到防控效果,更可能加剧视力恶化。
文/陈炜 2025-07-29 16:20
 资讯
资讯 外用制剂领域再突破 MC2-01乳膏治疗中国斑块状银屑病的Ⅲ期临床试验获批
杭州中美华东制药有限公司开发的MC2-01乳膏,用于治疗中国斑块状银屑病的Ⅲ期临床试验申请已正式获得国家药品监督管理局批准
2025-07-28 18:18
 资讯
资讯 欧盟批准含Blenrep(注射用玛贝兰妥单抗)的联合治疗方案用于治疗复发或难治多发性骨髓瘤
葛兰素史克(LSE NYSE:GSK)7月24日宣布,Blenrep已获得欧盟(EU)批准,用于以下适应症:联合硼替佐米和地塞米松(BVd),用于既往接受过至少一线治疗的复发或难治多发性骨髓...
2025-07-28 16:08
 资讯
资讯 欧狄沃联合逸沃获批成为中国首个非小细胞肺癌一线双免疫疗法
今日(7月28日),百时美施贵宝宣布,欧狄沃®(纳武利尤单抗注射液)联合逸沃®(伊匹木单抗注射液)方案获得中国国家药品监督管理局(NMPA)批准。
2025-07-28 15:58
 资讯
资讯 橙帆医药完成超6000万美元Pre-A+轮融资,加速全球首创新药管线临床开发
2025年7月28日,专注多抗与ADC药物研发的创新企业橙帆医药宣布完成超6000万美元Pre-A+轮融资。本轮融资由顺为资本领投,北极光创投、汉康资
2025-07-28 09:21
 资讯
资讯 Lenacapavir“零时差”落地乐城,我国HIV防控迈入长效预防新时代
2025年7月25日,全球同类首创、一年仅需给药两次的HIV暴露前预防药物Lenacapavir(来那帕韦)正式落地海南博鳌乐城国际医疗旅游先行区
2025-07-27 10:35
 资讯
资讯 国家卫健委:医养结合示范项目工作方案(2025年版)
全国医养结合示范机构。具备医疗卫生机构资质,依法进行养老机构备案的医疗卫生机构或养老机构。示范机构每2年评估一次,每次命名100个左右(含中医药特色的示范机构),2030年...
2025-07-26 17:05
 资讯
资讯 CDE :化学药品口溶膜剂药学研究技术指导原则(试行)
膜剂是指原料药物与适宜成膜材料等经加工制成的膜状制剂,根据给药部位不同,可分为口用膜、眼用膜、阴道膜等。口用膜可分为口溶膜、口颊膜、舌下膜和口腔贴膜。口溶膜是指在口...
2025-07-26 10:52
 资讯
资讯 CDE:12项生物类似药药学相似性研究的问题与解答
生物类似药进行临床试验申请时,对于生产工艺和规模的要求是什么?候选药的剂型、规格、 制剂处方是否必须与参照药一致?对参照药的来源如何要求?多规格制剂中是否可以选择一...
2025-07-26 10:40
 资讯
资讯 皮尔法伯集团毕太维®联合疗法在华获批,精准靶向BRAFV600E突变型转移性结直肠癌
用于既往接受过系统治疗的BRAFV600E突变型转移性结直肠癌(mCRC)成人患者。
2025-07-25 18:24
 资讯
资讯 《特殊医学用途流质配方食品注册指南》和《特殊医学用途增稠组件配方食品注册指南》
流质配方为非全营养配方食品,一般在短时间内使用,满足需要流质饮食和限制脂肪摄入人群的基本营养需求。
2025-07-25 17:15
 资讯
资讯 扬子江药业在固阳成功举办第二届717龙凤堂有机黄芪节
“健康中国”战略指引下,扬子江药业集团(以下简称扬子江)旗下中药品牌龙凤堂始终致力于全链条把控产品质量,从源头助力中药材产业发展水平提升。
2025-07-25 10:42