2025年4月17日,礼来公布了3期临床研究ACHIEVE-1的积极顶线结果,该研究评估了orforglipron对比安慰剂,在饮食控制和运动基础上血糖控制仍不佳的2型糖尿病患者中的安全性和有效性。Orforglipron是首个成功完成3期试验、对饮食或饮水不加以限制的口服小分子胰高血糖素样肽-1(GLP-1)受体激动剂。如果该药物未来获批,礼来对其实现全球充足的供应充满信心。这将进一步实现礼来长期以来的使命——降低包括2型糖尿病在内的慢性病的影响。预计到2050 年,全球将有约7.6亿成人受2型糖尿病影响。[1]
“目前共有7项评估orforglipron在糖尿病和肥胖人群中安全性和有效性的3期临床试验,ACHIEVE-1则是其中的首个研究。作为最新的肠促胰岛素类药物,我们很高兴看到它达到了我们对其安全性、耐受性、血糖控制和减重的各项预期,并且今年年底前我们将获得有关这一研究的更多数据” ,礼来制药董事长兼首席执行官戴文睿表示, “作为一种给药便利的每日一次口服药物,orforglipron将为患者提供一种新的治疗选择。如果这款药物能够获批,将能实现大规模生产和上市,惠及全球患者。”
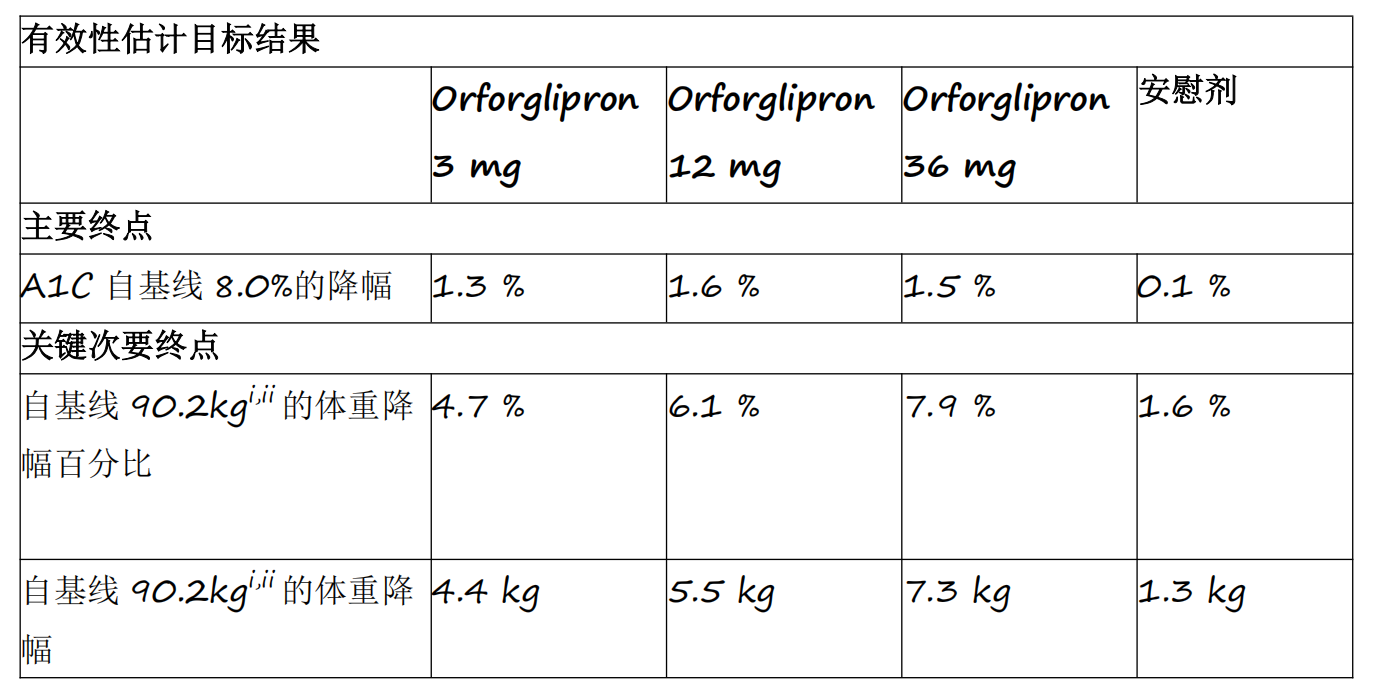
在ACHIEVE项目的第一项3期临床试验中,orforglipron达到了主要终点,即在40周时,经orforglipron治疗后糖化血红蛋白(A1C)的降幅显著优于安慰剂组,A1C自8.0%的基线平均降低 1.3%至1.6%(使用有效性估计目标)。[2]在关键次要终点,超过65%的患者接受最高剂量的orforglipron后A1C值降至≤6.5%,低于美国糖尿病协会(ADA)定义的糖尿病阈值。[3 ]在另一个关键次要终点,接受orforglipron的患者在最高剂量下平均减重7.3kg(7.9%)。鉴于患者在研究结束时尚未达到体重平台期,可能表明尚未实现完全减重。
i 体重次要终点未对 3 mg 剂量组的 orforglipron 进行 I 类错误控制。
ii 患者体重平均降幅在 40 周时未达到平台期。
对于治疗方案估计目标,[4 ]orforglipron的每个剂量组都显示出具有统计学意义的A1C降低。在体重关键次要终点中,12mg和36mg剂量组显示出具有统计学意义的降低。
· A1C降幅:3mg组降低1.2%,12mg组降低1.5%,36mg组降低1.5%,安慰剂组降低0.4%
· 体重降幅百分比:3mg组降低4.5%,12mg组降低5.8%,36mg组降低7.6%,安慰剂组降低1.7%
· 体重降幅:3mg组降低4.2kg,12mg组降低5.2kg,36mg组降低7.2kg,安慰剂组降低1.5kg
在ACHIEVE-1研究中,orforglipron的整体安全性与GLP-1类药物一致。最常见的不良反应是胃肠道反应,通常为轻至中度。接受orforglipron(3mg、12mg和36mg)的患者中最常见的不良事件分别为:腹泻(19%、21%和26%)vs安慰剂组9%;恶心(13%、18%和16%)vs安慰剂组的2%;消化不良(10%、20%和15%)vs安慰剂组7%;便秘(8%、17%和14%)vs安慰剂组4%;呕吐(5%、7%和14%)vs安慰剂组1%。由于不良事件导致的总体治疗中断率分别为:3mg组6%,12mg组4%,36mg组8%,安慰剂组为1%。未观察到肝脏安全性信号。
ACHIEVE-1研究结果将在第85届ADA科学会议上发布,并发表在同行评审的期刊上。预计今年年底前将发布ACHIEVE研究 3期临床试验项目的更多结果,以及orforglipron用于体重管理的ATTAIN 研究3期临床研究结果。礼来预计将在今年年底前向全球监管机构提交orforglipron用于体重管理的上市申请,预计于2026年提交其用于治疗2型糖尿病的上市申请。
参考文献:
1. Facts & figures International Diabetes Federation. (2025, April 7). https://idf.org/about diabetes/diabetes-facts-figures/
2. The efficacy estimand represents efficacy had all participants remained on study intervention (with possible dose interruptions) for 40 weeks without initiating additional antihyperglycemic medications (>14 days of use).
3. American Diabetes Association. (n.d.). Understanding diabetes diagnosis. Diabetes Diagnosis & Tests | ADA. https://diabetes.org/about- diabetes/diagnosis
4. The treatment-regimen estimand represents the estimated average treatment effect regardless of treatment discontinuation or initiation of additional antihyperglycemic medications.
为你推荐
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12
 资讯
资讯 扬帆出海正当时:Cytiva 为中国生物药企绘制全球合规航海图
峰会聚焦法规解读、国际监管环境、中国生物药企业出海案例等关键议题,通过专家分享和深入解读,为中国生物药企提供全球化战略指导和合规支持;
2025-04-15 17:00
 资讯
资讯 全国肿瘤防治宣传周:礼来携手信达生物、和黄医药加速赋能本土医药创新
礼来携手本土合作伙伴信达生物、和黄医药齐聚上海,共话本土医药创新发展,探索加速惠及中国肿瘤患者的新模式
2025-04-15 16:27
 资讯
资讯 ADC明星企业映恩生物港交所上市,开盘高开91.33%
上市首日,其股价开盘高开91 33%,随后涨幅迅速扩大至127 06%,午间收报214 80港元,市值突破178 66亿港元,成为近年来港股18A生物科技公司中最亮眼的IPO案例之一。
2025-04-15 13:19