被恒瑞医药寄予厚望的“双艾疗法”再次失利了。
宣布将尽快采取措施并重新提交申请
近日,恒瑞医药发布公告称,公司了收到美国食品药品监督管理局(FDA)关于卡瑞利珠单抗联合甲磺酸阿帕替尼(又称“双艾”疗法)用于不可切除或转移性肝细胞癌患者一线治疗的生物制品许可申请(BLA)的完整回复信(Complete Response Letter,简称CRL)。在回复信中,FDA表示相关生产场地检查需进一步提交答复,但FDA并未在回复信中说明具体原因。
对于此次再次收到完整回复信,恒瑞医药方面表示,相关生产场地在2025年1月再次接受FDA检查,FDA核实去年发出CRL的检查中发现的问题都已经整改完毕,仅提出了3个新的改进要求,公司在规定时间内已对相关问题进行了积极回复,并一直与FDA保持密切沟通。公司将在确认具体原因后尽快采取措施并重新提交申请,以期能够获得批准。
就在恒瑞医药公布消息的同期,恒瑞医药的韩国合作伙伴HLB制药也在社交媒体上同步宣布,公司与恒瑞医药合作开发的“双艾”疗法又一次未能获得美国FDA的批准。
此前,HLB的美国子公司Elevar Therapeutics拥有阿帕替尼在中国与韩国之外的开发权利,并于2018年开始与恒瑞医药合作推进阿帕替尼联合卡瑞利珠单抗用于治疗晚期不可切除肝细胞癌的全球多中心Ⅲ期临床研究。2023年10月,恒瑞医药进一步宣布将“双艾组合”用于治疗肝细胞癌适应症在除大中华区和韩国以外全球范围内开发及商业化的独家权利有偿许可给Elevar Therapeutics。
受上述消息影响,恒瑞医药、HLB及相关子公司的股价开始走低或跌停。
被指生产场地存在缺陷
“双艾”疗法,即卡瑞利珠单抗联合阿帕替尼,是恒瑞医药自主研发的创新药物组合。卡瑞利珠单抗(中文商品名:艾瑞卡)是恒瑞医药自主研发的一款人源化PD-1单克隆抗体,于2019年5月获国家药品监督管理局批准上市,已在肺癌、肝癌、食管癌、鼻咽癌等多个癌种中获批了多个适应症。阿帕替尼(中文商品名:艾坦)则是恒瑞医药开发的一款针对血管内皮生长因子受体(VEGFR)的小分子酪氨酸激酶抑制剂,于2014年10月获批上市,用于治疗多种晚期恶性肿瘤。
2018年12月,卡瑞利珠单抗联合阿帕替尼一线治疗肝细胞癌的国际多中心Ⅲ期临床试验获准在美国开展。2021年4月,“双艾”疗法用于治疗肝细胞癌适应证获得FDA授予的孤儿药资格认定。
2023年7月,恒瑞医药首次向FDA提交了“双艾”疗法用于不可切除或转移性肝细胞癌患者一线治疗的生物制品许可申请(BLA)。据了解,此次上市申请是基于一项国际多中心Ⅲ期临床研究(CARES-310研究)的积极结果,在2024年美国临床肿瘤学会(ASCO)年会上,研究报告了继续随访16个月后的最终分析(FA)的更新数据,“双艾”组合一线治疗晚期肝癌具有显著的生存获益和可耐受的安全性,中位总生存期(mOS)达到23.8个月,患者生存获益再创新高。在所有获批肝细胞癌一线治疗适应症的方案中,“双艾”疗法成为迄今为止获得最长中位OS研究数据的治疗方案。
也正是基于上述结果,“双艾”疗法已在此前获得国家药监局(NMPA)批准用于不可切除或转移性肝细胞癌患者的一线治疗。此外,“双艾”疗法已获国家卫生健康委发布的《原发性肝癌诊疗指南(2024版)》和中国临床肿瘤学会(CSCO)发布的《原发性肝癌诊疗指南2024》推荐用于晚期肝细胞癌人群的一线治疗。2025年,该治疗方案又获肝细胞癌诊疗规范性指南之一《ESMO临床实践诊疗指南:肝细胞癌诊断、治疗、随访》的推荐用于晚期肝癌人群的一线治疗。
极具优异的临床数据让行业都认为“双艾”疗法在美上市也能稳了之时,第一次失利就猝不及防的来了。
2024年5月,恒瑞医药第一次收到该上市申请的完整回复信,FDA在回复信中表示,由于生产场地检查缺陷和部分国家的旅行限制,导致无法全部完成该项目必需的生物学研究监测计划(BIMO)临床检查,该申请无法在规定审查时间内得到批准。面对FDA的第一次“拒批”,恒瑞医药并未放弃,同年10月,其发布公告宣布已重新向FDA提交“双艾”疗法用于肝癌一线治疗的适应证上市申请并获受理,直至此次又再次“遭遇滑铁卢”。
另援引来自雪球的报道称,根据HLB公司透露的信息,此次“双艾”组合拒批原因与恒瑞苏州工厂未解决的生产缺陷有关。具体而言,此次FDA指出苏州盛迪亚生物医药有限公司(恒瑞全资子公司)存在的三大问题:微生物污染控制不严、目视检查协议不一致、自动化系统不完善。
恒瑞医药的生产场地被指出存在缺陷,这背后可能有着多方面的深层原因。包括可能源于其生产场地和设备未能及时跟上药品生产技术和FDA法规标准的发展变化,如无菌生产区域可能未达到FDA对空气质量和表面微生物污染的严格控制标准;同时,质量管理体系的执行力度不足,如质量控制部门对生产文档监督和控制不到位,未能及时发现和纠正偏差,也是导致生产场地合规问题的重要原因。
还有业内人士分析,尽管生产环节存在问题,但相比创新药在疗效或临床上出现的缺陷,这些问题相对容易解决。只要该药物的疗效具有创新性和临床价值,恒瑞医药和HLB就不会放弃在美国上市的尝试,而美国FDA也不会完全拒绝“双艾疗法”的上市申请。至于“双艾疗法”的在美上市何时才能“平安落地“,医谷网也将持续关注。
来源:医谷网
为你推荐
 资讯
资讯 2025“数据要素×”•行业样板发布:华山医院•联仁健康“医院数据资产化生态平台”成功入选
近日,由中国信息协会大数据分会主办,信息化观察网承办的2025数据要素融合与应用创新峰会在北京举办,并正式对外发布了2025“数据要素×”·行业样板100例。
2025-03-25 16:06
 资讯
资讯 全国肿瘤诊疗规范化提升行动启动会在京召开,夯实高质量肿瘤诊疗体系
2025年3月24日,由国家癌症中心学术支持,北京中康联公益基金会、辉瑞公司主办的全国肿瘤诊疗规范化提升行动启动会在北京召开,全国肺癌和肾癌规范化诊疗质控讲师培育计划也于...
2025-03-25 09:52
 资讯
资讯 生态赋能,新加坡助力全球企业迈向国际化新高度
本文将通过三家具有代表性的企业案例,解析新加坡如何利用其完善的产业生态体系,为全球医疗科技企业提供全方位支持,助力其全球化布局。
2025-03-25 09:35
 资讯
资讯 “关注睡眠健康 聚焦抗衰未来”2025睡眠与健康学术研讨会在四川成功举办
在第二十五个“世界睡眠日”到来之时,为促进国民健康、呼吁人们重视睡眠问题、树立“防未病”意识。2025年3月21日上午由中国保健协会健康管理专业委员会与四川天府亨特生命科技...
2025-03-24 16:54
 资讯
资讯 响应“体重管理年”行动,众安互联网医院助力国民科学减肥
在全民健康意识不断提升的当下,体重管理已成为社会各界关注的焦点。随着国家卫健委等部门对体重管理的重视,以及“体重管理年”行动的推进,越来越多的专业机构开始积极探索科...
2025-03-24 11:40
 资讯
资讯 万益特首次亮相中国发展高层论坛,以重要脏器疗法共筑中国健康未来
2025年3月23日,万益特全球首席执行官陶克瑞(Chris Toth)出席在北京举办的中国发展高层论坛2025年年会。
2025-03-24 11:10
 资讯
资讯 河南如何思考医保即时结算
河南省在统一实施路径基础上,统一增加按日(T+1)、隔日(T+3)、按周(T+7)的结算新模式,定点医药机构根据自身运行实际选择结算周期,而后通过月度结算、年度清算据实拨付;...
2025-03-22 22:30
 资讯
资讯 《提升中药质量促进中医药产业高质量发展的意见》发布
研究修订《野生药材资源保护管理条例》,完善分级保护制度。加强药用野生动植物物种就地和迁地保护。研究制定中药材种子管理办法。加强中药炮制技术传承创新,依法依规对特殊饮...
2025-03-22 11:41
 资讯
资讯 吉利德拓达维® (Trodelvy®)在中国获批用于治疗转移性激素受体阳性、人类表皮生长因子受体2阴性乳腺癌
拓达维®是全球首个获批的靶向Trop-2的抗体偶联药物(antibody-drug conjugate,ADC),2022年已在中国获批用于治疗既往至少接受过二种系统治疗(其中至少1种治疗针对转移性疾病...
2025-03-21 16:46
 资讯
资讯 蚂蚁集团加码医疗AI,发布医院、医生、用户三大产品体系升级
蚂蚁集团正加码AI医疗产业布局,3月21日,其对外公布了在医疗机构、医生、用户三端最新AI产品体系升级。其中,面向医疗机构,蚂蚁联合华为医疗卫生军团、阿里云等推出“蚂蚁医疗...
2025-03-21 16:03
 资讯
资讯 上海首家外商独资医院获颁证
据青浦商务官微信息,近日,上海德达医院已正式获上海市卫生健康委员会颁发“外商独资”医疗机构执业许可证,同时获得外商独资企业营业执照,成为医疗领域开展扩大开放试点政策...
2025-03-21 11:50
 资讯
资讯 维昇药业今日登陆港交所,募资逾1亿美元,成2025港股创新药第一股
成为2025年第一家在港股上市的创新药企业,同时也成为港股首家专注于生长发育及内分泌领域的上市公司。
2025-03-21 11:16
 资讯
资讯 2024年度药品审评报告(全文)
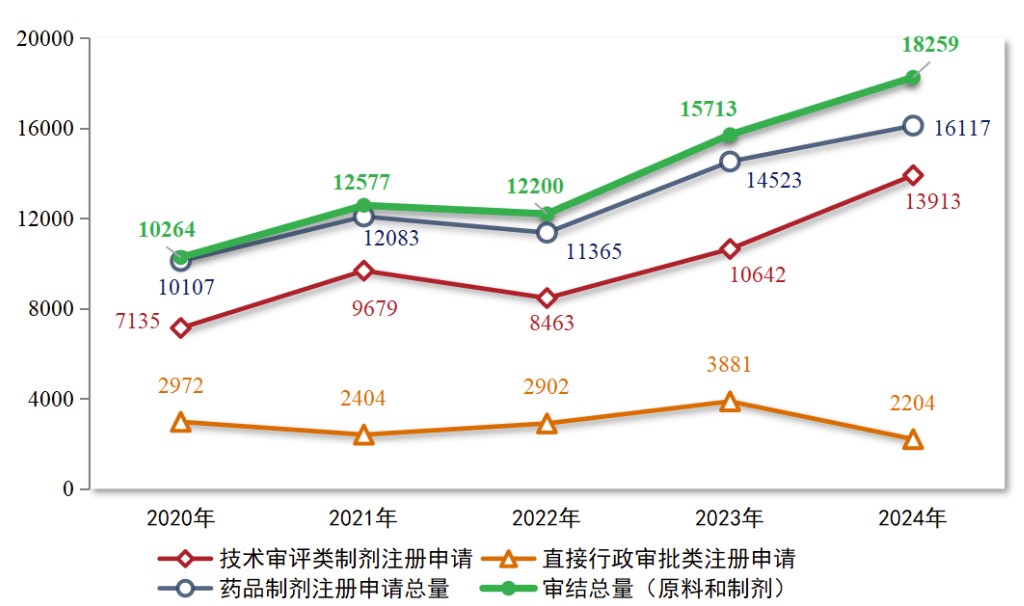
2024年,药审中心审结各类药品注册申请共18259件(同比增加16 20%),包括药品制剂注册申请16117件(同比增加10 98%),化学原料药注册申请2142件(同比增加80 00%)。
2025-03-20 21:30