近日,Autolus Therapeutics(以下简称“Autolus”)公司宣布,其自主研发的创新CD19靶向CAR-T疗法Aucatzyl(商品名,通用名为obecabtagene autoleucel或obe-cel)已成功获得美国FDA的上市批准,用于治疗复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)的成年患者。这也是FDA批准的第五款CD19 CAR-T疗法。
是新一代靶向CD19的CAR-T疗法
据了解,Aucatzyl作为一种自体来源、针对CD19的CAR-T细胞治疗产品,其独特设计在于拥有较快的靶点解离速率,这一特性旨在减轻工程化T细胞的过度活化状态,使其行为更接近自然状态下的T细胞,同时增强了其持续杀伤目标细胞的能力。
该疗法的获批依据主要来自于FELIX临床试验的数据支持。在该试验中,共有94名患者接受了至少一次Aucatzyl的输注治疗,其中65例患者在治疗前骨髓中原始细胞比例超过5%,并因此被纳入疗效评估。在这65名可评估疗效的患者中,有63%的患者实现了总体完全缓解(OCR),具体包括51%的完全缓解(CR)和12%的带有部分血液学恢复的完全缓解(CRi)。同时,有42%的患者在3个月内即达到完全缓解,且中位缓解持续时间(DOR)长达14.1个月。
不过,Aucatzyl的药品说明书上特别标注了FDA发布的最高级别安全警示——“黑框警告”,明确指出使用该药品可能伴随一系列严重风险,包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)以及T细胞恶性肿瘤。具体来说,有75%的患者在使用过程中出现了CRS(其中3%达到3级严重程度),64%的患者遭遇了神经系统毒性反应(其中12%达到或超过3级),而ICANS的发生率也达到了24%(其中7%为≥3级)。这些数据强调了在使用Aucatzyl时必须高度关注其潜在的安全性问题。
另值得一提的是,Aucatzyl的定价也是目前全球获批CAR-T细胞治疗产品中最高的,达52.5万美元。
部分CAR-T疗法前三季度销售业绩披露
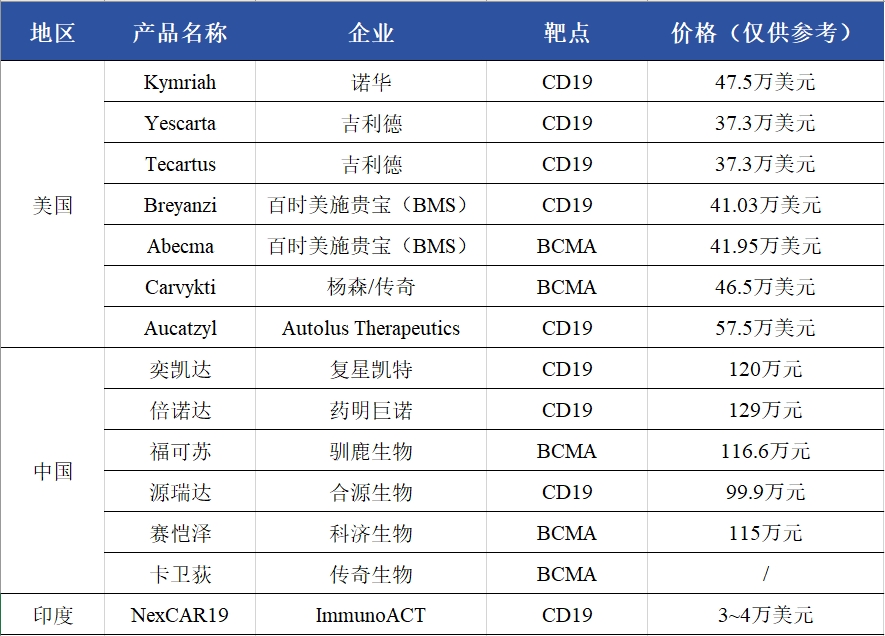
截止目前,在全球范围内,已有超10款CAR-T疗法获批上市,靶点均为CD19或BCMA。日前,随着各大药企相继发布2024年Q3业绩报,部分CAR-T疗法今年前三个季度的成绩单也相应出炉。
全球范围内获批上市的CAR-T疗法
其中,吉利德两款CAR-T疗法Yescarta和Tecartus第三季度的销售业绩分别为3.87亿美元和0.98亿美元,分别环比下降7%和8%,吉利德方面表示,销售额的下降反映了美国境内和境外竞争激烈,预计这种竞争将持续到2025年,公司将与政府机构和医疗保健协会合作,继续专注于扩大Yescarta、Tecartus的总体使用率。不过,今年前三个季度,Yescarta和Tecartus共计总销售额为14.86亿美元,同比增长了6%。
同样手握两款CAR-T疗法的百时美施贵宝则迎来了更好的发展的态势,其靶向CD19的CAR-T疗法Breyanzi第三季度全球销售业绩为2.24亿美元,同比增长143%,靶向BCMA的CAR-T疗法Abecma全球销售业绩为1.24亿美元,同比增长40%,两款产品在第三季度合计为百时美施贵宝贡献了3.48亿美元的业绩收入。
较早公布第三季度的强生,其与传奇生物合作开发的CAR-T疗法在2024年Q3销售额达到2.86亿美元,同比增长87.7%。加上第一季度1.57亿美元和第二季度1.86亿美元的销售业绩,今年前三季度,Carvykti的累计销售收入为6.29亿美元,同比增长84.3%。业内预计,Carvykti有望在2024年冲击10亿美元销售大关,迈入重磅炸弹药物行列。
再看看国内获批上市的CAR-T疗法方面,截止目前,国内已经有6款CAR-T疗法获批,分别是复星凯特的阿基仑赛、药明巨诺的瑞基奥仑赛、合源生物的纳基奥仑赛、科济药业的泽沃基奥仑赛、驯鹿生物的伊基奥仑赛和传奇生物的西达基奥仑赛,但并未有更多详细的业绩披露。
此外,在上个月的2024年国家医保药品目录调整谈判中,此前通过形式审阿基仑赛、瑞基奥仑赛、纳基奥仑赛注射液以及泽沃基奥仑赛全部止步于形式审查,没有通过专家评审,没有进入国谈的现场谈判环节。而在此前三次医保谈判中,CAR-T药物都受制于医保谈判“50万不谈,30万不进”规则,最后都未走上谈判桌。
来源:医谷网
为你推荐
 资讯
资讯 “全力治愈的春天音乐会”乳腺癌公益项目在南京暖心启航
3月7日,南京国民小剧场内,一场特殊的“疗愈音乐会”正在温暖上演。没有冰冷的医学术语,没有沉重的疾病阴霾,取而代之的是歌声、琴声、孩童的欢笑和患者含泪的拥抱。
2025-03-08 18:03
 资讯
资讯 部分企业未按要求上传价格承诺函被暂停相关产品采购资格
近日,上海市医药集中招标采购事务管理所发布通知,根据国家医疗保障局相关文件,因部分企业未按要求上传价格承诺函,即日起暂停部分别嘌醇片采购资格。
2025-03-08 10:19
 资讯
资讯 CDE:患者报告结局指标(PROs)用于风湿免疫性疾病临床试验的技术指导原则
患者报告结局( Patient- Reported Outcomes, PROs) 是指任何来自患者直接报告但不包括他人引申解读的对自身疾病和相应治疗感受的评估结局。 该理念对临床上症状复杂、反...
2025-03-07 21:51
 资讯
资讯 国内首款,瑞龙外科分体式手术机器人海山一获批上市
昨日(3月6日),瑞龙外科在其官微宣布,其自主研发的海山一腔镜手术机器人正式获得国家药监局上市批准(注册证编号:国械注准20253010500),不仅成为了国内上市的首款分体式腔镜...
2025-03-07 15:18
 资讯
资讯 无锡发布生物医药产业园区高质量发展若干政策措施
在锡医疗机构使用经认定的无锡产创新药、医疗器械、生物材料等产品,不纳入医疗机构药占比和耗占比的考核范围。对创新药品、新批准注册药品和纳入国家创新医疗器械特别审查程序...
2025-03-06 18:45
 资讯
资讯 罗氏制药中国携手京东健康赋能流感防治健康生态
今日(3月6日),罗氏制药中国与京东健康正式签署《流感防治生态共建深度合作协议》,标志着双方在流感防治领域的长期深化合作正式启动。此次合作将通过整合双方优势资源,依托...
2025-03-06 16:25
 资讯
资讯 诺和诺德计划在线药房半价销售减肥药司美格鲁肽
日前,诺和诺德表示,将通过一家新设立的直接面向消费者的在线药房——诺和关怀(NovoCare),以大幅低于正常价格的费用提供其畅销减肥药司美格鲁肽(Wegovy)。这一举措旨在让...
2025-03-06 12:20
 资讯
资讯 华东医药Sinclair欣可丽美学光学射频治疗仪V30注册申请获受理
V30是Sinclair的全资子公司Viora开发的集射频(RF)、强脉冲光(IPL)、Nd:YAG激光能量源为一体的医美多功能操作平台
2025-03-05 19:26
 资讯
资讯 坚守女性健康承诺,欧加隆多维度投资“她未来”
2025年3月8日,正值一年一度的国际劳动妇女节之际,全球领先女性健康企业欧加隆重申志在革新女性健康发展蓝图的企业愿景。
2025-03-05 15:30
 资讯
资讯 荣灿生物HPV治疗性mRNA疫苗获得FDA临床许可
近日,荣灿生物医药技术(上海)有限公司(以下简称“荣灿生物”)自主研发的人乳头瘤病毒(HPV)治疗性mRNA疫苗已获得美国食品药品监督管理局(FDA)的临床试验许可。该疫苗的...
2025-03-05 07:34
 资讯
资讯 一款国产重磅ADC药物上市申请延迟
近日,据国家药监局政务服务门户官网信息显示,乐普生物的重磅新药维贝柯妥塔单抗(MRG003)收到“药品通知件”。根据国内现行的新药审批流程,如果药物顺利获批,则会收到“药...
2025-03-05 07:06
 资讯
资讯 商务部:禁止因美纳向中国出口测序仪
3月4日,国家商务部宣布,禁止美国生物科技公司因美纳公司(Illumina, Inc )向中国出口基因测序仪。公告同时还表示,未尽事宜按《不可靠实体清单规定》执行, 且该公告自发...
2025-03-04 19:02
 资讯
资讯 专家科普围绝经期女性常见妇科问题及应对
围绝经期,又名更年期,是指妇女从成年进入老年期所必须经过的阶段,女性超过40岁以后,由于卵巢功能逐渐衰退,卵泡不能正常发育成熟及排卵
文/西安交通大学第一附属医院院长 邹余粮 2025-03-04 18:31
 资讯
资讯 拜耳•亦庄开放创新中心正式启动
作为首批入驻国际医药创新公园(BioPark)的6家外资企业之一,拜耳医药在2024国际生物医药产业创新北京论坛开幕式上宣布,将中国首个开放创新中心——拜耳•亦庄开放创新中心落...
2025-03-04 17:19
 资讯
资讯 百赛生物完成近亿元融资,华盖资本独家投资
这笔资金将用于加速百赛生物自主品牌产品线的建设,构建现代化供应链体系,以及加强数字化电商平台建设,全面提升其服务全球客户的能力。
2025-03-04 11:01