曾经的“港股18A第一股”,如今业绩归零。
近日,歌礼制药发布2024年上半年报,财报显示其期内收入为0,主要由于中国内地新冠肺炎疫情得到有效控制,导致利托那韦产品的市场需求收缩,因此公司于2024年上半年并无取得利托那韦产品销售收入;期内亏损增加687%至1.30亿元,主要由于研发成本的增加;期内研发成本约1.32亿元,同比增长43.5%。截止2024年6月30日,歌礼制药现金及现金等价物、定期存款、可转让存单、结构性存款、理财产品及在途银行存款约为21.17亿元,预计可支持其直至2028年的研发活动及运营。
上市产品颗粒无收
歌礼制药目前共有3款商业化产品,分别是丙肝药物达诺瑞韦钠片(商品名:戈诺卫)、拉维达韦片(商品名:新力莱),以及抗病毒药物利托那韦片。
其中,戈诺卫于2018年获批上市,是歌礼制药第一款获批产品,也是中国本土企业研发的首个1类靶向丙型肝炎创新药,在此之前国内丙肝药市场主要被吉利德、艾伯维、BMS、默沙东等占据,而戈诺卫的出现打破了这一垄断局面,而业界对其进入医保目录并实现“国产替代”也抱有极大期待。
但戈诺卫后续的商业化并不顺利。2019年的国家医保谈判,默沙东、吉利德、歌礼制药等的4款新型丙肝治疗方案共同竞争,最终默沙东的择必达(艾尔巴韦格拉瑞韦),吉利德的丙通沙(索磷布韦维帕他韦)、夏帆宁(来迪派韦索磷布韦)以超过85%的降幅进入国家医保乙类目录,而作为唯一入围谈判的国产丙肝药——戈诺卫,由于其使用时需与干扰素连用,报价时必须考虑罗氏干扰素的价格,最终错失市场机会。歌礼制药曾在官方公告中解释称“受方案中长效干扰素的价格限制,谈判没有成功。”
2020年,丙通沙、夏帆宁等成功续约而戈诺卫医保谈判再次失利,直到2021年戈诺卫终于进入医保,但此时已失去市场优势,且吉利德的“吉四代”索磷维伏片以及东阳光的磷酸依米他韦也一并进入医保,竞争激烈;同时,丙肝药市场经过多轮降价,利润空间已然有限。戈诺卫在2018年及2019年的销售额分别为7230万元及1.24亿元,之后便未有具体数据披露。
歌礼制药的第二款丙肝药物新力莱于2020年7月上市,是全口服无干扰素的慢性丙肝治疗方案,歌礼制药也曾对其寄予厚望,但因其需要和戈诺卫联用,因而销售效果也不佳。
抗新冠病毒药物利托那韦片于2021年9月在中国上市,在2022年国家卫健委发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》中,PF-07321332/利托那韦片(Paxlovid)被纳入诊疗方案。2023年利托那韦贡献了约0.494亿元收入,占比总营收超过80%,但随着新冠退潮,其市场也逐渐萎缩。
值得一提的是,2022年9月,歌礼制药发布公告称,基于罗氏对派罗欣在中国大陆地区市场策略的调整,歌礼制药与罗氏已达成一致,自12月31日起双方不再继续派罗欣在中国大陆地区市场的推广合作关系。这对歌礼制药而言是一个不小的打击,歌礼制药2021年销售总收入7688万元,其中超过90%的收入来自代理产品派罗欣,失去派罗欣也意味着其失去了一大收入来源。
2018年至2023年,歌礼制药的营收分别为1.66亿元(+212.6%)、1.73亿元(+4.3%)、3500万元(-79.8%)、7688万元(+119.64%)、5409万元(-29.6%)、5660万元(+4.6%),总体营收不断减少。2024年上半年,中国内地新冠肺炎疫情得到有效控制,利托那韦产品的市场需求收缩,歌礼制药的期内收入直接降为零。
多次砍管线,押注MASH赛道
在公司营收下降、亏损不断累计的情况下,去年以来歌礼制药多次砍掉研发管线。
2023年6月,歌礼制药终止2款新药临床开发,分别是用于治疗肝癌的候选药物ASC06以及HIV蛋白酶抑制剂候选药物ASC09。对于终止原因,公告称歌礼制药曾寄望于将ASC06开发为通过使用RNA干扰递送技术治疗肝癌的首个系统性递送治疗药物,然而由于该领域很多公司开发的RNA干扰递送技术近期取得重大进展,ASC06的RNA干扰递送技术成为早期技术已经过时,因此决定不再继续研发;ASC09方面,该药拟开发用于治疗HIV 1型感染,然而,治疗相同适应症的替代产品已在中国获批上市,并已成为主流药物,且表现出更佳的疗效、安全性及耐药性,与同类替代品比较ASC09可能已没有竞争优势,因而决定终止研发。
今年4月,歌礼制药决定终止ASC42治疗原发性胆汁性胆管炎(PBC)的临床试验,因为试验结果表明,与目前处于开发和注册阶段的新型PBC候选药物相比,ASC42未显示出竞争优势。同时歌礼药物也不再继续开展ASC42联用治疗非酒精性脂肪性肝炎(NASH)的临床研究(ASC43F),以及ASC42治疗乙肝的临床研究。
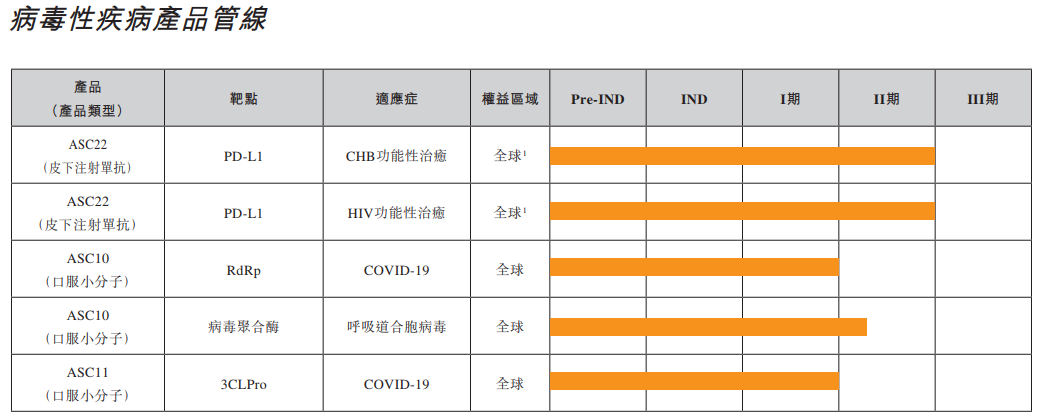
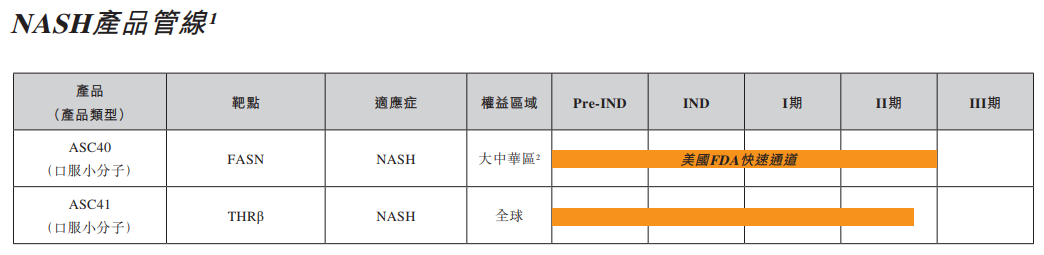
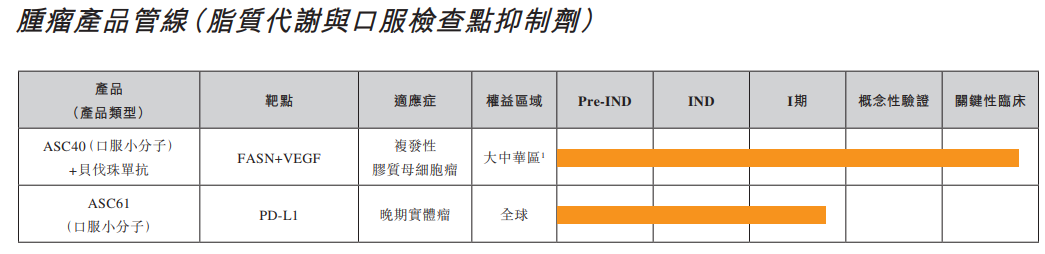
目前歌礼制药的管线主要聚焦病毒性疾病、非酒精性脂肪性肝炎、肿瘤等领域。
目前歌礼制药主要聚焦在两款功能障碍相关脂肪性肝炎(MASH)治疗药物——脂肪酸合成酶(FASN)抑制剂ASC40以及甲状腺激素β受体(THR-β)激动剂ASC41方面。
近年来MASH一直是药物研发热点,据弗若斯特沙利文预计,MASH全球市场规模将在2030年突破300亿美元,但MASH发病机制复杂,直到今年3月FDA才批准了近40年来首款MASH药物——Madrigal公司的口服小分子药物Rezdiffra。在国内,众生药业、正大天晴、四环医药、石药集团、豪森药业等均在布局该领域。
歌礼制药方面,半年报显示,在一项针对168例纤维化2期或3期的NASH患者进行的52周临床试验中,ASC40在主要终点及多个次要终点均取得了统计学显著性差异的结果。主要疗效终点包括:地尼法司他治疗组36%的患者达到NASH改善且纤维化无恶化且NAS降低≥2分,而安慰剂组为13%(p=0.002);及地尼法司他治疗组52%的患者达到NAS降低≥2分且纤维化无恶化,而安慰剂组为20%(p=0.0001)。ASC40总体耐受性良好。
ASC41方面,在经肝穿活检证实的NASH患者中开展的II期临床试验显示,服用ASC41片的患者肝脏脂肪含量降低与服用安慰剂的患者相比具有统计学显著性差异。在服用ASC41片的患者中,高达93.3%的患者肝脏脂肪含量较基线相对降低30%及以上,肝脏脂肪含量降低30%及以上与患者实现NASH组织学改善高度相关,尤其是对THRβ激动剂治疗的患者而言。
为你推荐
 资讯
资讯 无锡发布生物医药产业园区高质量发展若干政策措施
在锡医疗机构使用经认定的无锡产创新药、医疗器械、生物材料等产品,不纳入医疗机构药占比和耗占比的考核范围。对创新药品、新批准注册药品和纳入国家创新医疗器械特别审查程序...
2025-03-06 18:45
 资讯
资讯 罗氏制药中国携手京东健康赋能流感防治健康生态
今日(3月6日),罗氏制药中国与京东健康正式签署《流感防治生态共建深度合作协议》,标志着双方在流感防治领域的长期深化合作正式启动。此次合作将通过整合双方优势资源,依托...
2025-03-06 16:25
 资讯
资讯 诺和诺德计划在线药房半价销售减肥药司美格鲁肽
日前,诺和诺德表示,将通过一家新设立的直接面向消费者的在线药房——诺和关怀(NovoCare),以大幅低于正常价格的费用提供其畅销减肥药司美格鲁肽(Wegovy)。这一举措旨在让...
2025-03-06 12:20
 资讯
资讯 华东医药Sinclair欣可丽美学光学射频治疗仪V30注册申请获受理
V30是Sinclair的全资子公司Viora开发的集射频(RF)、强脉冲光(IPL)、Nd:YAG激光能量源为一体的医美多功能操作平台
2025-03-05 19:26
 资讯
资讯 坚守女性健康承诺,欧加隆多维度投资“她未来”
2025年3月8日,正值一年一度的国际劳动妇女节之际,全球领先女性健康企业欧加隆重申志在革新女性健康发展蓝图的企业愿景。
2025-03-05 15:30
 资讯
资讯 荣灿生物HPV治疗性mRNA疫苗获得FDA临床许可
近日,荣灿生物医药技术(上海)有限公司(以下简称“荣灿生物”)自主研发的人乳头瘤病毒(HPV)治疗性mRNA疫苗已获得美国食品药品监督管理局(FDA)的临床试验许可。该疫苗的...
2025-03-05 07:34
 资讯
资讯 一款国产重磅ADC药物上市申请延迟
近日,据国家药监局政务服务门户官网信息显示,乐普生物的重磅新药维贝柯妥塔单抗(MRG003)收到“药品通知件”。根据国内现行的新药审批流程,如果药物顺利获批,则会收到“药...
2025-03-05 07:06
 资讯
资讯 商务部:禁止因美纳向中国出口测序仪
3月4日,国家商务部宣布,禁止美国生物科技公司因美纳公司(Illumina, Inc )向中国出口基因测序仪。公告同时还表示,未尽事宜按《不可靠实体清单规定》执行, 且该公告自发...
2025-03-04 19:02
 资讯
资讯 专家科普围绝经期女性常见妇科问题及应对
围绝经期,又名更年期,是指妇女从成年进入老年期所必须经过的阶段,女性超过40岁以后,由于卵巢功能逐渐衰退,卵泡不能正常发育成熟及排卵
文/西安交通大学第一附属医院院长 邹余粮 2025-03-04 18:31
 资讯
资讯 拜耳•亦庄开放创新中心正式启动
作为首批入驻国际医药创新公园(BioPark)的6家外资企业之一,拜耳医药在2024国际生物医药产业创新北京论坛开幕式上宣布,将中国首个开放创新中心——拜耳•亦庄开放创新中心落...
2025-03-04 17:19
 资讯
资讯 百赛生物完成近亿元融资,华盖资本独家投资
这笔资金将用于加速百赛生物自主品牌产品线的建设,构建现代化供应链体系,以及加强数字化电商平台建设,全面提升其服务全球客户的能力。
2025-03-04 11:01
 资讯
资讯 依诺基科成功完成近1.5亿元A轮融资,加速合成生物学产品研发与产业化进程
依诺基科是一家致力于合成生物学研发及产业化的创新型企业,产品覆盖天然香料、医药大健康、生物基化学品等多个领域。
2025-03-03 13:58
 资讯
资讯 美国首款干细胞药物定价公布,国内获批的首款干细胞药物会如何跟进
近日,澳大利亚生物技术公司Mesoblast在官网资讯中公布了其间充质基质细胞(MSC)疗法Ryoncil的定价,即单次输注价格为19 4 万美元(与体重无关),整个疗程需要8次输注(Ryon...
2025-03-03 08:33
 资讯
资讯 辽宁开展挂网药品价格自查,企业3月17日前需完成
挂网价格高于其他省市挂网价格的情形;同企业药品不同规格、包装之间不符合差比价规则,特别是存在价格倒挂情形的;同通用名药品仿制药挂网价格高于参比制剂的;挂网价格明显高...
2025-03-02 19:37
 资讯
资讯 新修订的《北京市药品零售企业许可管理规定》
开办药品零售企业,营业场所使用面积不少于70平方米。在农村乡镇以下地区开办药品零售企业的,营业场所使用面积不少于40平方米。开办仅经营非处方药或仅经营同一品牌的药品零售...
2025-03-02 16:53