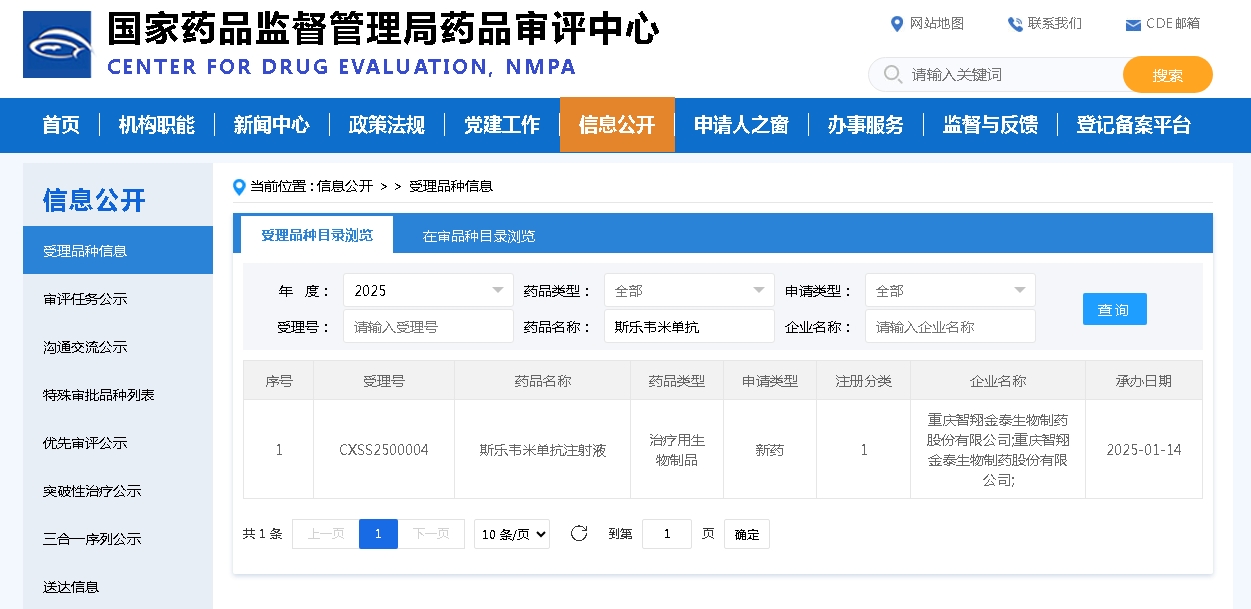
近日,国家药审中心发布受理共性问题。针对——
纳入优先的药品制剂使用单独审评的原料药,原料药的审评时限如何管理?
《药品注册管理办法》第九十六条规定,“关联审评时限与其关联药品制剂的审评时限一致”。登记人在原料药登记表“3. 审评程序”选择“单独审评(仿制境内已上市药品所用的化学原料药)”的 ,审评时限为200天, 选择“与制剂申请关联审评”的,审评时限其关联药品制剂的审评时限一致。
来源:CDE
为你推荐
 资讯
资讯 “和合共生,健康共护”四价HPV疫苗男性适应证上市暨“HPV男女共防计划”启动新闻发布会成功举办,共筑HPV预防新生态
今日(1月18日),默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)举办的“和合共生,健康共护”四价HPV(人乳头瘤病毒)疫苗男性适应证上市暨“HPV男女共防计划”启动...
2025-01-18 18:31
 资讯
资讯 四同药品价格治理已基本实现,正建设全国挂网药品价格一览表
目前,我们正在建设全国挂网药品价格一览表,全量汇总展示各地挂网价格信息并对首涨、高涨幅等异常价格行为予以标识,敦促各地持续纠正不合理的挂网高价。
2025-01-18 12:15
 资讯
资讯 2025年全国80%左右医保统筹地区基本实现即时结算,2026年底全部实现即时结算
1月16日,国家医疗保障局办公室正式对外发布《关于推进基本医保基金即时结算改革的通知》。根据通知,以全国统一的医保信息平台为支撑,2025年全国80%左右统筹地区基本实现即时...
2025-01-18 11:20
 资讯
资讯 2024年底,60岁及以上人口3.1亿,占全国人口的22.0%
年末全国人口(包括31个省、自治区、直辖市和现役军人的人口,不包括居住在31个省、自治区、直辖市的港澳台居民和外籍人员)140828万人,比上年末减少139万人。全年出生人口954...
2025-01-17 14:56
 资讯
资讯 赛诺菲荣膺“杰出雇主2025”桂冠,连续五年傲立榜首
作为10多年来首个且唯一连续五年荣获此殊荣的企业,赛诺菲再次彰显了其在企业文化、人才战略、多元发展及员工培养等方面的卓越成就。
2025-01-17 11:02
 资讯
资讯 又一款国产三代EGFR-TKI抑制剂获批上市
昨日(1月16日),据国家药监局官网显示,奥赛康药业的1类创新药利厄替尼片(limertinib ASK120067,商品名:奥壹新)获批上市,用于治疗既往接受表皮生长因子受体酪氨酸激酶抑制...
2025-01-17 10:31
 资讯
资讯 增辉生命,默沙东中国再度荣膺“中国杰出雇主”
1月16日,由全球权威的杰出雇主调研机构(Top Employers Institute)颁布的“杰出雇主2025”榜单正式揭晓
2025-01-16 22:48
 资讯
资讯 国家市场监督管理总局发布《医药企业防范商业贿赂风险合规指引》
本指引所称的商业贿赂, 是指采用财物或者其他手段贿赂交易相对方的工作人员、 受交易相对方委托办理相关事务的单位或者个人、 利用职权或者影响力影响交易的单位或者个人,...
2025-01-14 23:38
 资讯
资讯 阿斯利康与宜联生物达成临床研究合作,共同探索联合治疗创新方案
双方将共同启动一项多中心、开放性、I Ib期研究,旨在评估两款药物联合治疗在实体肿瘤患者中的安全性、有效性和药代动力学。
2025-01-14 18:36
 资讯
资讯 NVIDIA与多家行业顶尖机构达成深度合作,共促医疗健康产业蓬勃发展
在日前举办的摩根大通医疗健康大会上,NVIDIA 宣布与多家行业领先机构达成合作,这类新的合作旨在通过加速药物发现、提升基因组研究,以及利用代理式和生成式 AI 开创先进医...
2025-01-14 13:26
 资讯
资讯 老牌上市药企终止PD-1项目,计提资产减值准备1.75亿元
近日,丽珠医药集团发布公告称,对公司及下属子公司截至2024年12月31日合并报表范围内存在减值迹象的资产进行了减值测试,并对其中存在减值迹象的资产相应计提了减值准备。
2025-01-14 10:13
 资讯
资讯 尊享e生2025升级:首次全场景放开外购药械,医院药品覆盖数量再增
1月13日,众安保险举办“与10光,共生长”尊享e生十周年产品升级发布会,正式发布尊享e生2025版,并推出众安健康险未来将主打的两大产品系列——面向健康人群的“尊享系列”,以...
2025-01-13 20:17
 资讯
资讯 PLA材料的医美应用:安全与效果的双重考验
聚乳酸PLA,作为医美行业面部填充剂历经了3个时代大约20多年的发展,大体可分为1 0、2 0、3 0三个不同的时代;即1 0-结晶片状;2 0-普遍表面粗糙的多孔微球或实心微球;3 ...
2025-01-13 19:53
 资讯
资讯 国家医保局:开展2025年定点医药机构违法违规使用医保基金自查自纠工作,肿瘤类、重症医学类、麻醉类、零售药店典型问题清单
2025年3月底前,各级医保部门根据本地化问题清单,对辖区内所有定点医疗机构和定点零售药店2023-2024年医保基金使用情况开展自查自纠。2025年4月起,国家医保局将对全国定点医药...
2025-01-13 17:32
 资讯
资讯 好大夫正式牵手蚂蚁集团,共同推进“AI+医疗”创新
蚂蚁集团收购好大夫在线尘埃落定。1月11日,在2025年好大夫峰会上,双方在收购完成后首度携手亮相。好大夫在线创始人王航现场表示,共同的使命和愿景让双方走到了一起,后续好大...
2025-01-11 18:05