近日,和铂医药发布了2023年财报,报告显示,和铂医药实现总收入同比增长119.9%至8950万美元(约合人民币6.47亿元),全年总盈利2276万美元(约合人民币1.65亿元),同比扭亏为盈,这也是和铂医药自上市以来首次实现年度财务盈利。值得一提的是,和铂医药目前尚无任何产品实现商业化。
首次实现年度盈利
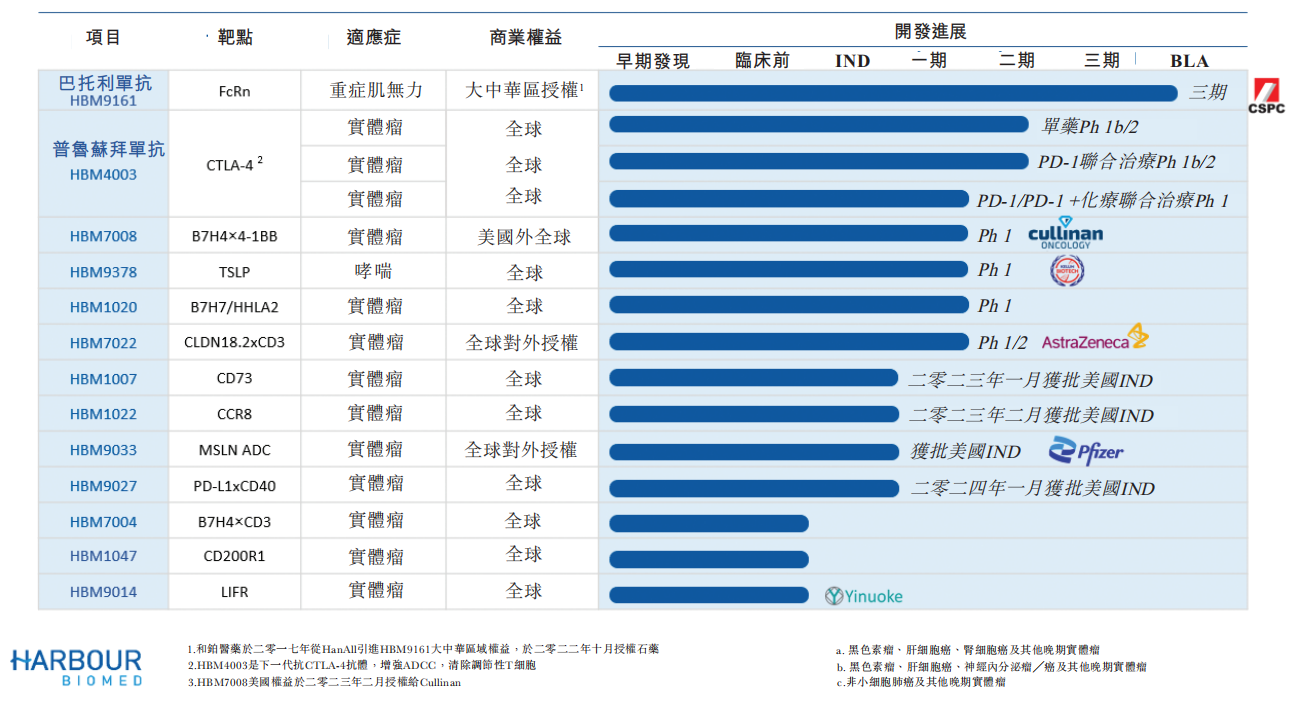
和铂医药成立于2016年,专注于肿瘤及免疫性疾病领域创新药的研发,2020年12月,和铂医药在港交所上市,目前拥有超过10种专注于肿瘤与免疫性疾病的候选药物,均处于临床前阶段至临床后期阶段。财报显示,和铂医药目前尚无任何产品实现商业化,2023年和铂医药收入来源主要包括分子许可费、研究服务费及技术许可费,收入的增长主要是与辉瑞、Cullinan等的授权合作协议。
2023年2月,和铂医药与Cullinan签订授权及合作协议,根据该协议,Cullinan获得在美国及其领土和属地(包括哥伦比亚地区和波多黎各)开发HBM7008的独家可转许可的授权,和铂医药获得2500万美元预付款和最高达6亿美元里程碑付款。资料显示HBM7008是一款B7H4和4-1BB靶点的双特异性抗体,其在美国和澳大利亚的I期临床试验已于2022年启动。
2023年12月,和铂医药子品牌诺纳生物与Seagen(辉瑞)就HBM9033的全球临床开发及商业化签订授权协议,并可获得总额为5300万美元的预付款及近期付款和最高达约10.5亿美元的里程碑付款。
其他产品方面,目前和铂医药进展进展最快的为FcRn抑制剂巴托利单抗,2023年3月和铂医药宣布巴托利单抗治疗全身型重症肌无力(gMG)的III期临床试验结果符合主要研究终点及关键次要研究终点。2023年6月该药治疗gMG的上市申请获国家药监局受理。
进度排在第二位的是普鲁苏拜单抗,财报显示该药正在二期临床阶段,据悉,该药也是全球首个进入临床研究的全人源重链CTLA-4抗体,目前正在进行中的神经内分泌瘤和肝细胞癌试验已在疗效和安全性方面读出积极数据。此外,HBM1020、HBM1022、HBM1007和HBM9033均已于2023年获得美国FDA的IND许可,HBM9027已于2024年第一季度获得美国FDA的IND许可。
缩减开支
一方面是“开源”,另一方面和铂医药也进行了“节流”。财报显示,2023年和铂医药研发费用、管理费用分别为4508万美元、1950万美元,分别同比下降66.6%,下降28.6%。
此外,此前的2022年10月,和铂医药宣布一停一“卖”两个核心药物,包括结束用于干眼病治疗的特那西普的三期临床试验,以及将巴托利单抗“卖”给石药集团,获得包括1.5亿元首付款、最多4亿元开发里程碑付款等其他里程碑付款;同时为了更快地回笼资金,改善现金流,2022年11月和铂医药宣布以1.46亿元将有关生物大分子研发创新中心项目的生产厂房出售给苏州药明海德生物。
截至目前,和铂医药现金与现金等价物余额为1.40亿美元(约合人民币10.12亿元)。
多家药企依靠授权出海实现盈利
近年来,多家药企实现创新药出海,并依靠授权实现盈利。
今年2月,和黄医药发布2023年财报,报告显示公司总收入增长97%至8.38亿美元,肿瘤/免疫业务综合收入增长223%至5.286亿美元,接近财务指引上限,包括确认自武田收取的首付款中的2.8亿美元。和黄医药应占净收益达到1.008亿美元。2023年1月,和黄医药将旗下VEGFR抑制剂呋喹替尼除中国内地、香港及澳门外的全球权益授权给了日本武田制药,首付款高达4亿美元,总额可达11.3亿美元,创下中国小分子新药出海授权交易的新高。此次,和黄医药迎来近五年来首度扭转亏损的局面,很大程度上离不开其创新药品呋喹替尼的成功“出海”。
今年3月,康方生物的2023年财报显示,其营业收入45.26亿元,较上年增长440%;净利润从上年亏损14.22亿元转为年度盈利19.42亿元,首次实现年度盈利。康方生物扭亏为盈的关键之一在于对外授权的收益。2022年12月,康方生物与Summit Therapeutics就PD-1/VEGF双抗依沃西的全球开发达成合作,康方生物获得5亿美元的首付款及最高可达50亿美元的总交易金额。2023年第一季度,康方生物收到总计约5亿美元的首付款,该首付款中的大部分已在报告期内被确认为许可费收入,达29亿元。
此外,今年3月百利天恒发布公告称,已收到与百时美施贵宝就ADC产品BL-B01D1开发与商业化许可协议8亿美元首付款(约合人民币57.84亿元),百利天恒药方面称,该款项将对该公司2024年业绩产生积极影响。
为你推荐
 资讯
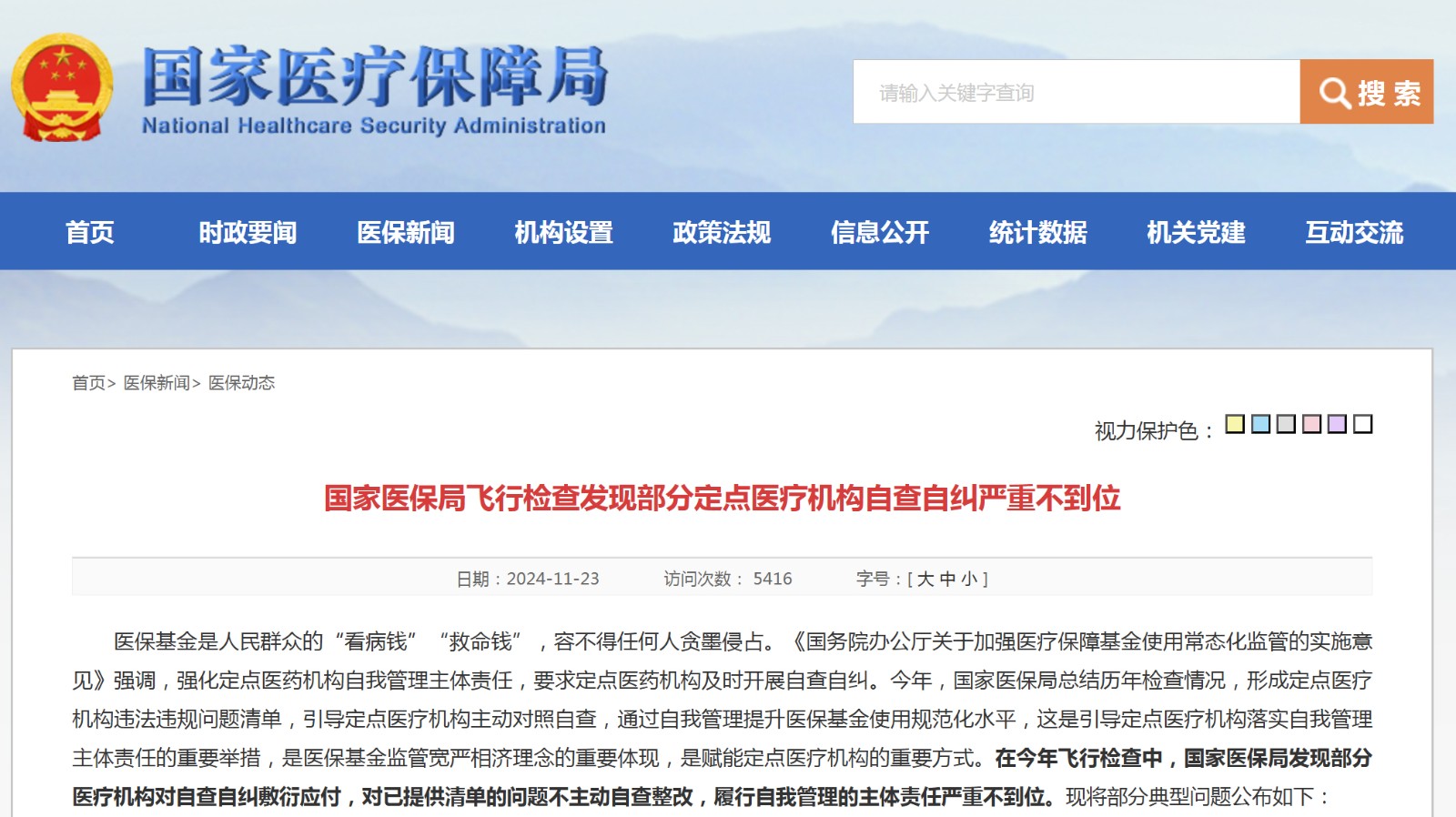
资讯 国家医保局公布7家医院飞行检查自查自纠严重不到位
在今年飞行检查中,国家医保局发现部分医疗机构对自查自纠敷衍应付,对已提供清单的问题不主动自查整改,履行自我管理的主体责任严重不到位。
2024-11-25 18:14
 资讯
资讯 全球首款IDH双靶点创新药在博鳌乐城实现“亚洲首用” ——Vorasidenib落地华西乐城医院并启动筹备真实世界研究
近日,由四川大学华西乐城医院、海南乐城真实世界研究院主办、施维雅中国支持的“Vorasidenib华西乐城医院落地启动暨筹备真实世界研究会”在华西乐城医院举行,宣布华西乐城医院...
2024-11-25 17:11
 资讯
资讯 包装循环利用,无碍患者健康:肖特医药、Corplex和武田制药成功展示闭环回收系统
近日,药物包装及给药解决方案供应商肖特医药,运输包装设计、制造和回收利用领域的翘楚Corplex公司,全球领先的生物制药企业武田制药,正开展合作共同推进制药行业的循环经济解...
2024-11-25 15:24
 资讯
资讯 天猫国际第四餐与庶正康讯联合发布《营养抗衰白皮书——麦角硫因》
面对全球人口老龄化的挑战,营养抗衰成为健康领域的一大热点。随着科学研究的深入和生物技术的突破,营养抗衰成分和产品不断涌现。为了促进营养抗衰市场的稳健发展,保护消费者权益...
2024-11-25 14:23
 资讯
资讯 星汉德生物SCG101一期临床革命性突破:乙肝根源性清除无复发,实现真正功能性治愈
星汉德生物(SCG)公布了全球首创针对乙肝病毒表面抗原(HBsAg)特异性的自体T细胞受体 TCR-T细胞治疗产品SCG101最新突破性一期临床研究数据
2024-11-25 09:04
 资讯
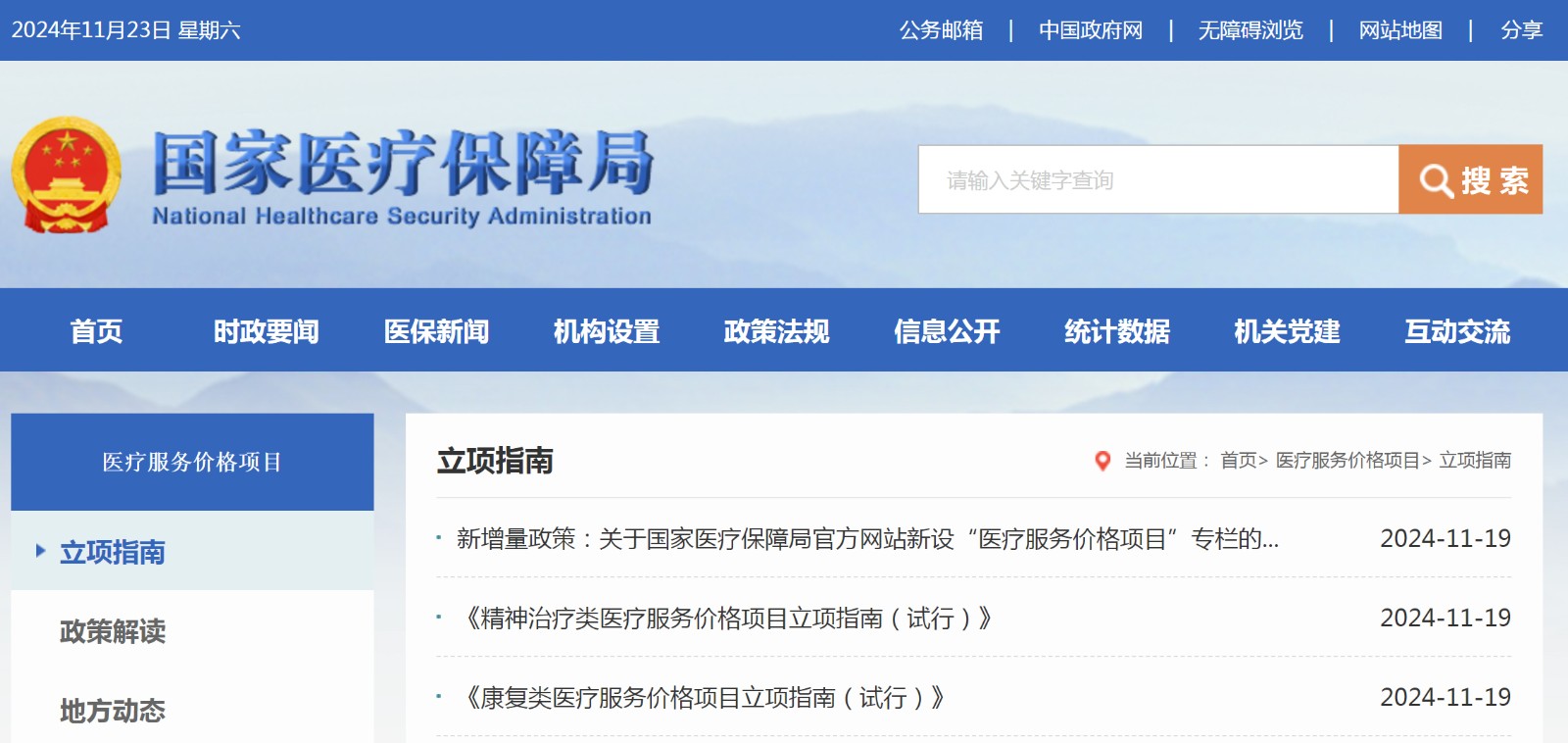
资讯 国家医保局官网新增“医疗服务价格项目”专栏
目前,国家医保局正以编制出台医疗服务价格项目立项指南的方式,统一指导各地规范医疗服务价格项目,现已印发护理、综合诊查、康复等17批立项指南。
2024-11-23 12:16
 资讯
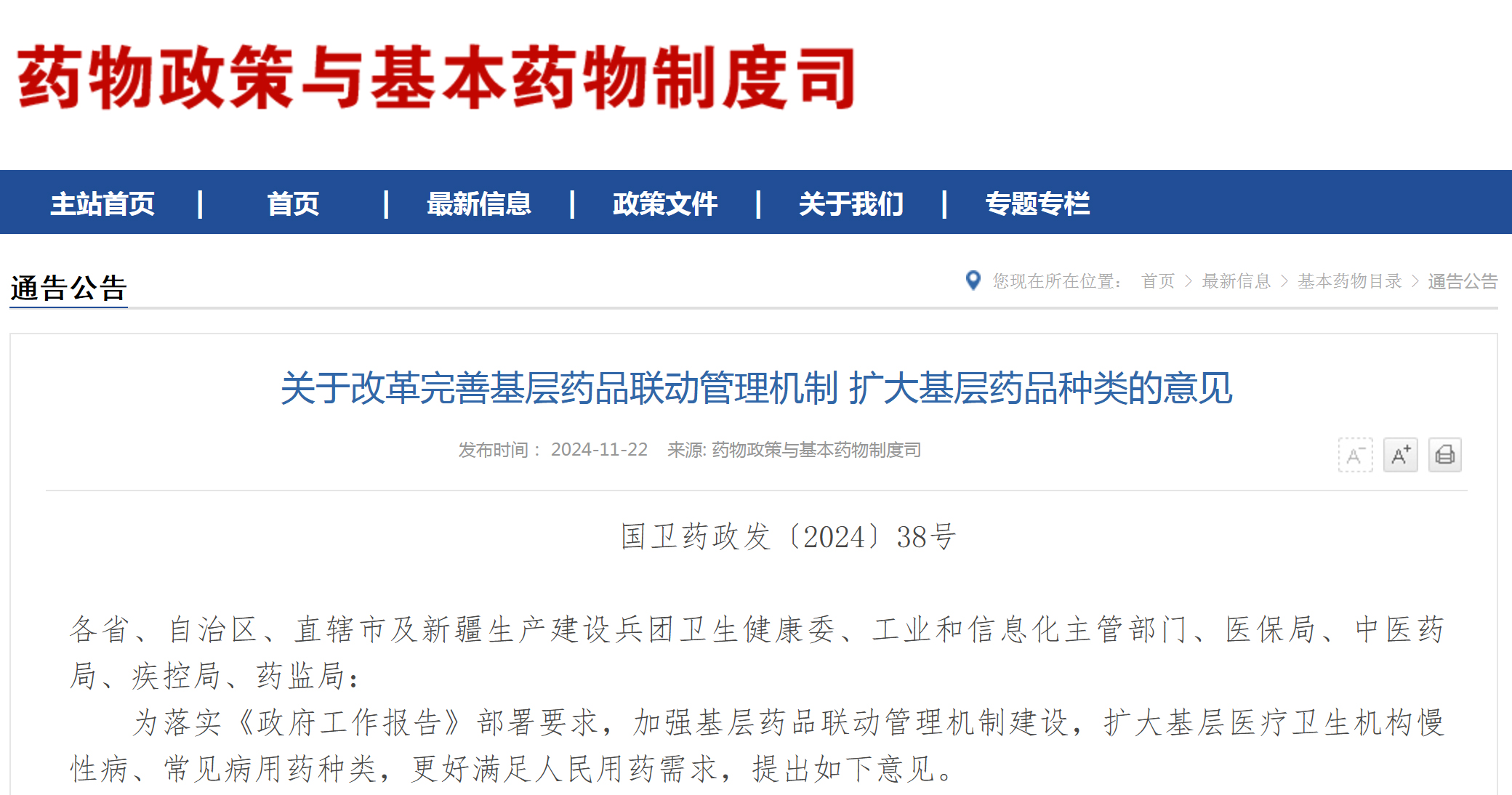
资讯 国家卫健委、工信部、国家医保局等六部门联合印发扩大基层药品种类的意见
11月22日,国家卫健委、工信部、国家医保局等六部门联合印发《关于改革完善基层药品联动管理机制 扩大基层药品种类的意见》。
2024-11-23 11:51
 资讯
资讯 限制B证,增加复活机制,第十批国家药品集采文件正式发布
11月22日晚间,第十批药品集中采购文件正式对外发布,根据文件显示,此次集采将于12月12日在上海市奉贤区进行报价。采购周期自中选结果执行之日起至2027年12月31日,与此前与第...
2024-11-23 11:18
 资讯
资讯 恩凯赛药完成数千万元A++轮融资,加速推进NK细胞免疫产品管线
近期,恩凯赛药(上海恩凯细胞技术有限公司)宣布完成数千万元A++轮融资,本轮融资由三生制药领投,张科禾润、易津资本等跟投。本轮募集的资金将用于加速推进恩凯赛药在研产品管...
2024-11-22 09:22
 资讯
资讯 CDE:细胞治疗产品临床药理学研究技术指导原则(试行)
本指导原则所涵盖的细胞治疗产品是指来源、操作和临床试验过程符合伦理要求,按照药品管理相关法规进行研发和注册申报,用于治疗疾病的人体来源活细胞产品。
2024-11-21 22:11
 资讯
资讯 又一款针对晚期肺癌的创新药获批上市
日前,根据国家药监局官网信息显示,晨泰医药申报的1类创新药盐酸佐利替尼片(商品名:泽瑞尼)获批上市,用于具有表皮生长因子受体(EGFR)19号外显子缺失或外显子21(L858R)...
2024-11-21 16:04
 资讯
资讯 万泰生物九价HPV疫苗男性临床试验申请获批
近日,万泰生物发布公告称,公司全资子公司厦门万泰沧海生物技术有限公司(下简称:万泰沧海生物)收到国家药品监督管理局下发的《药物临床试验通知书》(通知书编号:2024LP025...
2024-11-21 13:31
 资讯
资讯 百济神州,达成了一项和解
近日,百济神州美股发布临时公告宣布,其两家子公司BeiGene USA,Inc 和BeiGene Switzerland GmbH(与百济神州有限公司合称“百济神州”)与MSN Pharmaceuticals,Inc 和MSN...
2024-11-21 08:54
 资讯
资讯 TPP亚太区总裁叶惠琦:以AI赋能医疗,推动“一人一生一份电子病历”理念中国落地
作为英国NHS(英国国家医疗卫生体系)首选的医疗解决方案与服务供应商,TPP凭借其前沿的理念和创新的技术,正加速在中国市场深耕,推动中国医疗服务的信息化、智慧化进程。
文/张蓉蓉 2024-11-20 15:51
 资讯
资讯 将获超4000万美元现金付款,博奥信2款自免资产授权出海
日前,博奥信生物宣布与Aclaris Therapeutics就BSI-045B和BSI-502达成全球(除大中华区外)独家授权协议。根据协议条款,博奥信将获得超过4000万美元的现金付款,作为首付款以...
2024-11-20 14:19
 资讯
资讯 因美纳宣布扩展TruSight Oncology产品线
最新解决方案将亮相于分子病理学协会年度会议,以实现对肿瘤的全景变异分析。由因美纳客户主导的研究和分享将提供最新的肿瘤分析证据和相关内容。
2024-11-20 10:01