近日,据国家药监局药审中心官网信息显示,礼来用于早期阿尔茨海默病(AD)患者的治疗的抗体新药Remternetug注射液拟纳入突破性疗法,今年1月,礼来的另外一款AD新药Donanemab注射液也被纳入突破性治疗品种名单。
公开资料显示,Remternetug是一款在研IgG1单克隆抗体,靶向仅存在于脑淀粉样蛋白斑块中的淀粉样β肽第3个氨基酸的焦谷氨酸修饰,目前正在开展治疗早期症状性阿尔茨海默病的国际多中心(含中国)3期临床试验。Remternetug采用灵活的给药方案,包括皮下给药,以满足阿尔茨海默病患者的不同需求。礼来曾表示,Remternetug是Donanemab的后续产品,属于“下一代N3pG淀粉样蛋白抗体”。
在近期举行的2023年阿尔茨海默病和帕金森病国际会议(AD/PD 2023)上,礼来公布了Remternetug一项名为J1G-MC-LAKB的多中心、随机、双盲1期临床试验的中期分析结果。
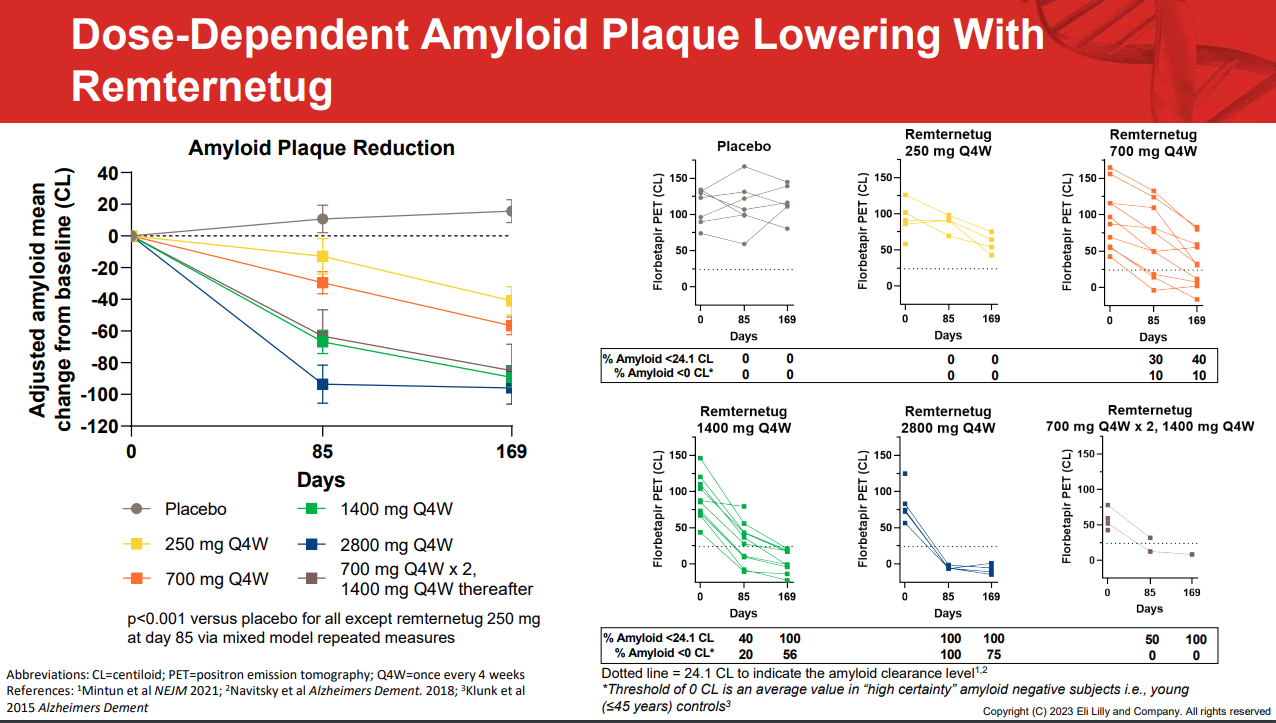
中期分析包括41名患有轻度认知障碍或轻度至中度阿尔茨海默病痴呆的受试者,患者随机接受安慰剂或不同剂量的Remternetug输注,包括250 mg组、700 mg组、1400 mg组、700-1400 mg组、2800 mg组、每4周一次,然后在第85天和第169天通过正电子发射断层扫描(PET)成像进行检视。
结果显示,Remternetug产生了“快速而强大”的斑块清除能力,具体而言,在试验所有给药组中均观察到淀粉样蛋白呈剂量依赖性降低,虽然较小的250 mg剂量在第85天的应答程度低于较高剂量组。但到了169天,24例接受治疗的患者中有18人实现了淀粉样蛋白清除。
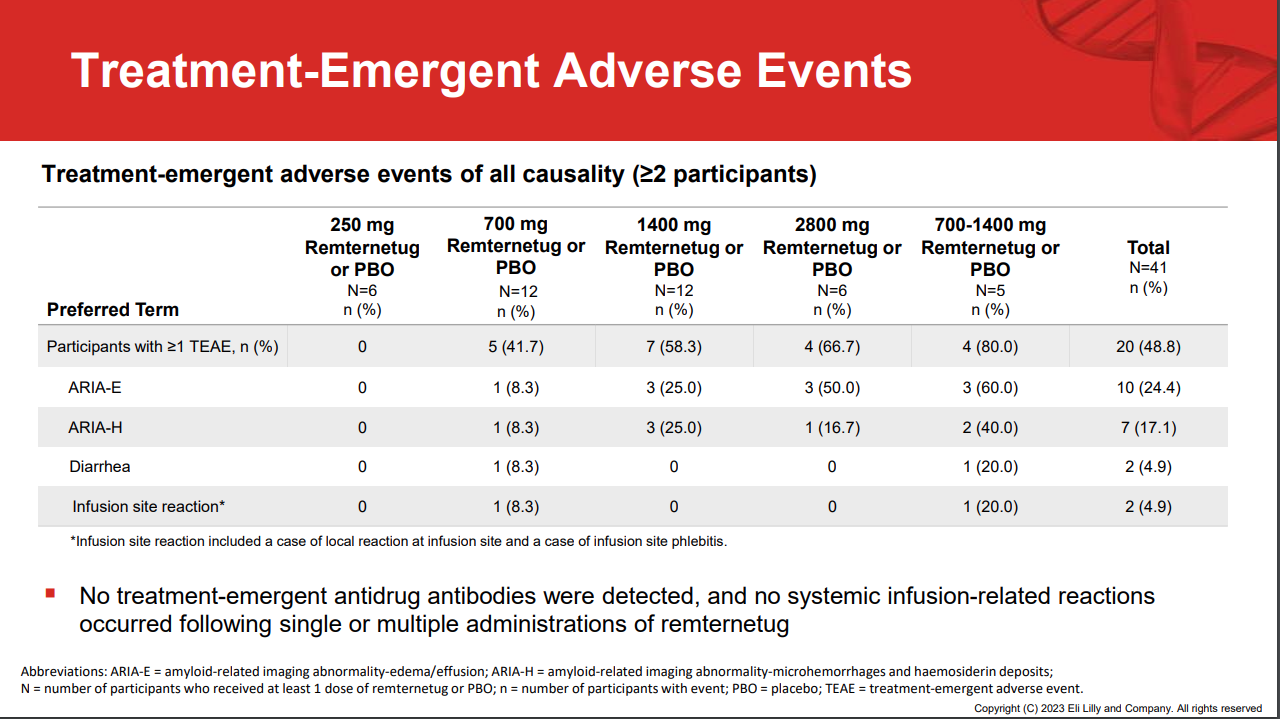
安全性方面,礼来报告了淀粉样蛋白相关成像异常(ARIA)类别的常见副作用,该试验中,41例患者中有10例ARIA,其中700-1400 mg剂量队列中有1例受试者发生了严重不良反应ARIA-E(脑水肿)和ARIA-H(微出血),并产生失语、失衡和视野缺损等情形。此外,在所有的研究组中,总共有9例患者停药。
另值得一提的是,除了礼来的Remternetug和Donanemab,卫材/渤健共同开发的阿尔茨海默病新药仑卡奈单抗(lecanemab)注射液已向国家药监局提交了上市申请并获得受理,适应症为轻度阿尔茨海默症(AD)和阿尔茨海默症(AD)引起的轻度认知障碍(MCI)疾病的改善治疗。
来源:医谷网
为你推荐
 资讯
资讯 用于非小细胞肺癌,贝达ALK抑制剂恩沙替尼获FDA批准上市
今日,美国FDA宣布批准Xcovery Holdings所开发的ALK抑制剂Ensacove(恩沙替尼,ensartinib),用于治疗未接受过ALK抑制剂治疗的ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)成年患者。
2024-12-19 10:21
 资讯
资讯 CDE:替代或者减去巴上市中药处方中濒危药味研究技术指导原则(试行)
一般应当开展与原药品进行药学、非临床有效性和 或者非临床安全性的对比研究, 原则上至少开展Ⅲ期临床试验的比较研究。
2024-12-18 22:15
 资讯
资讯 礼来阿尔茨海默病疗法记能达(多奈单抗注射液)在中国获批
今日,中国国家药品监督管理局批准礼来公司(纽约证券交易所代码:LLY)的阿尔茨海默病疗法,记能达®(多奈单抗注射液,每四周一次静脉输注)用于治疗成人因阿尔茨海默病引起的...
2024-12-18 15:58
 资讯
资讯 国产二代血糖仪获批
近日,三诺生物发布公告称,公司于近日收到国家药品监督管理局颁发的两项《中华人民共和国医疗器械注册证》,“持续葡萄糖监测系统”新产品(简称三诺生物第二代动态血糖监测仪...
2024-12-18 10:29
 资讯
资讯 濒危动物类中药材人工制成品研究技术指导原则(试行)
濒危动物类中药材人工制成品的研发应当按照中药 1 3类研发的一般要求开展临床试验,原则上应当进行Ⅰ期、Ⅱ期、Ⅲ期临床试验,相关研究应当为拟定的性味、归经、 功能主治等...
2024-12-17 18:17
 资讯
资讯 沈腾官宣成为健康中国行动偏头痛公益倡导大使,携手中国人口福利基金会提升公众认知
为了提升公众对偏头痛疾病的认知与重视程度,由中国人口福利基金会发起的健康中国行动—2025偏头痛大众疾病认知教育和倡导项目(下称:偏头痛教育项目)在12月17日正式官宣启动...
2024-12-17 15:09
 资讯
资讯 两款国产双抗医保价曝光
还有不足半个月,新版国家医保目录将开始正式实施,近日,康方生物的PD-1 CTLA-4双抗卡度尼利和PD-1 VEGF双抗依沃西医保支付价格已被披露。
2024-12-17 09:43
 资讯
资讯 全国医疗保障工作会议召开,2025医保重点工作如何规划
2025年医保工作加强医保基金运行管理,坚决守住医保基金安全底线。坚持以收定支、收支平衡、略有结余,严格基金全流程管理,确保基金应收尽收、应付尽付、账实相符,坚决防范医...
2024-12-16 17:38
 资讯
资讯 《科学》杂志发布2024年度十大科学突破榜单,长效HIV预防针剂来那帕韦位列榜首
近日, 国际顶级学术期刊《科学》(Science)杂志公布了2024年度十大科学突破,来那帕韦(lenacapavir)位列2024年度科学突破之首 。
2024-12-14 11:07
 资讯
资讯 强生“此地无银”公益沙龙在上海举行,持续关注银屑病患者学业职业公平发展
12月13日,由强生公司发起、中国职工发展基金会公益支持的“此地无银”银屑病患者学业职业公平发展支持公益沙龙在上海成功举办。
2024-12-14 11:02
 资讯
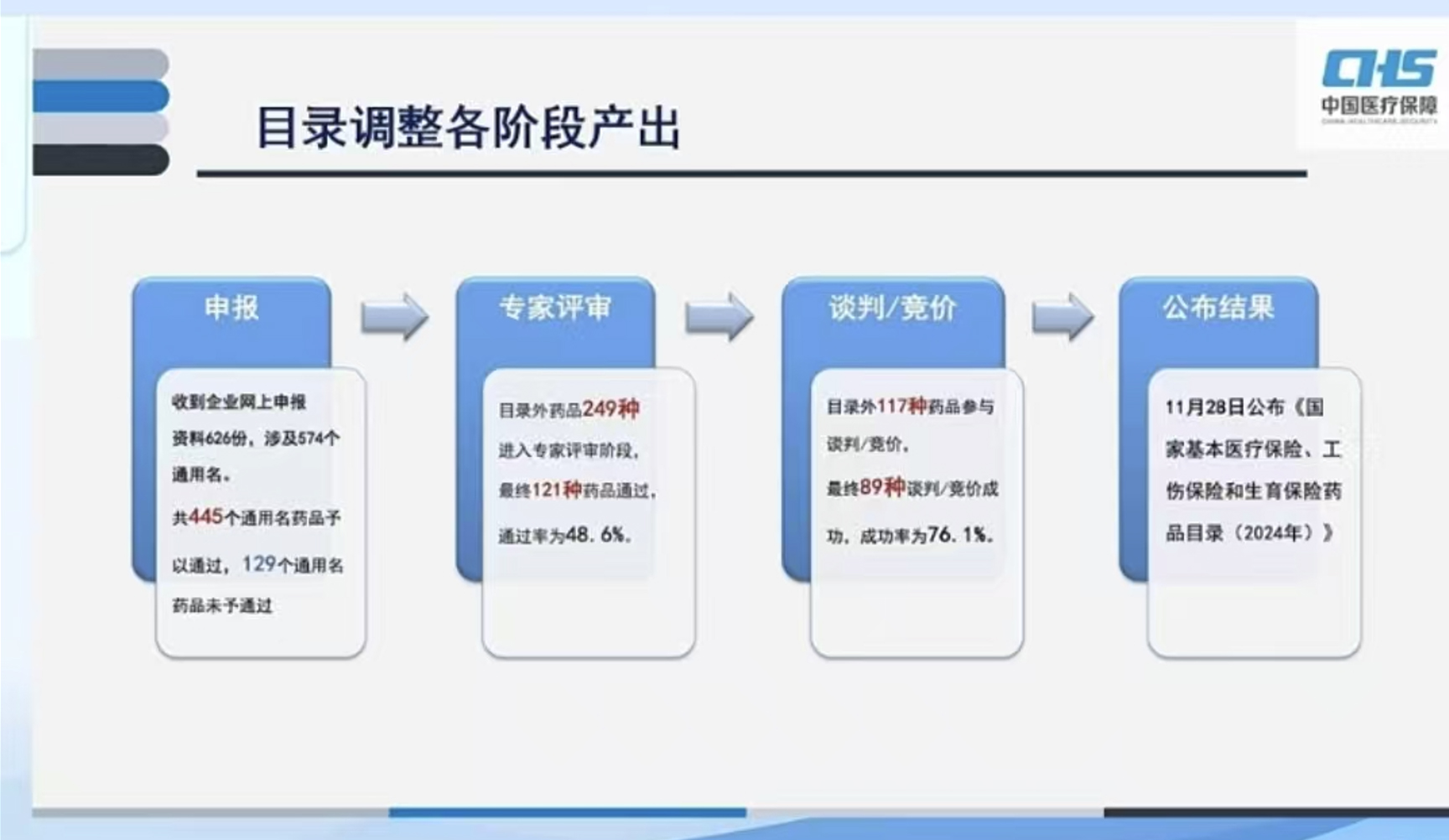
资讯 国家医保局官方说:2024国家医保目录调整为什么通不过审查或谈判不成功
12月9日晚间,国家医保局举办2024年国家医保药品目录解读活动,从中,我们可以更多了解医保目录从谈判到最终公示更多细节,为什么有些药品没有进入后续环节。
2024-12-14 10:40
 资讯
资讯 远大医药全球创新脓毒症药物及创新眼药连获研发进展,多元创新管线开花结果增厚发展潜力
继眼科领域斩获两款全球创新产品,以及全球创新高端医疗器械完成国产化转化后,12月13日,港股科技创新型国际化医药企业远大医药(0512 HK)再度传来利好。
2024-12-13 18:45
 资讯
资讯 “振东中—澳分子中医药研究中心”生物科学家分享最新学术报告研究
12月3日-4日,由北京市人民政府、国家卫生健康委员会、国家中医药管理局共同主办,世界卫生组织联合举办的世界传统医药大会于北京国家会议中心大会堂隆重开幕,85个国家和地区的...
2024-12-12 18:56
 资讯
资讯 第三批全国中成药集采相关数据信息(企业信息、产品信息、同采购组AB竞争单元、排名、加分扣分项等)
12月11日,全国中成药联合采购办公室发布《关于全国中成药采购联盟集中采购相关数据信息的公示》。
2024-12-12 18:18
 资讯
资讯 国内首款CD19 ADC新药获批上市
日前,据国家药监局政务服务门户官网信息显示,ADC Therapeutics和瓴路药业联合申报的注射用替朗妥昔单抗(曾用名:泰朗妥昔单抗,loncastuximab tesirine)获批上市,用于二...
2024-12-12 11:34