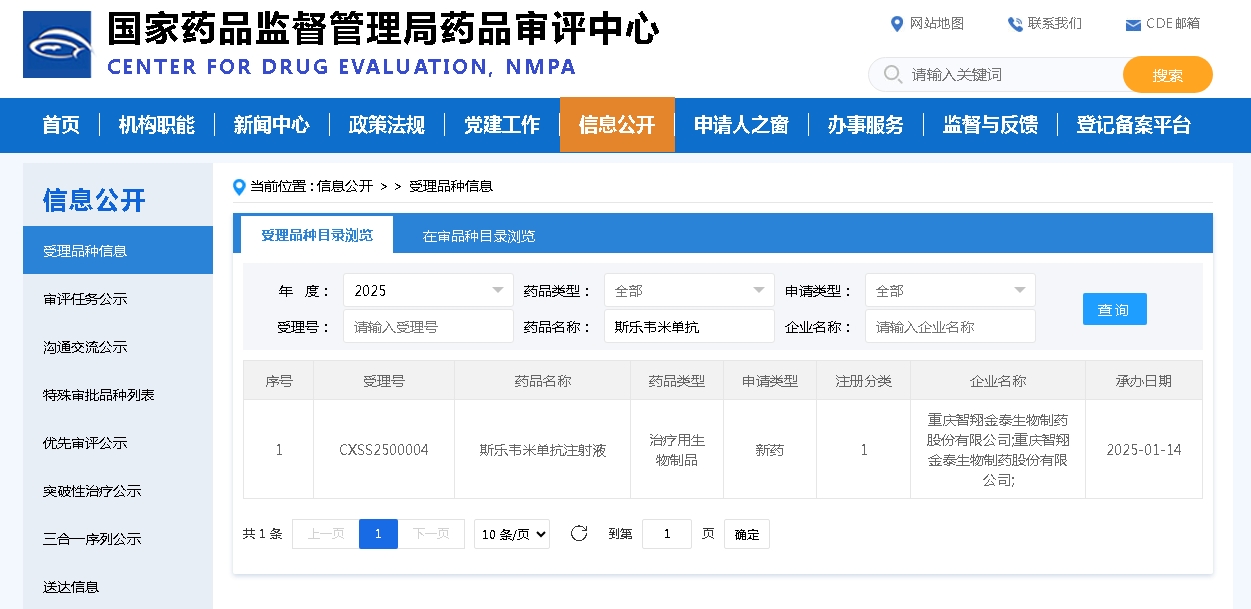
今日(5月2日),和黄医药发布公告称,美国FDA已就索凡替尼(商品名:苏泰达)治疗胰腺和非胰腺神经内分泌瘤的新药上市申请发出完整回覆函,FDA认为当前基于两项成功的中国III期研究以及一项美国桥接研究的数据包尚不足以支持药品现时于美国获批。
索凡替尼是一种具有抗血管生成和免疫调节双重活性的口服抑制剂,其安全性和疗效已在两项在中国晚期胰腺和非胰腺神经内分泌瘤患者中开展的随机双盲的III期研究(即SANET-ep和SANET-p研究)中得到证明。一项由和黄医药申办、在美国开展的桥接研究结果亦显示出与两项SANET研究人群中相似的安全性及疗效。
2020年4月,索凡替尼获美国FDA授予取得快速通道资格,用于治疗胰腺和非胰腺神经内分泌瘤,此前于2019年11月获授予孤儿药资格用于治疗胰腺神经内分泌瘤。2020年5月,和黄医药在新药上市申请前会议上与FDA达成一致,索凡替尼用于治疗胰腺和非胰腺神经内分泌瘤患者的两项获得积极结果的中国 III期研究,连同索凡替尼美国桥接研究的现有数据,可构成支持在美国提交新药上市申请的依据。FDA于2021年6月30日受理了索凡替尼提交的新药上市申请。
根据公告披露,此次FDA评估了两项SANET研究从单一国家中得出的数据对美国患者及美国医疗实践的适用程度,FDA在完整回覆函中表明,需要纳入更多代表美国患者人群的国际多中心临床试验来支持美国获批,此外,与疫情相关的现场视察和日程安排,也是此次FDA做出决策的原因之一。
和黄医药方面强调,FDA的此次决策与索凡替尼的任何安全问题无关,和黄医药正在与FDA合作,以评估下一步行动。
2021年6 月,索凡替尼获国家药监局批准用于治疗无法手术切除的局部晚期或转移性、进展期非功能性、分化良好(G1、G2)的胰腺来源的神经内分泌瘤,2021年12月,又获批用于治疗晚期非胰腺神经内分泌瘤,同月,索凡替尼以降价52%纳入2022年国家医保目录。据和黄医药2021年财报,索凡替尼全年销售业绩为1160万美元,约合人民币7665万元。
来源:医谷网
为你推荐
 资讯
资讯 国家医保局21日上海调研交流提纲
国家医保局决定1月21日由国家医保局负责同志带队,联合卫生健康、工业信息化、药品监管部门,赴上海当面听取相关委员、专家关于药品集采政策及中选产品质量保障的意见建议,并重...
2025-01-20 21:41
 资讯
资讯 一款国产肺癌药物2024年大卖超30亿元
日前,艾力斯发布了2024年业绩预告,数据显示,该公司预计2024年度实现营业收入35 5亿元,比上年同期增加15 32亿元,同比增加75 90%;预计实现归属于母公司所有者的净利润为1...
2025-01-20 20:47
 资讯
资讯 华东医药MaiLi Extreme国内获批上市,深耕高端医美领域版图再扩张
据悉,MaiLi系列共有4款产品,包括MaiLi Precise、MaiLi Define、MaiLi Volume 和 MaiLi Extreme,均已在欧洲上市,通过多种配方可适用于面部不同部位,为求美者提供面部美容填充的整体解决方案。
2025-01-20 19:49
 资讯
资讯 华东医药高端玻尿酸、PARP抑制剂于中国上市,创新医疗器械美国获批
2025年1月20日晚,华东医药同时发布三个产品获批上市公告,其在创新及医美领域连续获得多个里程碑进展。
2025-01-20 19:38
 资讯
资讯 早筛与创新疗法并进,共筑前列腺癌防治堡垒
前列腺癌偏爱“高龄+遗传”的双重风险人群,特别是55岁以上的男性、有家族史者及携带特定遗传变异(如BRCA1 2基因突变)的个体。因此,提高公众对前列腺癌的认知,加强早期筛查...
2025-01-20 14:49
 资讯
资讯 国家医保局将赴上海当面听取医生关于集采药效反馈
近日,上海两会期间,来自上海多家三甲医院的 20 名政协委员联名提案《关于在药品集采背景下如何能够用到疗效好的药物的提案》,其中提到集采药药效不稳定的情况。其中,该提...
2025-01-20 13:50
 资讯
资讯 中粮集团领航央地合作,2025年大兴区CGT项目路演专场活动成功举办
历时17个月的精心筹备与建设,国内首个细胞与基因治疗特色产业园——中关村(大兴)细胞基因治疗产业园,于北京中关村科技园区大兴生物医药产业基地落成,并于1月17日举办2025年...
2025-01-20 12:25
 资讯
资讯 “和合共生,健康共护”四价HPV疫苗男性适应证上市暨“HPV男女共防计划”启动新闻发布会成功举办,共筑HPV预防新生态
今日(1月18日),默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)举办的“和合共生,健康共护”四价HPV(人乳头瘤病毒)疫苗男性适应证上市暨“HPV男女共防计划”启动...
2025-01-18 18:31
 资讯
资讯 四同药品价格治理已基本实现,正建设全国挂网药品价格一览表
目前,我们正在建设全国挂网药品价格一览表,全量汇总展示各地挂网价格信息并对首涨、高涨幅等异常价格行为予以标识,敦促各地持续纠正不合理的挂网高价。
2025-01-18 12:15
 资讯
资讯 2025年全国80%左右医保统筹地区基本实现即时结算,2026年底全部实现即时结算
1月16日,国家医疗保障局办公室正式对外发布《关于推进基本医保基金即时结算改革的通知》。根据通知,以全国统一的医保信息平台为支撑,2025年全国80%左右统筹地区基本实现即时...
2025-01-18 11:20
 资讯
资讯 2024年底,60岁及以上人口3.1亿,占全国人口的22.0%
年末全国人口(包括31个省、自治区、直辖市和现役军人的人口,不包括居住在31个省、自治区、直辖市的港澳台居民和外籍人员)140828万人,比上年末减少139万人。全年出生人口954...
2025-01-17 14:56
 资讯
资讯 赛诺菲荣膺“杰出雇主2025”桂冠,连续五年傲立榜首
作为10多年来首个且唯一连续五年荣获此殊荣的企业,赛诺菲再次彰显了其在企业文化、人才战略、多元发展及员工培养等方面的卓越成就。
2025-01-17 11:02
 资讯
资讯 又一款国产三代EGFR-TKI抑制剂获批上市
昨日(1月16日),据国家药监局官网显示,奥赛康药业的1类创新药利厄替尼片(limertinib ASK120067,商品名:奥壹新)获批上市,用于治疗既往接受表皮生长因子受体酪氨酸激酶抑制...
2025-01-17 10:31
 资讯
资讯 增辉生命,默沙东中国再度荣膺“中国杰出雇主”
1月16日,由全球权威的杰出雇主调研机构(Top Employers Institute)颁布的“杰出雇主2025”榜单正式揭晓
2025-01-16 22:48
 资讯
资讯 国家市场监督管理总局发布《医药企业防范商业贿赂风险合规指引》
本指引所称的商业贿赂, 是指采用财物或者其他手段贿赂交易相对方的工作人员、 受交易相对方委托办理相关事务的单位或者个人、 利用职权或者影响力影响交易的单位或者个人,...
2025-01-14 23:38