11月25日,市场监管总局等部门发布《粤港澳大湾区药品医疗器械监管创新发展工作方案》,提出到2022年基本建立粤港澳大湾区内地医疗机构使用港澳上市药品医疗器械的体制机制,粤港澳大湾区内地指定医疗机构基本具备为港澳提供高水平的医疗用药用械条件。值得注意是,方案提出粤港澳大湾区内地9九市将可有条件使用港澳上市药品及医疗器械。
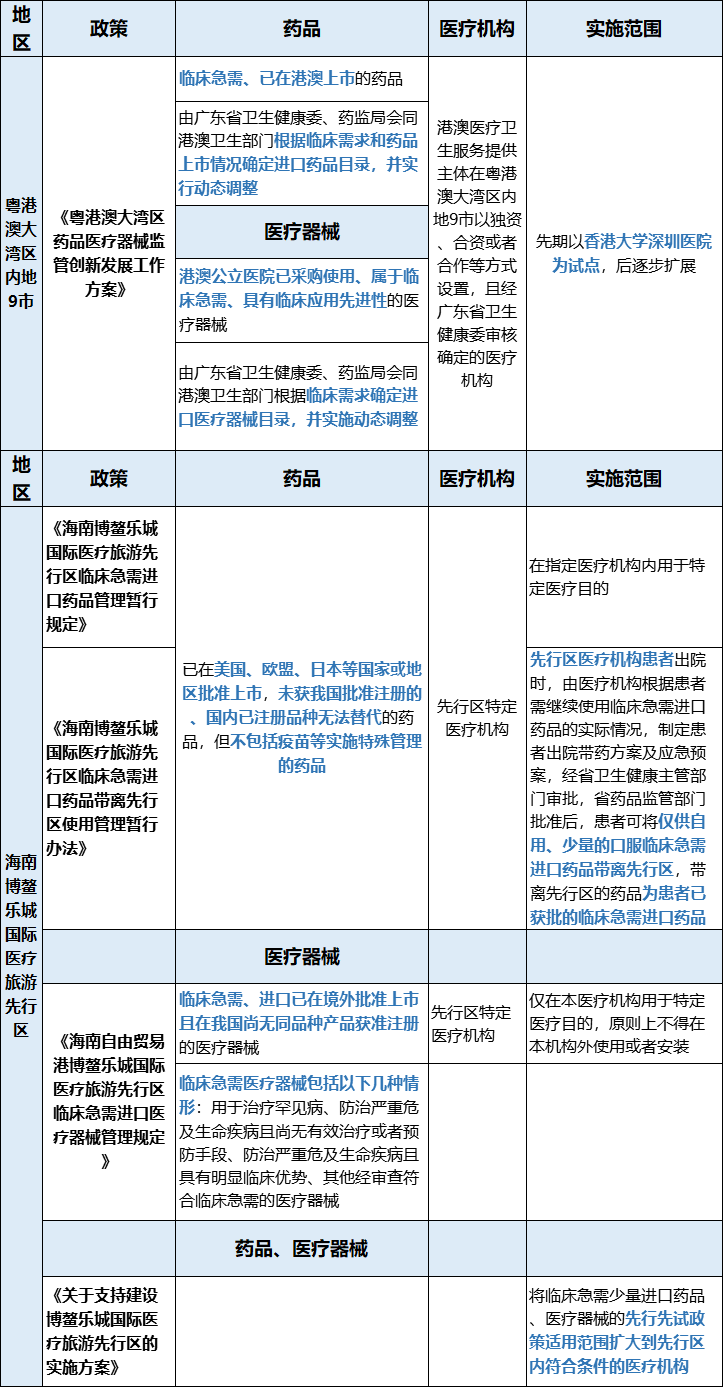
临床急需、已在港澳上市的药品可有条件用于内地9市
药品方面:
在粤港澳大湾区内地9市开业的指定医疗机构使用临床急需、已在港澳上市的药品,由国家药监局批准改为由国务院授权广东省人民政府批准。
1、指定医疗机构范围:港澳医疗卫生服务提供主体在粤港澳大湾区内地9市以独资、合资或者合作等方式设置,且经广东省卫生健康委审核确定的医疗机构
2、分步实施:先期以香港大学深圳医院为试点,在取得阶段性进展后逐步扩展至其他符合要求的指定医疗机构。相关核定条件和程序由广东省卫生健康委负责制定。
3、进口药品目录范围:由广东省卫生健康委、药监局会同港澳卫生部门根据临床需求和药品上市情况确定进口药品目录,并实行动态调整。
4、进口审批:指定医疗机构提出临床用药需求申请,广东省卫生健康委根据申请出具审核意见,评估内容包括拟进口药品是否属于临床急需。指定医疗机构根据审核意见向广东省药监局提出进口申请,符合要求的,由广东省药监局核发批件。
5、通关管理:指定医疗机构凭批件向粤港澳大湾区内地口岸药监局申请办理《进口药品通关单》,海关按规定办理通关手续。指定医疗机构按规定委托药品经营企业采购、进口和配送药品。
医疗器械方面:
在粤港澳大湾区内地9市暂停实施《医疗器械监督管理条例》第十一条第二款,区域内开业的指定医疗机构使用临床急需、港澳公立医院已采购使用、具有临床应用先进性的医疗器械,由广东省政府批准。
1、暂停法规条款实施:暂时调整《医疗器械监督管理条例》第十一条第二款“向我国境内出口第二类、第三类医疗器械的境外生产企业,应当由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件”在粤港澳大湾区内地9市实施。
2、指定医疗机构范围:港澳医疗卫生服务提供主体在粤港澳大湾区内地9市以独资、合资或者合作等方式设置,且经广东省卫生健康委审核确定的医疗机构。
3、分步实施:先期以香港大学深圳医院为试点,在取得可复制、可推广的经验后逐步扩展至其他符合要求的指定医疗机构。相关核定条件和程序由广东省卫生健康委负责制定。
4、进口医疗器械目录范围:港澳公立医院已采购使用、属于临床急需、具有临床应用先进性的医疗器械,由广东省卫生健康委、药监局会同港澳卫生部门根据临床需求确定进口医疗器械目录,并实施动态调整。
5、进口审批:指定医疗机构提出用械申请,广东省卫生健康委对临床需求进行评估并出具审核意见,评估内容包括拟进口医疗器械是否属于临床急需且无其他治疗手段、国内目前已上市产品能否达到同等治疗效果、医疗机构的器械使用能力等。广东省药监局对临床应用先进性进行评估,对国内无同品种获批注册上市的医疗器械予以支持并出具进口批复意见。广东省商务厅按相关规定对属于大型医用设备的医疗器械出具进口审核意见。
6、通关管理:指定医疗机构凭广东省药监局的批复意见(属于大型医用设备的医疗器械还应提供广东省商务厅出具的进口审核意见)申请医疗器械进口报关,广东海关按规定核验放行。指定医疗机构按规定委托医疗器械经营企业采购、进口和配送医疗器械。
海南博鳌乐城先行区相关政策
目前,海南博鳌乐城国际医疗旅游先行区和粤港澳大湾区内地9市都先后获得了临床急需进口药品、医疗器械相关使用权限,但海南博鳌与后者在具体细则上与有一定的差别,主要体现在:
1、对药品和医疗器械的规定
海南博鳌乐城国际医疗旅游先行区为:已在美国、欧盟、日本等国家或地区批准上市,未获我国批准注册的、国内已注册品种无法替代的药品,但不包括疫苗等实施特殊管理的药品;以及临床急需、进口已在境外批准上市且在我国尚无同品种产品获准注册的医疗器械,并对临床急需医疗器械做了一个大致的范围描述。
2、适用的医疗机构
海南博鳌乐城国际医疗旅游先行区为:先行区特定医疗机构。但在2019年9月由国际发改委等四部门印发的《关于支持建设博鳌乐城国际医疗旅游先行区的实施方案》中提到,将临床急需少量进口药品、医疗器械的先行先试政策适用范围扩大到先行区内符合条件的医疗机构。
3、药品的带离使用
今年3月发布的《海南博鳌乐城国际医疗旅游先行区临床急需进口药品带离先行区使用管理暂行办法》指出,先行区医疗机构患者出院时,由医疗机构根据患者需继续使用临床急需进口药品的实际情况,制定患者出院带药方案及应急预案,经省卫生健康主管部门审批,省药品监管部门批准后,患者可将仅供自用、少量的口服临床急需进口药品带离先行区,带离先行区的药品为患者已获批的临床急需进口药品。
粤港澳大湾区内地9市尚无此政策。
粤港澳大湾区内地9九市与海南博鳌乐城先行区在相关细则上的比较
《粤港澳大湾区药品医疗器械监管创新发展工作方案》全文
为深入实施《粤港澳大湾区发展规划纲要》,推进粤港澳大湾区药品医疗器械监管创新发展,探索建立互动互利的药品医疗器械合作新模式,提升监管体系和能力现代化水平,制定本方案。
一、总体要求
(一)指导思想。
以习近平新时代中国特色社会主义思想为指导,深入贯彻落实习近平总书记关于粤港澳大湾区建设的重要指示精神和“四个最严”要求,按照党中央、国务院决策部署,坚持新发展理念,深入推进“放管服”改革,创新药品医疗器械监管方式,整合监管资源,促进医药产业在粤港澳大湾区融合发展,更好地满足粤港澳大湾区居民用药用械需求,保障用药用械安全,塑造具有创新活力的健康湾区。
(二)基本原则。
坚持“一国两制”、依法办事。把维护国家药品医疗器械监管体制和尊重港澳监管机制差异有机结合起来,推动粤港澳监管机制对接,促进药品医疗器械创新发展,实现粤港澳大湾区医药产业共同发展。
坚持共享发展,改善民生。坚持以人民为中心的发展思想,围绕粤港澳大湾区居民需求,通过创新药品医疗器械监管方式,不断提供优质的药品医疗器械和服务,使粤港澳大湾区居民获得感、幸福感、安全感更加充实、更有保障、更可持续。
坚持分步实施,试点先行。针对粤港澳大湾区内地进口药品医疗器械需求,为加强监管确保安全,坚持分步实施,先期在一些条件比较成熟的地方和医疗机构作为试点,在取得可复制、可推广经验后扩展至粤港澳大湾区其他符合要求的区域和医疗机构。
(三)总体目标。
到2022年,基本建立粤港澳大湾区内地医疗机构使用港澳上市药品医疗器械的体制机制,粤港澳大湾区内地指定医疗机构基本具备为港澳提供高水平的医疗用药用械条件;建设粤港澳大湾区内地与港澳地区药品医疗器械研发、生产、流通和使用的“软联通”机制,推动粤港澳大湾区医药产业融合发展,积极稳妥开展港澳外用中成药审评审批、港澳药品医疗器械在大湾区内地生产等试点工作;建立国家药品医疗器械技术支撑机构,促进粤港澳大湾区医药产业快速健康发展;凭借粤港澳大湾区的国际化区位优势,推进中医药标准化、现代化、国际化。
到2035年,建立完善的粤港澳大湾区药品医疗器械监管协调机制,为港澳和大湾区内地居民提供便利的药品医疗器械产品及服务;打造粤港澳大湾区医药产业高水平科技创新平台,实现粤港澳大湾区医药产业深度融合和药品医疗器械生产制造产业升级,建成全国医药产业创新发展示范区和宜居宜业宜游的国际一流湾区。
二、重点任务
(一)在粤港澳大湾区内地9市开业的指定医疗机构使用临床急需、已在港澳上市的药品,由国家药监局批准改为由国务院授权广东省人民政府批准。
一是实施范围。关于指定医疗机构范围。港澳医疗卫生服务提供主体在粤港澳大湾区内地9市以独资、合资或者合作等方式设置,且经广东省卫生健康委审核确定的医疗机构。坚持分步实施,先期以香港大学深圳医院为试点,在取得阶段性进展后逐步扩展至其他符合要求的指定医疗机构。相关核定条件和程序由广东省卫生健康委负责制定。关于进口药品目录范围。由广东省卫生健康委、药监局会同港澳卫生部门根据临床需求和药品上市情况确定进口药品目录,并实行动态调整。
二是实施程序。关于进口审批。指定医疗机构提出临床用药需求申请,广东省卫生健康委根据申请出具审核意见,评估内容包括拟进口药品是否属于临床急需。指定医疗机构根据审核意见向广东省药监局提出进口申请,符合要求的,由广东省药监局核发批件。关于通关管理。指定医疗机构凭批件向粤港澳大湾区内地口岸药监局申请办理《进口药品通关单》,海关按规定办理通关手续。指定医疗机构按规定委托药品经营企业采购、进口和配送药品。
(二)在粤港澳大湾区内地9市暂停实施《医疗器械监督管理条例》第十一条第二款,区域内开业的指定医疗机构使用临床急需、港澳公立医院已采购使用、具有临床应用先进性的医疗器械,由广东省政府批准。
一是暂停法规条款实施。暂时调整《医疗器械监督管理条例》第十一条第二款“向我国境内出口第二类、第三类医疗器械的境外生产企业,应当由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件”在粤港澳大湾区内地9市实施。
二是实施范围。关于指定医疗机构范围。港澳医疗卫生服务提供主体在粤港澳大湾区内地9市以独资、合资或者合作等方式设置,且经广东省卫生健康委审核确定的医疗机构。坚持分步实施,先期以香港大学深圳医院为试点,在取得可复制、可推广的经验后逐步扩展至其他符合要求的指定医疗机构。相关核定条件和程序由广东省卫生健康委负责制定。关于进口医疗器械目录范围。港澳公立医院已采购使用、属于临床急需、具有临床应用先进性的医疗器械,由广东省卫生健康委、药监局会同港澳卫生部门根据临床需求确定进口医疗器械目录,并实施动态调整。
三是实施程序。关于进口审批。指定医疗机构提出用械申请,广东省卫生健康委对临床需求进行评估并出具审核意见,评估内容包括拟进口医疗器械是否属于临床急需且无其他治疗手段、国内目前已上市产品能否达到同等治疗效果、医疗机构的器械使用能力等。广东省药监局对临床应用先进性进行评估,对国内无同品种获批注册上市的医疗器械予以支持并出具进口批复意见。广东省商务厅按相关规定对属于大型医用设备的医疗器械出具进口审核意见。关于通关管理。指定医疗机构凭广东省药监局的批复意见(属于大型医用设备的医疗器械还应提供广东省商务厅出具的进口审核意见)申请医疗器械进口报关,广东海关按规定核验放行。指定医疗机构按规定委托医疗器械经营企业采购、进口和配送医疗器械。
(三)加快国家药监局药品和医疗器械审评检查大湾区分中心建设。大湾区分中心作为国家药监局药品和医疗器械审评中心的派出机构,主要承担协助国家药监局药品和医疗器械审评机构开展审评事前事中沟通指导及相关检查等工作,建立审评审批的便捷机制。
(四)支持在横琴粤澳合作中医药科技产业园发展中医药产业。一是简化外用中成药注册审批流程。国家药监局委托广东省药监局对在港澳已上市传统外用中成药进行审批,具体目录由广东省药监局商港澳药品监管部门制定并报国家药监局备案。二是推进中医药产品创新研发。支持在横琴粤澳合作中医药科技产业园设立中医药产品创新孵化中心,鼓励中医医疗机构在产业园发展医疗机构制剂,鼓励在产业园研发中医医疗器械。三是加强中医药政策和技术研究。由广东省药监局、国家药监局南方医药经济研究所与横琴粤澳合作中医药科技产业园共同开展中医药标准和国际交流策略等政策和技术研究,搭建中医药政策和技术研究、交流、传播平台,为加快完善中医药政策体系建设、促进中医药事业发展献言建策,推动中医药标准化、现代化、国际化。
(五)在粤港澳大湾区开展药品上市许可持有人、医疗器械注册人制度改革。药品上市许可持有人、医疗器械注册人为港澳企业的,由其指定粤港澳大湾区内地企业法人履行药品上市许可持有人、医疗器械注册人义务的,与相关港澳企业承担连带责任。支持港澳药品上市许可持有人、医疗器械注册人将持有的药品医疗器械在粤港澳大湾区内地9市符合条件的企业生产。
(六)在中山市设立药品进口口岸。按程序申报在广东省中山市增设药品进口口岸,评估论证将广东省药品检验所中山实验室作为口岸药品检验所。
三、保障措施
(一)建立协作机制。国家市场监管总局、国家药监局会同国家发展改革委、商务部、国家卫生健康委、海关总署、国务院港澳办、国家中医药局等有关部门协调推动实施相关工作。广东省人民政府牵头建立广东省内及与港澳特别行政区政府之间的协作机制,具体负责落实工作。国家药监局指导广东省药监局同港澳药品监管等部门建立粤港澳三地药品监管协作机制,研究确定协作重要事项,定期通报监管情况,动态调整允许使用的药品医疗器械目录和范围。
(二)健全配套制度。广东省药监局会同有关方面梳理药品医疗器械创新监管配套制度清单,根据职能分别制定指定医疗机构、药品医疗器械在粤港澳大湾区的采购、进口、通关、贮存、配送、使用全过程监管配套制度和管理办法,明确指定医疗机构的认定条件,规范临床急需药品医疗器械的进口程序和使用条件,细化贮存、维护、管理要求,明确不良反应、不良事件监测、应急处置等内容。涉及内地对港澳单独开放措施,纳入内地与香港、澳门《关于建立更紧密经贸关系的安排》(CEPA)框架下实施。
(三)落实监管责任。广东省各相关职能部门按照拟定的配套制度严格审核审批,做到申请条件、申报材料、进口通关流程及使用管理等不变,审批标准不降低,严防临床急需进口药品医疗器械管理失控。加快建设临床急需进口药品医疗器械监管信息平台,建立涵盖采购、进口、通关、贮存、配送、使用全过程管理的追溯体系,实现药品医疗器械来源可溯、去向可追、风险可控、责任可究。加强日常监督检查,探索实施分级分类监管、“日常检查+飞行检查”等措施。健全不良反应、事件监测体系,建立不良反应、事件监测信息通报机制,及时采取有效措施控制风险。
(四)强化主体责任。严格执行医疗机构准入条件,实施法定代表人承诺制。指定医疗机构加强药品医疗器械采购、进口、使用、贮存、维护保养、伦理审核、患者知情同意、不良事件报告、产品召回、损害赔偿等管理。药品医疗器械经营企业加强采购、进口、贮存和配送管理。医疗机构申请临床急需进口药品医疗器械的,必须由法定代表人签署承诺书,承诺申报资料真实,确保药品医疗器械在本医疗机构使用,对所进口药品医疗器械的使用风险负全部责任。
(五)完善救济体系。指定医疗机构与患者签订知情同意书,明确纠纷解决途径,借鉴港澳处理医疗事故的工作模式,参照国际通行的保险赔付机制,保障患者在使用进口药品医疗器械后出现医疗事故情况下的合法权益。药品监管部门负责制定应急预案,指定医疗机构负责制定应急方案,加大舆情监测力度,快速有效做好事故核查、处置等工作。
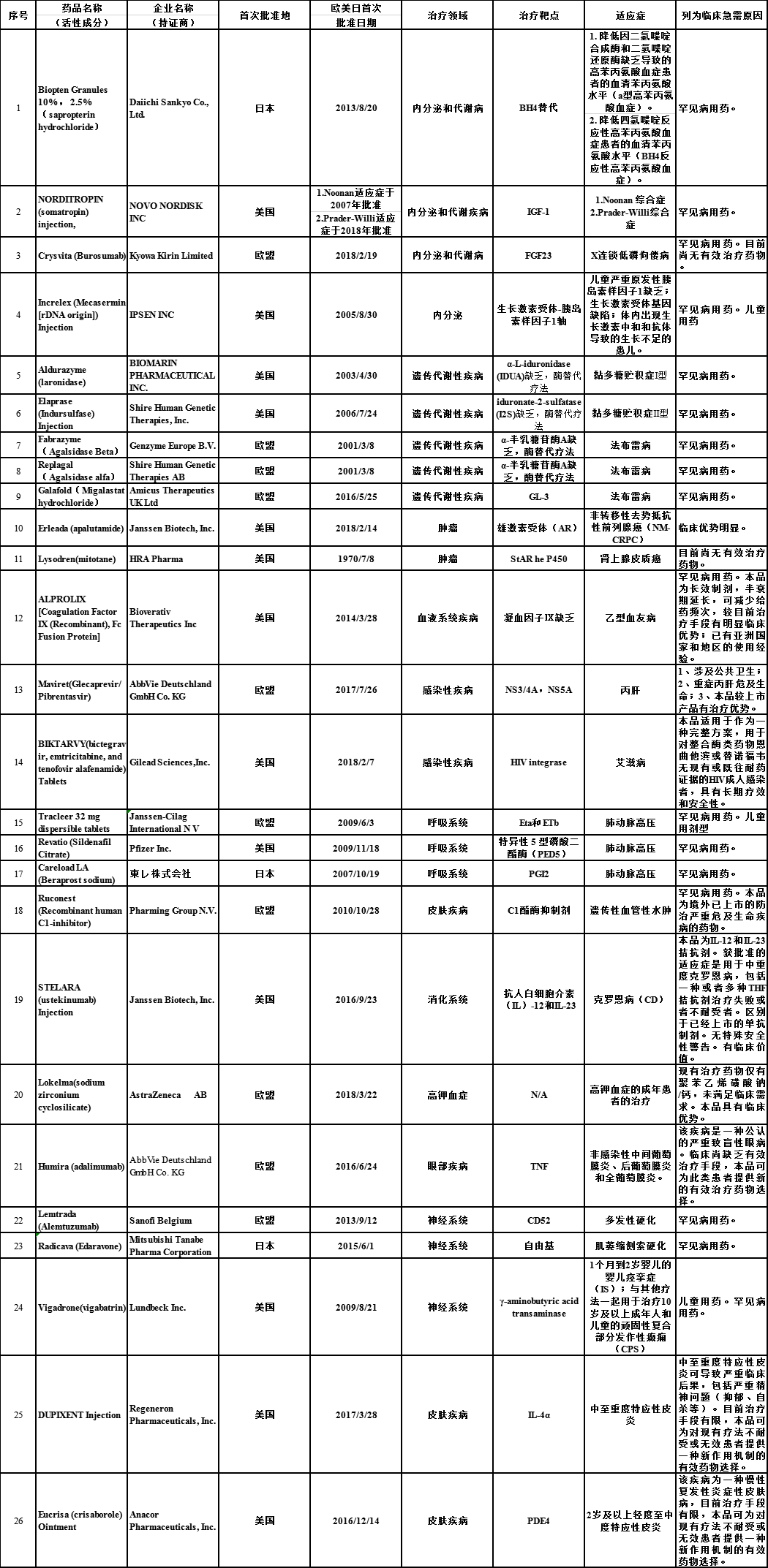
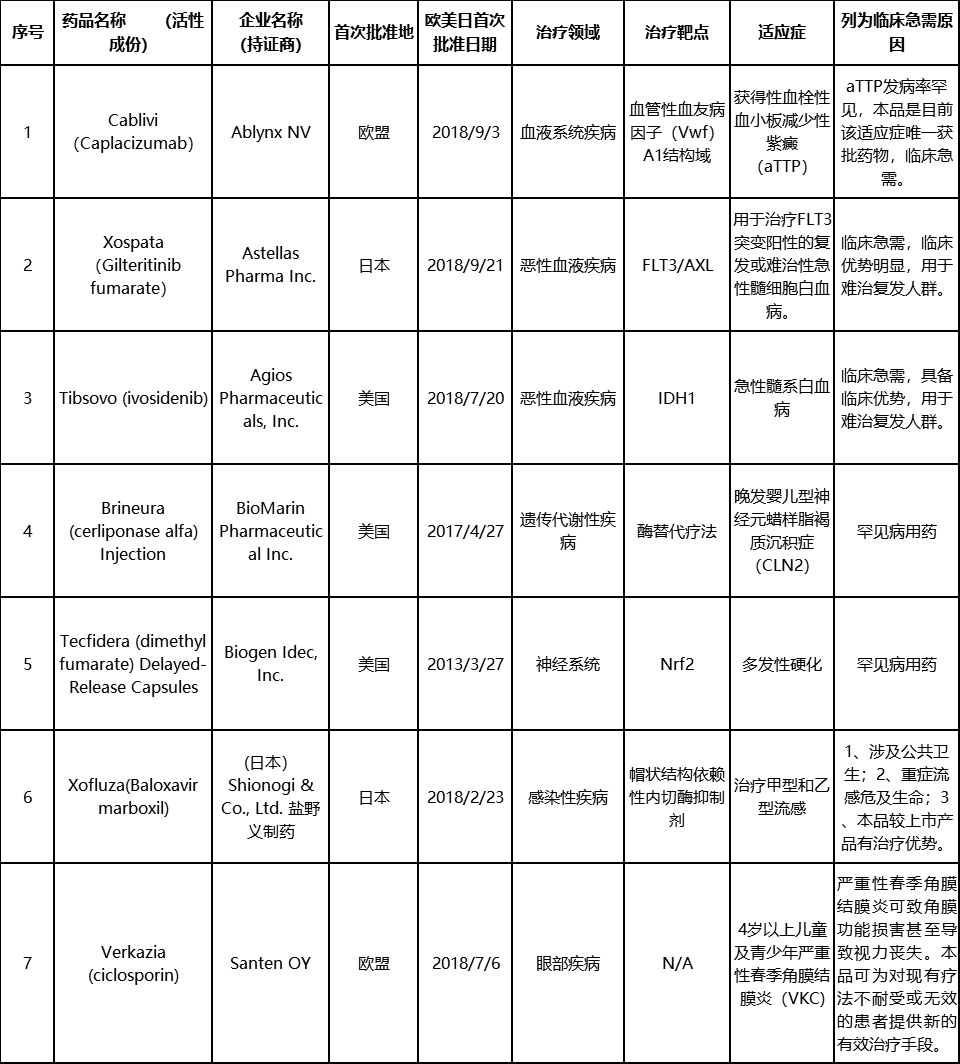
已公布的三批临床急需境外新药名单
自2018年11月以来,国家药监局药品审评中心(CDE)先后发布了3批临床急需境外新药名单。纳入境外已上市临床急需新药名单的药品,尚未进行申报的或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,国家药品监督管理局将按照优先审评审批程序,加快审评审批。与此同时,CDE建立专门通道开展审评,对罕见病治疗药品,在受理后3个月内完成技术审评;对其他境外新药,在受理后6个月内完成技术审评。
来源:医谷网
为你推荐
 资讯
资讯 复宏汉霖私有化计划失败,将保留H股上市地位
宣布其关于吸收合并及私有化复宏汉霖(02696 HK)的特别决议案未获通过,因此吸收合并计划将不予实施,复宏汉霖将继续保留H股上市地位。
2025-01-23 10:57
 资讯
资讯 国家药监局:关于简化港澳已上市传统口服中成药内地上市注册审批的公告
本公告适用于由香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)...
2025-01-22 17:48
 资讯
资讯 国家医保局21日上海调研交流提纲
国家医保局决定1月21日由国家医保局负责同志带队,联合卫生健康、工业信息化、药品监管部门,赴上海当面听取相关委员、专家关于药品集采政策及中选产品质量保障的意见建议,并重...
2025-01-20 21:41
 资讯
资讯 一款国产肺癌药物2024年大卖超30亿元
日前,艾力斯发布了2024年业绩预告,数据显示,该公司预计2024年度实现营业收入35 5亿元,比上年同期增加15 32亿元,同比增加75 90%;预计实现归属于母公司所有者的净利润为1...
2025-01-20 20:47
 资讯
资讯 华东医药MaiLi Extreme国内获批上市,深耕高端医美领域版图再扩张
据悉,MaiLi系列共有4款产品,包括MaiLi Precise、MaiLi Define、MaiLi Volume 和 MaiLi Extreme,均已在欧洲上市,通过多种配方可适用于面部不同部位,为求美者提供面部美容填充的整体解决方案。
2025-01-20 19:49
 资讯
资讯 华东医药高端玻尿酸、PARP抑制剂于中国上市,创新医疗器械美国获批
2025年1月20日晚,华东医药同时发布三个产品获批上市公告,其在创新及医美领域连续获得多个里程碑进展。
2025-01-20 19:38
 资讯
资讯 早筛与创新疗法并进,共筑前列腺癌防治堡垒
前列腺癌偏爱“高龄+遗传”的双重风险人群,特别是55岁以上的男性、有家族史者及携带特定遗传变异(如BRCA1 2基因突变)的个体。因此,提高公众对前列腺癌的认知,加强早期筛查...
2025-01-20 14:49
 资讯
资讯 国家医保局将赴上海当面听取医生关于集采药效反馈
近日,上海两会期间,来自上海多家三甲医院的 20 名政协委员联名提案《关于在药品集采背景下如何能够用到疗效好的药物的提案》,其中提到集采药药效不稳定的情况。其中,该提...
2025-01-20 13:50
 资讯
资讯 中粮集团领航央地合作,2025年大兴区CGT项目路演专场活动成功举办
历时17个月的精心筹备与建设,国内首个细胞与基因治疗特色产业园——中关村(大兴)细胞基因治疗产业园,于北京中关村科技园区大兴生物医药产业基地落成,并于1月17日举办2025年...
2025-01-20 12:25
 资讯
资讯 “和合共生,健康共护”四价HPV疫苗男性适应证上市暨“HPV男女共防计划”启动新闻发布会成功举办,共筑HPV预防新生态
今日(1月18日),默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)举办的“和合共生,健康共护”四价HPV(人乳头瘤病毒)疫苗男性适应证上市暨“HPV男女共防计划”启动...
2025-01-18 18:31
 资讯
资讯 四同药品价格治理已基本实现,正建设全国挂网药品价格一览表
目前,我们正在建设全国挂网药品价格一览表,全量汇总展示各地挂网价格信息并对首涨、高涨幅等异常价格行为予以标识,敦促各地持续纠正不合理的挂网高价。
2025-01-18 12:15
 资讯
资讯 2025年全国80%左右医保统筹地区基本实现即时结算,2026年底全部实现即时结算
1月16日,国家医疗保障局办公室正式对外发布《关于推进基本医保基金即时结算改革的通知》。根据通知,以全国统一的医保信息平台为支撑,2025年全国80%左右统筹地区基本实现即时...
2025-01-18 11:20
 资讯
资讯 2024年底,60岁及以上人口3.1亿,占全国人口的22.0%
年末全国人口(包括31个省、自治区、直辖市和现役军人的人口,不包括居住在31个省、自治区、直辖市的港澳台居民和外籍人员)140828万人,比上年末减少139万人。全年出生人口954...
2025-01-17 14:56
 资讯
资讯 赛诺菲荣膺“杰出雇主2025”桂冠,连续五年傲立榜首
作为10多年来首个且唯一连续五年荣获此殊荣的企业,赛诺菲再次彰显了其在企业文化、人才战略、多元发展及员工培养等方面的卓越成就。
2025-01-17 11:02
 资讯
资讯 又一款国产三代EGFR-TKI抑制剂获批上市
昨日(1月16日),据国家药监局官网显示,奥赛康药业的1类创新药利厄替尼片(limertinib ASK120067,商品名:奥壹新)获批上市,用于治疗既往接受表皮生长因子受体酪氨酸激酶抑制...
2025-01-17 10:31
 资讯
资讯 增辉生命,默沙东中国再度荣膺“中国杰出雇主”
1月16日,由全球权威的杰出雇主调研机构(Top Employers Institute)颁布的“杰出雇主2025”榜单正式揭晓
2025-01-16 22:48