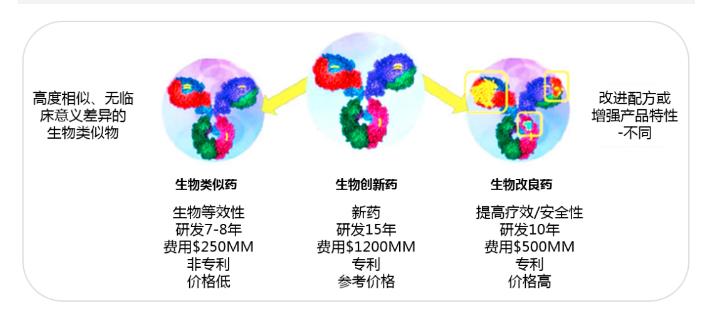
近年来,随着各种生物创新药的专利先后到期,全球生物类似药的研发异常火热。生物类似药的不断引入,生物创新药的继续存在,并且研究者还会继续研发现有生物制剂的改良药物(图1),这些因素构成了一个具有挑战性的环境。为了确保向患者处方最安全、最有效的治疗药物,临床医生应充分了解生物创新药与生物类似药的复杂性,并作出符合患者利益的决策。
图1 生物类似药、生物创新药及其改良药物1
生物类似药不是“仿制药”
生物创新药不可精准复制
生物类似药是一种与特定参比制剂(生物创新药)高度相似的生物制品,在质量、安全性和有效性方面与参比制剂之间不存在临床意义上的差异2,3。需要注意的是,生物类似药与仿制药的术语不能互换,因为仿制药(化学合成的小分子)与原始产品完全相同,而生物类似药仅与其原始产品高度相似2。
生物制剂的内在、外在复杂性致使生物类似药难以完全复制。首先,相对于化学药物而言,生物类似药分子量较大,比化学药物大100-1000倍以上(图2)4。生物类似药由多蛋白质组成,具有独特的多维结构,其复杂作用方式永远不可能完全复制,而且很多因素如蛋白的聚合程度、一级序列的修饰、糖基化和局部二级结构的不同均会影响最终的蛋白产物4,5。
图2 生物制剂分子量比化学药大,内部构造复杂1
其次,生物类似药与生物创新药的起点不同(即整个制造过程的差异)6。生物制剂来源多为活体细胞,对生产环境具有敏感性,原材料及生产工艺的任何微小改变均可能影响生物制剂的疗效和安全性5,6。
实际上,生物类似药即使具有相同的分子量,并且由相同类型的细胞或微生物生产,也可能具有不同的药代动力学和药效学性质4。而生物类似药是试图复制现有的生物制剂产品或蛋白质药物,由于它们是用不同的细胞系和不同的生产、纯化工艺制成的,因此最终的产品并不相同4。
生物创新药数十载的研发和实践历程,无法复制
生物创新药除了药物本身无法被完全复制以外,其适应症的获得过程同样不可复制。生物创新药研发是一个漫长且复杂的过程,一个新药的诞生需要经过药物发现阶段、临床前研究阶段(药学研究阶段、药物评价阶段)、临床研究阶段(Ⅰ、Ⅱ、Ⅲ期临床)、审批与投产上市阶段以及上市后的Ⅳ期临床和新药检测期。据统计,生物创新药从其早期研究到最终上市要花大概十几年的时间2。
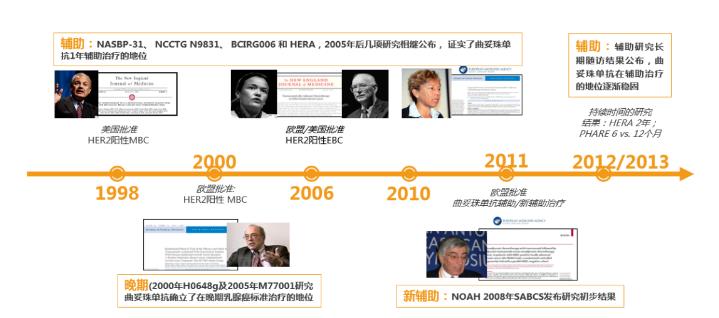
以曲妥珠单抗为例,从发现HER2/neu基因至进入临床研究就已经历了10年历程,自1998年首次获批上市之后,又屡次更新、扩大适应症范围,逐步实现乳腺癌全疗程的覆盖。截至目前,曲妥珠单抗已有22年的历史,其安全性与有效性在国内外长期的临床实践中得到了广泛验证7-11。
图3曲妥珠单抗生物创新药研发历程:曲妥珠单抗的临床试验及实践7-11
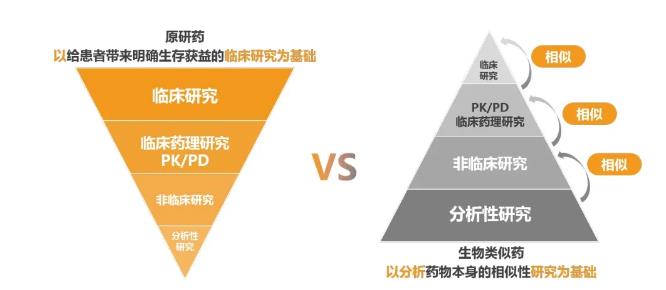
生物创新药需要经过完整的非临床和临床试验系统评价来获批上市,而生物类似药仅需用分析方法逐步从结构和功能上阐明其与参照药的高度相似性12,重临床前研究而轻临床研究(图4)。原研创新药采用优效性评价疗效和安全性,生物类似药是等效性评价,与参照药相似即可2,13。然而目前监管机构对等效界值的设定尚无具体要求和标准。
图4 生物类似药与生物创新药的开发过程不同2,13
原研创新药需在不同人群中进行研究,以曲妥珠单抗为例,通过从乳腺癌晚期到早期的不断探索,才筛选出如今的“敏感”人群,而生物类似药可以只选择敏感、均一的研究人群13。而且,原研创新药与生物类似药的临床研究终点也有所不同。原研药多采用总生存期(OS)、无进展生存期(PFS)等作为临床研究终点,而生物类似药多采用客观缓解率(ORR),但ORR并不总是与长期改善患者生存的结局相关13,14。
生物创新药每一个适应症的疗效和安全性都有大量临床研究支持,而生物类似药则相对简化,仅在一种适应症中验证与原研药高度相似后,可以考虑外推至参照药的其他适应症15。但生物类似药适应症不能自动外推至参照药的所有己批适应症。生物类似药外推适应症需要基于充分证据的科学判断16。外推虽给生物类似药临床应用提供了便利,但由于临床研究的不足,其在其他适应症中的疗效和安全性存在一定的不确定性。
权衡获益与风险,作出合理选择
生物制品具有免疫原性,可诱发机体的免疫反应,进而形成抗药物抗体(ADAs),影响药物的疗效和安全性17。生物创新药如曲妥珠单抗等,临床安全性数据充足,进行了全面评估与管理。由于生物类似药与生物创新药并不完全相同,其生产过程以及制剂的变化都可能会改变生物技术药的免疫原性,因此应高度重视17。
另外,参比制剂与生物类似药的可互换性或者生物类似药之间的可互换性还常常存在不确定性和担忧。转换用药的主要潜在风险因素是生物类似药免疫原性相关经验不足,相似并不意味着即可互换,而要有严格稳健的药物警戒系统跟踪和追溯12。
生物类似药作为新型生物治疗的竞争性、低成本替代品被开发和销售18。然而,事实上生物创新药与生物类似药的费用价格相似。在日本,曲妥珠单抗原研药与类似药使用相比,患者实际付费差额很小19。而且,在我国医保部门的努力下曲妥珠单抗原研药已经进入医保并2次降价,提高了药物可及性,减轻经济负担,助力乳腺癌患者的长期生存。18年的使用经验,药物使用管理经验丰富,不会给医院带来额外的不良事件管理费用,也不会给患者带来用药风险而产生额外花费。因此,生物类似药未来仍需要长期充足的药物经济学数据证实其药经学价值。
总结
生物创新药本身以及长达几十年的生产和质控经验是生物类似药无法完全复制的。临床医生应该意识到,生物技术药物和生物类似药的质量、安全性和功效问题比传统仿制药更为关键和复杂4。不同生物技术公司不同药物种类所用的工具细胞和蛋白纯化技术不同,由生产工艺不同带来的制剂中的杂质也不同。因此,在治疗应用中,生物类似药的免疫原性问题必须要予以特别重视20。药企应加强安全用药宣传,科学推介产品。总之,临床中选择生物药物时应综合考虑疗效及安全性,作出符合患者利益的明智的选择。
参考文献:
1. http://anewbiotech.com/
2. Agbogbo FK, et al. Current perspectives on biosimilars. J Ind Microbiol Biotechnol. 2019;46(9-10):1297-1311.
3. Lyman GH, et al. American Society of Clinical Oncology Statement: Biosimilars in Oncology. J Clin Oncol. 2018;36(12):1260-1265.
4. Nowicki M. Basic facts about biosimilars. Kidney Blood Press Res. 2007;30(5):267-272.
5. 姜时雨, 石远凯. 中华肿瘤杂志. 2017;39(10):721-725.
6. Wolff-Holz E, et al. Evolution of the EU Biosimilar Framework: Past and Future. BioDrugs. 2019;33(6):621-634.
7. Slamon DJ, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001;344(11):783-792.
8. Marty M, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment: the M77001 study group. J Clin Oncol. 2005;23(19):4265-4274.
9. Piccart-Gebhart MJ, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med. 2005;353(16):1659-1672.
10. Perez EA, et al. Sequential versus concurrent trastuzumab in adjuvant chemotherapy for breast cancer. J Clin Oncol. 2011;29(34):4491-4497.
11. Gianni L, et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet. 2010;375(9712):377-384.
12. 梅丹, 等. 多维度关注生物类似药的管理与临床应用. 中国药房. 2020;31(3):373-378.
13. Thill M. Biosimilar Trastuzumab in Clinical Trials: Differences or Not?. Breast Care (Basel). 2019;14(1):17-22.
14. 郭玮, 等. 生物类似药物曲妥珠单抗临床研究的启示和思考. 中国肿瘤生物治疗杂志. 359-365.
15. 生物类似药研发与评价技术指导原则(试行). 国家药品监督管理局.
16. 吴其威, 等. 各国生物类似药适应症外推技术要求的比对研究及完善我国生物类似药适应症外推技术要求的建议. 现代药物与临床. 2019;34(4):904-906.
17. Pineda C, et al. Assessing the Immunogenicity of Biopharmaceuticals. BioDrugs. 2016;30(3):195-206.
18. Lyman GH, et al. American Society of Clinical Oncology Statement: Biosimilars in Oncology. J Clin Oncol. 2018;36(12):1260-1265.
19. Hara F, et al. Current situation and challenges regarding biosimilars in Japan: an example of trastuzumab biosimilars for breast cancer. Future Oncol. 2019;15(12):1353-1361.
20. 王海学, 等. 生物类似药的免疫原性研究与评价技术思考. 中国药学杂志. 2015;50(6):483-489.
来源:医脉通 作者: 医脉通肿瘤科
为你推荐
 资讯
资讯 四同药品价格治理已基本实现,正建设全国挂网药品价格一览表
目前,我们正在建设全国挂网药品价格一览表,全量汇总展示各地挂网价格信息并对首涨、高涨幅等异常价格行为予以标识,敦促各地持续纠正不合理的挂网高价。
2025-01-18 12:15
 资讯
资讯 2025年全国80%左右医保统筹地区基本实现即时结算,2026年底全部实现即时结算
1月16日,国家医疗保障局办公室正式对外发布《关于推进基本医保基金即时结算改革的通知》。根据通知,以全国统一的医保信息平台为支撑,2025年全国80%左右统筹地区基本实现即时...
2025-01-18 11:20
 资讯
资讯 2024年底,60岁及以上人口3.1亿,占全国人口的22.0%
年末全国人口(包括31个省、自治区、直辖市和现役军人的人口,不包括居住在31个省、自治区、直辖市的港澳台居民和外籍人员)140828万人,比上年末减少139万人。全年出生人口954...
2025-01-17 14:56
 资讯
资讯 赛诺菲荣膺“杰出雇主2025”桂冠,连续五年傲立榜首
作为10多年来首个且唯一连续五年荣获此殊荣的企业,赛诺菲再次彰显了其在企业文化、人才战略、多元发展及员工培养等方面的卓越成就。
2025-01-17 11:02
 资讯
资讯 又一款国产三代EGFR-TKI抑制剂获批上市
昨日(1月16日),据国家药监局官网显示,奥赛康药业的1类创新药利厄替尼片(limertinib ASK120067,商品名:奥壹新)获批上市,用于治疗既往接受表皮生长因子受体酪氨酸激酶抑制...
2025-01-17 10:31
 资讯
资讯 增辉生命,默沙东中国再度荣膺“中国杰出雇主”
1月16日,由全球权威的杰出雇主调研机构(Top Employers Institute)颁布的“杰出雇主2025”榜单正式揭晓
2025-01-16 22:48
 资讯
资讯 国家市场监督管理总局发布《医药企业防范商业贿赂风险合规指引》
本指引所称的商业贿赂, 是指采用财物或者其他手段贿赂交易相对方的工作人员、 受交易相对方委托办理相关事务的单位或者个人、 利用职权或者影响力影响交易的单位或者个人,...
2025-01-14 23:38
 资讯
资讯 阿斯利康与宜联生物达成临床研究合作,共同探索联合治疗创新方案
双方将共同启动一项多中心、开放性、I Ib期研究,旨在评估两款药物联合治疗在实体肿瘤患者中的安全性、有效性和药代动力学。
2025-01-14 18:36
 资讯
资讯 NVIDIA与多家行业顶尖机构达成深度合作,共促医疗健康产业蓬勃发展
在日前举办的摩根大通医疗健康大会上,NVIDIA 宣布与多家行业领先机构达成合作,这类新的合作旨在通过加速药物发现、提升基因组研究,以及利用代理式和生成式 AI 开创先进医...
2025-01-14 13:26
 资讯
资讯 老牌上市药企终止PD-1项目,计提资产减值准备1.75亿元
近日,丽珠医药集团发布公告称,对公司及下属子公司截至2024年12月31日合并报表范围内存在减值迹象的资产进行了减值测试,并对其中存在减值迹象的资产相应计提了减值准备。
2025-01-14 10:13
 资讯
资讯 尊享e生2025升级:首次全场景放开外购药械,医院药品覆盖数量再增
1月13日,众安保险举办“与10光,共生长”尊享e生十周年产品升级发布会,正式发布尊享e生2025版,并推出众安健康险未来将主打的两大产品系列——面向健康人群的“尊享系列”,以...
2025-01-13 20:17
 资讯
资讯 PLA材料的医美应用:安全与效果的双重考验
聚乳酸PLA,作为医美行业面部填充剂历经了3个时代大约20多年的发展,大体可分为1 0、2 0、3 0三个不同的时代;即1 0-结晶片状;2 0-普遍表面粗糙的多孔微球或实心微球;3 ...
2025-01-13 19:53
 资讯
资讯 国家医保局:开展2025年定点医药机构违法违规使用医保基金自查自纠工作,肿瘤类、重症医学类、麻醉类、零售药店典型问题清单
2025年3月底前,各级医保部门根据本地化问题清单,对辖区内所有定点医疗机构和定点零售药店2023-2024年医保基金使用情况开展自查自纠。2025年4月起,国家医保局将对全国定点医药...
2025-01-13 17:32
 资讯
资讯 好大夫正式牵手蚂蚁集团,共同推进“AI+医疗”创新
蚂蚁集团收购好大夫在线尘埃落定。1月11日,在2025年好大夫峰会上,双方在收购完成后首度携手亮相。好大夫在线创始人王航现场表示,共同的使命和愿景让双方走到了一起,后续好大...
2025-01-11 18:05
 资讯
资讯 创新给药机制,全球首个口服GLP-1RA诺和忻(司美格鲁肽片)在中国全面上市
今日(1月11日),全球领先的生物制药公司诺和诺德宣布,全球首个口服胰高糖素样肽-1受体激动剂(GLP-1RA)——诺和忻®(司美格鲁肽片)在中国全面上市。诺和忻®以便利的口服...
2025-01-11 17:56