自人类与灵长类的近亲们分道扬镳起,人类作为一个独特的物种,开启了一条截然不同的演化路径。随着科技进步和生产力水平的提高,人类寿命逐渐摆脱饥荒、瘟疫、战乱等历史上造成人口急剧减少因素的影响,人口总量及平均寿命显着增加。衰老及伴随的各种退行性疾病逐渐成为影响人类寿命及生活质量的制约因素。以干细胞技术为核心的再生医学正是在这种背景下应运而生。
俗话说,科技是一把双刃剑。历史上每次技术创新(尤其是跟人类健康有关的医疗技术)都引起很多新的伦理问题,干细胞技术也不例外。下面,小编简单总结全球(包括国内)对干细胞研究及临床转化中伦理问题的认识,并谈谈个人的理解。
一、胚胎干细胞等胚胎研究的必要性
人类的正常发育过程好比一个特殊的计时器,一旦按下启动按钮就无法停止。胚胎干细胞技术的发明好比给这个计时器装了一个暂停按钮,让人类得以从早期胚胎中提取细胞(通常是内细胞团),经过体外培养得到可以一直传代扩增的胚胎干细胞系。胚胎干细胞经过诱导,可以分化成人体任何一种细胞。因此,胚胎干细胞技术的发明理论上为器官移植等替代治疗技术提供源源不断的种子细胞来源。1981年,小鼠胚胎干细胞系首先成功建立,这项技术的发明人之一英国科学家马丁·埃文斯于2007年获得诺贝尔奖;1998年,人类胚胎干细胞系成功建立,小编预测发明人美国科学家詹姆斯·汤姆森有望获得诺贝尔奖,前提是胚胎干细胞产品成功获批上市,这一天也许5-10年就能到来。
2006年,日本科学家山中伸弥发明iPS技术。iPS细胞在很多方面和胚胎干细胞很类似,特别是关键的四倍体发育实验结果(2009年由周琪院士、高绍荣等团队分别报道)。由于iPS细胞可以从体细胞重编程获得,绕开了胚胎干细胞建系过程中利用早期胚胎(尽管这些胚胎通常都是IVF手术剩余的无用材料)这一步,大大降低了伦理方面的争议。因此,iPS技术诞生伊始,就受到科学界及社会的追捧。山中伸弥本人也凭借这项发明获得2012年的诺贝尔奖。
然而,随着研究的深入,科学家逐渐意识到iPS细胞尽管和胚胎干细胞无限接近(类似程度取决于诱导iPS细胞的技术及单个iPS细胞系的质量,需要大量的鉴定工作,而且目前缺少绝对可靠的区分标准),二者之间并不能画等号。另外,不同体细胞来源的iPS细胞,在分化潜能上有所不同,即表观遗传记忆现象。因此,现阶段就声称iPS技术可以完全取代胚胎干细胞研究,为时尚早。
目前科学家已经发明了不破坏胚胎,从单个细胞建立胚胎干细胞系的技术(2008年,Chung et al)。只是实际情况中,这一技术的价值并不大,除了伦理上的考量。一般胚胎干细胞建系的材料来自IVF剩余胚胎,从这些胚胎中分离单个细胞建系,剩余的胚胎部分通常没其他用途。这一技术目前最大的医学价值是产前诊断,即从IVF胚胎中取一个细胞进行基因检测,剩余胚胎部分仍能正常发育成个体。
因此,在2016版的《ISSCR干细胞研究和临床转化指南》中这样写道:干细胞研究在提升我们对人类发育和疾病的理解方面有巨大前景;要研究解决与人类发育早期阶段相关的问题,建立某些类型的多能干细胞系,则必须研究人类胚胎。ISSCR坚持认为,在严格的科学和伦理监管下,对植入前人类胚胎的科学研究在伦理上是允许的,特别在人类发育、遗传和染色体疾病、人类生殖和新型疾病治疗方法等领域。小编认为十分客观和中肯。
二、伦理指导原则
小编认为,目前国际上关于干细胞研究及临床转化中伦理问题的规范,最全面的当属国际干细胞研究学会(ISSCR)公布的指南。ISSCR先后于2006年及2008年公布了《人类胚胎干细胞研究规范指南2006》和《干细胞临床转化指南》,并于2016年将二者合并,公布了《干细胞研究和临床转化指南》。《指南》分为五部分,第一部分是基本伦理原则,第四部分关于媒体报道,第五部分关于标准制定,核心是第二部分的胚胎干细胞相关研究及第三部分的临床转化。
通篇读下来,小编的感受是《指南》的起草遵循国际基本伦理原则及主要国家关于胚胎干细胞相关研究的规定,十分专业和合理,可以作为各个国家制定相应法规的参考。如《指南》第一部分规定,临床试验永远不能因对未来患者的受益承诺而无视当下研究受试者的福利;有效的知情同意权,这意味着无论是在研究还是治疗情况下,都应该给参与者提供准确信息,让其了解相关风险,以及基于干细胞的新的干预的证据状态。尽管干细胞有着巨大的应用前景,在研究阶段仍要优先考虑受试者的福利,不能拿这部分先行者当“小白鼠”。
在人类胚胎研究的可容许性及严格的科学和伦理监管要求方面,ISSCR的立场与其他相关组织的政策声明是一致的,包括美国生殖医学学会(美国生殖医学学会伦理委员会,2013)、欧洲人类生殖及胚胎学会(ESHRE伦理和法律工作组,2001)、美国妇产科医师学会(2006)、英国人类受精与胚胎学管理局(2008)。关于干细胞治疗临床试验,必须遵循国际公认的关于伦理设计、临床试验开展以及受试者保护的原则(包括美国卫生,教育和社会福利部,1979;欧盟欧洲议会和理事会,2001;世界医学学会,1964)。主要要求包括有充分的临床前数据,独立的监管和同行评议,公平的受试者选择,知情同意,研究受试者的监察,研究实施的审核,以及临床试验的注册和报告。
对于是否有必要成立专门的伦理委员会,ISSCR的态度比较开放。以EMRO流程为例(包含对人类胚胎干细胞研究的监管,以及对一些并不特别需要获取干细胞的研究的监管),可以在机构、地方、地区、国家或国际层面单独开展,也可以多层面联合开展,而且并不需要单独的、专门的委员会来执行,但前提是整个审查流程有效、公正、严格。
三、胚胎研究伦理关键点分析
关于胚胎干细胞相关研究,ISSCR将其分为3类。这3类中,第1类无需审查;第2类需要审查后才能开展;第3类禁止研究。
第1类基于已有人胚胎干细胞系的研究,由于之前已经通过伦理审查,因此这里不再需要额外审查;另外,关于重编程的研究,只要理论上得到的细胞不具备发育成人类胚胎的能力,则无需审查。第2点背后的技术逻辑是全能细胞和多能细胞的区别。胚胎干细胞属于多能干细胞,正常情况下不能发育成滋养外胚层,光凭自身无法形成人类胚胎;而全能细胞具备分化成胚胎和胚外组织的能力。因此,不是所有的重编程研究都没有伦理争议。
第2类包括8条,根据内容又可分为3块。前3条属于研究材料的获得,包括胚胎和配子;第4条涉及在胚胎和配子上进行基因修饰,例如2015年中山大学教授黄军就进行的CRISPR/Cas9修饰人类胚胎的研究;第5-8条包括胚胎干细胞建系、全能细胞研究、人胚胎体外发育及混合胚胎研究,这几条研究的红线是体外发育的胚胎形成原条或生殖细胞,目前国际上的共识是时间不能超过14天。
第3类跟第2类在内容上互补,进一步细化各类研究的红线,可以分为两块。一块是胚胎分化成原条或生殖细胞,无论是通过体外培养、子宫外或非人类子宫内发育、嵌合体的技术手段(分别对应1、2、5条);第二块是经过基因修饰的卵子的体内发育,包括替换整个基因组(核移植,即克隆人)或修饰某个基因。
随着技术的进步,ISSCR又对两类新技术做出规定,包括基因修饰和嵌合体研究。通过CRISPR/Cas9等基因修饰技术,理论上可以彻底治愈各类遗传病。然而,这类技术尚不成熟,而且有被滥用的风险(如通过优化基因得到超级人类),因此ISSCR目前对这类研究持否定态度。对于另一种治疗手段(线粒体替代疗法),由于采用完全不同的方法并且不需要直接对核基因组进行修改,ISSCR持支持态度,并且国际上(英国等国家)已有成功应用的报道。另一类研究是通过人类全能或者多能细胞与动物宿主进行融合以实现中枢神经系统或生殖系的嵌合,需要专门的研究监管,背后的逻辑是很难定义这类人-动物嵌合体的属性。
四、临床转化伦理关键点分析
临床转化这部分最核心的问题有两类,一类是治疗细胞的来源,另一类是临床试验的设计。
关于生物材料的获取,总的指导原则是所有用于人类胚胎和干细胞研究的配子、胚胎和体细胞在获取前必须进行严格的审查。另外,如果研究人员从组织样本库中获得体细胞,知情同意书不是必须的,因为在捐献者决定将相关生物材料捐给组织样本库的环节中,已经签署了知情同意书,样本库要做的就是根据知情同意书中规定的应用范围独立或通过合作的形式开展基础和转化研究。《指南》建议,对于进行同种异体使用的细胞捐赠,捐赠者需要签署书面的合法有效的知情同意书,同意书应涵盖:在合适条件下潜在研究及治疗的应用、意外发现的反馈、研究成果潜在的商业应用以及其他问题所适用的条款。2017年8月,中国细胞生物学学会干细胞生物学分会发布《干细胞通用要求》,对于知情同意书范围做出相似规定,符合国际惯例,有利于推动研究成果转化。
关于生物材料捐献,最棘手的问题是捐赠者补偿。完全不给予补偿显然不合理,而补偿的方式和标准必须拿捏得恰到好处,稍有不慎就会有买卖人体器官之嫌。目前国际通用的原则是:对于选择提供用于研究的储存组织的个人,不应该在他们决定参加研究之前对样本储存的费用给予报销,杜绝捐赠和获利间的联系;对于获取用于研究的新鲜体细胞和精子的情况,在审查流程中可以确定对捐赠者实际花费的报销,不得为捐赠者提供超出实际费用的支付或者任何形式的利益,也是为了避免补偿标准超出实际花费,导致捐赠者为了经济利益作出捐赠决定。
对于临床转化,《指南》规定获批前临床试验的任何阶段都需要知情同意流程,尤其对于早期干细胞治疗,应尽量避免受试者对试验结果过于乐观,并消除对治疗效果的误解。另外,早期治疗的首要考虑因素是安全性,其次才是疗效;对新治疗手段的初始测试应控制在低风险下进行,即使研究很可能得到治疗效果,也不能直接升级到更高风险的测试条件。特殊情况下,临床医生与临床科学家可以考虑为极少数患者提供在常规临床试验之外的、未经证实的干细胞治疗,但必须严格遵守《指南》所列举的高度约束性规定。
五、小结
干细胞研究与转化在生物医学上有广阔的应用前景。然而对于任何新技术,必须严格监管。一旦滥用,就会打开潘多拉魔盒,结果很难掌控,甚至有可能带来一场人道主义灾难!
参考文献
1.《干细胞研究和临床转化指南》(2016,ISSCR)
2.《干细胞通用要求》(2017,中国细胞生物学学会干细胞生物学分会)
来源:生物制药小编
作者:吃瓜群众
来源:生物制药小编 作者:吃瓜群众
为你推荐
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
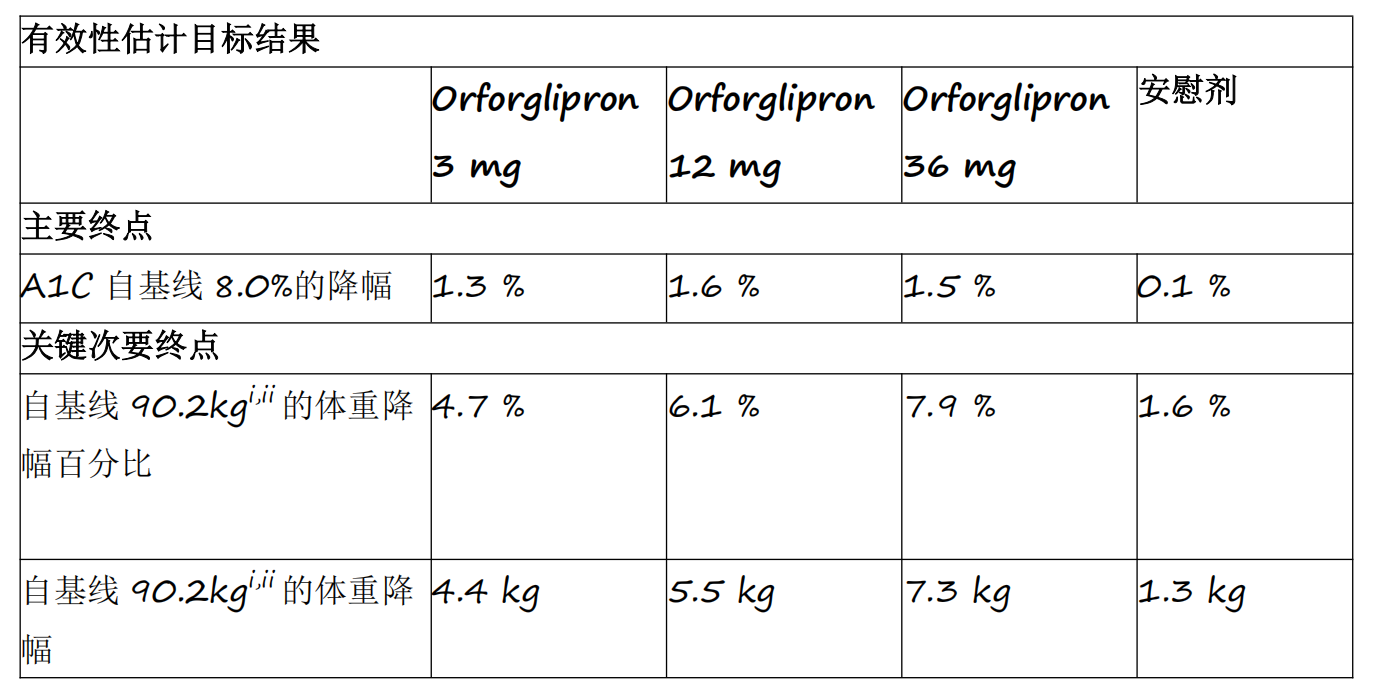
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12
 资讯
资讯 扬帆出海正当时:Cytiva 为中国生物药企绘制全球合规航海图
峰会聚焦法规解读、国际监管环境、中国生物药企业出海案例等关键议题,通过专家分享和深入解读,为中国生物药企提供全球化战略指导和合规支持;
2025-04-15 17:00
 资讯
资讯 全国肿瘤防治宣传周:礼来携手信达生物、和黄医药加速赋能本土医药创新
礼来携手本土合作伙伴信达生物、和黄医药齐聚上海,共话本土医药创新发展,探索加速惠及中国肿瘤患者的新模式
2025-04-15 16:27
 资讯
资讯 ADC明星企业映恩生物港交所上市,开盘高开91.33%
上市首日,其股价开盘高开91 33%,随后涨幅迅速扩大至127 06%,午间收报214 80港元,市值突破178 66亿港元,成为近年来港股18A生物科技公司中最亮眼的IPO案例之一。
2025-04-15 13:19