PD-1/L1检查点抑制剂药物并不是只在美国和欧洲市场竞争激烈。数据分析公司PharmCube报告称,Keytruda和Opdivo也应该在中国进行市场营销,因为中国本土的4个生物制药商已经正在争夺他们的市场份额,其后还有十多个PD-1/L1制药企业正在积极研发新药,希望能够在中国和世界市场范围内占有一席之地。
据PharmCube预测,2019年上半年,信达生物、君实生物、百济神州和恒瑞医药全部都会将旗下PD-1/L1全部投放市场。
2017年12月13日,信达生物的信迪单抗注射液(PD-1单抗)上市申请获CDE受理,适应症是霍奇金淋巴瘤,这是继百时美施贵宝(BMS)的Nivolumab注射液之后第2个在中国提交上市申请的PD-1单抗。2018年2月11日,默沙东PD-1单抗帕博利珠单抗注射液的上市申请(JXSS1800002)获得CDE承办受理,Keytruda成为第3款在中国提交上市申请的PD-1/PD-L1药物。2017年默沙东Keytruda的全球销售额是38.09亿美元,距离Opdivo的差距缩小到11亿美元。
2018年3月9日,君实生物发布公告称其重组人源化抗PD-1单克隆抗体注射液(JS001)于近日正式获得CFDA的新药申请受理通知书。JS001的中文名称正式亮相——特瑞普利单抗。据君实生物负责人透露,此次获得受理的申请是JS001的新药上市申请,适应症为黑色素瘤。JS001是国内企业首个获得CFDA 临床试验批件的抗 PD-1单克隆抗体注射液,目前正与国内多家临床中心开展黑色素瘤、鼻咽癌、胃癌、肺癌、食管癌、尿路上皮癌等10余个适应症 I~III 期临床试验。JS001于2018年1月获得FDA临床试验批准,是君实生物首个在全球开展临床试验的生物制品。
恒瑞医药和百济神州目前也有PD-1单抗产品处于III期试验阶段,测试的疾病有经治非小细胞肺癌、食道癌和肝细胞癌。
反观美国市场,目前有5种检查点药物,Regeneron和赛诺菲正在激烈的争夺第6名上市的竞争。不过癌症研究机构最近在全球范围内调查发现,全球市场共有164种新PD-1产品,正在进行1502项涉及PD-1/L1的临床试验,其中有1105项联合用药研究。而中国制药公司在PD-1/L1产品研发试验的进程正在加强,紧随着4位领导者身后又新增加了13家中国本土公司,其中6款药物处于I期试验,3款药物即将进入临床试验阶段,还有9款药物正在新药研发的阶段。
下表中所示的未配对资产可以帮助西方公司寻找适合添加到他们生产线的临床阶段PD-1/L1药物。
不过并不是所有的药物都是一帆风顺的。 2月14日,恒瑞医药公告称,经与Incyte协商,双方签订了终止合作开发PD-1单克隆抗体SHR-1210的协议。恒瑞与Incyte于2015年9月2日签订了SHR-1210的合作开发协议,恒瑞将SHR-1210除中国大陆、香港、澳门和台湾地区以外的全球独家临床开发和市场销售权利许可给Incyte。该笔交易总额合计7.95亿美元,协议签订后30天内Incyte向恒瑞支付了2500万美元首付款。双方此次终止SHR-1210的合作开发并不算太意外。
Incyte在去年10月以9亿美元从MacroGenis引进了另一款PD-1单抗药物MGA012所有适应症的全球开发和商业权利。Incyte虽然此前一直未明确透露SHR-1210的合作开发动向,但花了更大代价的首付款再引进一款PD-1药物之后,业内已有猜测Incyte可能会终止开发SHR-1210。
来源:新浪医药(微信号 sinayiyao) 作者:范东东
为你推荐
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
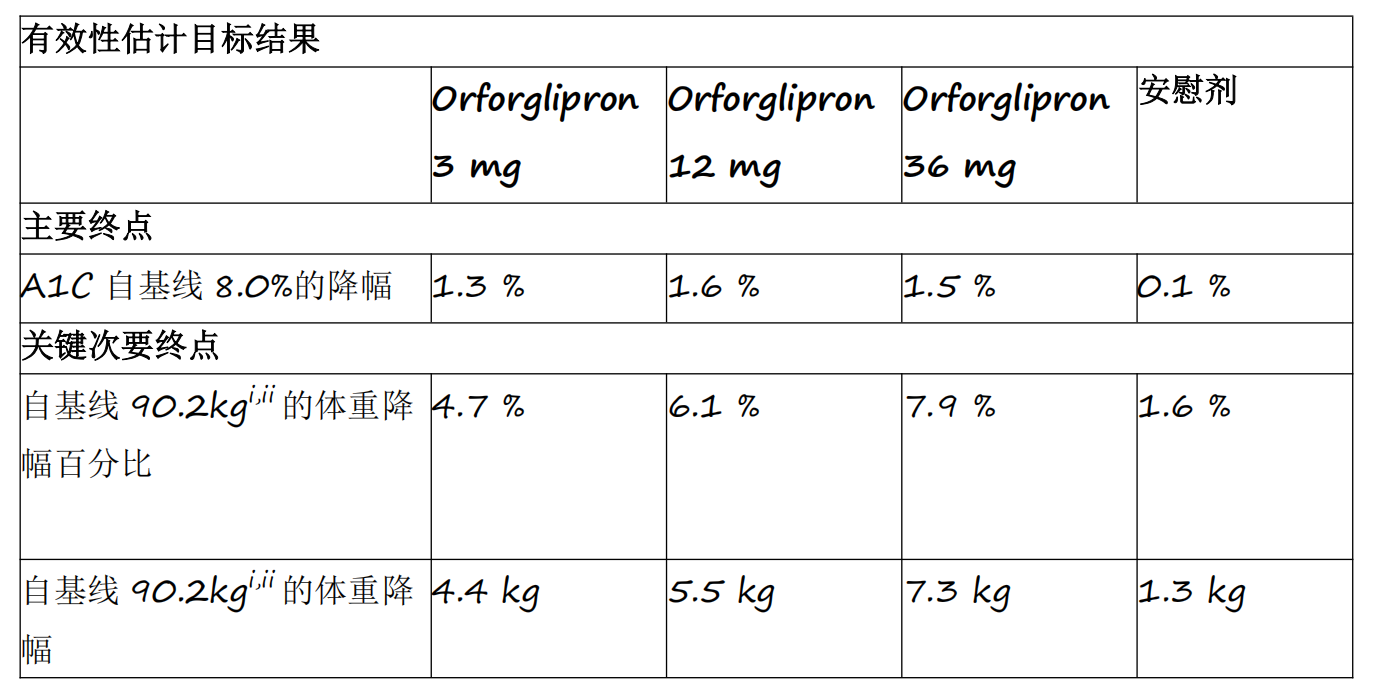
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12
 资讯
资讯 扬帆出海正当时:Cytiva 为中国生物药企绘制全球合规航海图
峰会聚焦法规解读、国际监管环境、中国生物药企业出海案例等关键议题,通过专家分享和深入解读,为中国生物药企提供全球化战略指导和合规支持;
2025-04-15 17:00
 资讯
资讯 全国肿瘤防治宣传周:礼来携手信达生物、和黄医药加速赋能本土医药创新
礼来携手本土合作伙伴信达生物、和黄医药齐聚上海,共话本土医药创新发展,探索加速惠及中国肿瘤患者的新模式
2025-04-15 16:27
 资讯
资讯 ADC明星企业映恩生物港交所上市,开盘高开91.33%
上市首日,其股价开盘高开91 33%,随后涨幅迅速扩大至127 06%,午间收报214 80港元,市值突破178 66亿港元,成为近年来港股18A生物科技公司中最亮眼的IPO案例之一。
2025-04-15 13:19