仿制境内外已上市的原研品,应当与被仿制药具有同样的活性成分、给药途径、剂型、规格和相同的治疗作用。仿制药注射剂的评价首先应关注与原研品的物质基础一致性。国内部分仿制药由于原辅料质量、工艺流程及质量控制有差异,或者为缓释、靶向等特殊剂型,难以确认物质基础一致性是否导致安全有效性的改变,需要非临床评价进行进一步比对。
仿制药的非临床评价是通过正常动物或模型动物,对比仿制药和原研品在安全性、有效性上的差别,有助于加强药学质量控制,预测临床用药的安全性。试验体系建立在严格执行《药物非临床研究质量管理规范》基础上,通过控制动物来源、饲养条件、操作规范等,降低动物自发病变发生率,减少环境因素对试验结果产生的影响,保证试验的准确、稳定,提高非临床试验结果对临床应用的预测程度。
下面将注射剂按分散系统分成溶液型注射剂和特殊注射剂(脂肪乳、混悬型、纳米制剂等),分别对仿制药的非临床研究要求进行综合。
1.溶液型注射剂
溶液型注射液的非临床研究包括溶血性、刺激性、过敏性试验,属于注射剂的一般要求。
溶血性试验
仿制药由于上市药物研究信息已知,常规可仅采用肉眼观察的体外试管法来检验受试物的溶血性。目前新技术如溶血率法可对溶血程度进行量化,并排除注射剂颜色等干扰,鼓励用于非临床安全性评价中。
刺激性试验
刺激性试验主要观察动物按照临床拟用途径给药时,血管、肌肉、皮肤等部位接触制剂后是否引起红肿、充血、渗出、变性或坏死等炎性病变,同时观察动物的一般状态、行为、体征等,进行局部与整体的综合评价。受试药物浓度不应低于临床拟用最高浓度,给药体积不应过小,同时注意给药次数、速度等对试验结果的影响。
按照我国和FDA的相关指导原则,静脉注射给药途径的注射剂如有药液渗漏造成血管外组织刺激性的担忧,可补充肌肉刺激性试验,部分国家如日本,则考察静脉注射制剂对血管周的影响,在静脉注射部位周围皮下注射0.2ml药液,观察血管周刺激性反应。
皮下、皮内等途径注射剂的刺激性试验,应结合品种的具体情况和研究中发现的具体问题,采用合理的方法以提供更有价值的试验结果,提高试验的临床预测性。
过敏性试验
过敏性是注射剂临床使用最常见、最严重的不良反应。进行何种过敏性试验应根据药物的特点、临床适应症、给药方式、发生机制、影响因素等确定。仿制药注射剂通常局部给药发挥全身作用,主要考察Ⅰ型过敏反应,通常情况下仅进行主动全身过敏试验。某些抗生素或含有特殊辅料的注射剂,视具体情况考虑是否增加其它过敏性试验。
2.特殊制剂
随着药物创新步伐的加快,新的注射类型产品不断出现,如微乳、胶束、脂质体等。这些新剂型可能影响药物体内药代动力学行为,如延长药物与靶组织或细胞作用的时间,选择性地浓集于靶组织或器官等,以改善疗效或减轻全身毒性。但同时,这些新剂型仿制药易受处方和工艺的影响,活性成分的形态、粒径等与原研品的微小差异,常引起在暴露量、组织分布、消除等方面的差别。因此,在特殊制剂申请仿制注册时,非临床研究应首先以药代动力学对比研究为主线,观察药物释放速度、释放程度、组织分布、蓄积情况等是否改变,根据其结果确定后续研究项目、给药方案等内容。
药代动力学对比研究可参考原研品已有的研究信息,选择一种适当的动物(通常采用大动物如犬、猴)单次给药,与原研品进行生物利用度/生物等效性试验,药代参数包括药物达峰时间(Tmax)、达峰浓度(Cmax)、血药浓度-时间曲线下面积(AUC0-t、AUC0-∞)、半衰期(T1/2)等。在无可行的药代动力学研究方法时(如无灵敏的血药浓度检测方法、浓度和效应之间不存在线性相关),可以考虑用明确的可分级定量的药效学指标通过效应-时间曲线,与原研品进行比较。根据药物作用特点,还应考虑组织分布、消除的比较研究(如脂质体、微球等在特定组织发挥特定作用等品种),根据组织分布的结果预测安全性上的变化,后续毒理研究的关注点等。
药代动力学参数的改变提示仿制药与原研品在有效性、安全性上并不一致,后续应有针对性地进一步进行药效学、毒理学的全面评价,如血药浓度是否能维持在治疗窗之内;暴露量的增加、半衰期的延长是否导致安全性的变化;骨髓分布的增加应在毒理试验中关注对造血系统的影响等。
在毒理学试验中观察到未预料,而且对安全性评价有重要意义的组织病理学改变时,应考虑进一步进行多次给药的药代动力学试验,分析毒性反应的药代动力学依据,为临床研究设计提供参考。
3.共性问题
试验样品的选择与暴露
应采用工艺相对稳定、纯度和杂质含量能反映临床试验拟用样品和/或上市样品质量和安全性的试验样品,加强受试物分析,保证受试物在试验周期内的质量和配制准确性。同时,根据观察指标和模型合理性确定适当的动物种属和试验体系,以最大程度暴露风险。
阳性结果的处理
非临床安全性评价如果出现阳性结果,首先应对试验条件进行分析,结合给药方案、试验操作、不良反应的性质等多因素进行综合评价,判断是否因仿制药与原研品质量上的不一致导致的安全性问题。
给药方案是安全性评价的关键,应兼顾受试物自身特点和临床用药情况综合考虑。如麻醉、细胞毒类等制品,易感动物在临床用法用量下可引起严重不良反应,干扰结果判定。建议根据品种特点进行预试验,调整试验动物、给药浓度、体积或给药速度,筛选出最适合的给药方案,充分暴露的同时兼顾结果判定。
在阐明其研究方法或技术科学、合理的前提下进行的安全性试验出现阳性结果时,首先应该对结果进行甄别,结合药物自身特点,区分是否为药理作用、动物自发性病变或类过敏反应等。
在排除上述因素后,应加入原研品对照组进行比较研究,以保证药物临床应用的安全有效性。结果出现与原研品不一致的安全性数据时,应结合仿制药的药学质控信息情况,重点关注杂质、辅料或理化性质等方面内容,对其合理性和必要性进行综合、全面的评价。
豁免情况
目前认为,注射用水、葡萄糖注射液、氯化钠注射液、葡萄糖氯化钠注射液、甘露醇注射液申请仿制注册时不需要提供溶血性、刺激性和过敏性试验资料。
进口产品的要求
对于进口产品,如果在境外上市时进行了规范的动物溶血性、刺激性、过敏性试验和/或进行了规范的临床试验对局部安全性研究,则可提供上述动物资料或临床资料替代。
4.结语
保证安全、有效、质量可控是仿制药临床应用的前提。非临床评价是仿制药制剂水平评价过程中一个重要的环节。在评价仿制药的安全有效性时,应具体问题具体分析,针对药物的自身特点,结合药学和原研品临床信息进行评估,同时,鼓励采用更灵敏的新技术新方法用于非临床安全性评价,提高临床预测性。
来源:中国药审 作者:CDE
为你推荐
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
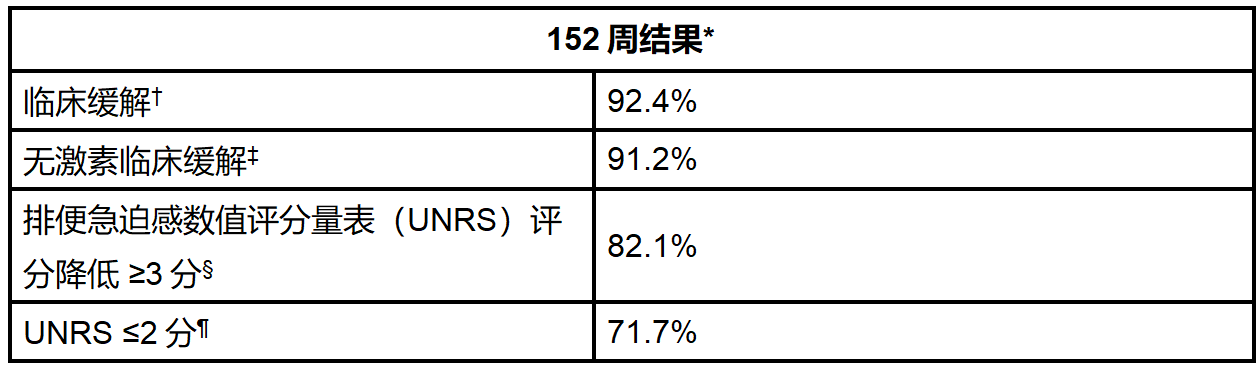 资讯
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54






