9月6日,国家药典委员会、中国医药科技出版社在京联合召开《中华人民共和国药典》2010年版第二增补本(以下简称《第二增补本》)发行工作会议。据介绍,药典增补本是对药典的修订和增补,与药典具有同等法律效力。《第二增补本》在《中华人民共和国药典》2010年版及《中华人民共和国药典》2010年版第一增补本的基础上进行了进一步的完善和补充,内容有较大的调整,涉及药品品种449个,附录、通则22个。
DNA分子标记鉴别中药材
《第二增补本》收载新增品种289个。其中,一部(即中药部)新增成方制剂75个,二部(即化药部)新增209个(化学药203个、辅料6个),三部(即生物制品部)新增5个(预防类1个、治疗类4个);修订或订正品种160个,其中一部修订或订正品种99个(中药材17个、成方制剂82个),二部修订或订正品种46个(化学药品41个、辅料5个),三部修订或订正品种15个(预防类12个、治疗类3个)。同时,《第二增补本》还对《中华人民共和国药典》2010年版的附录进行了增修订,其中一部增订2个;二部增订2个,修订或订正6个;三部修订或订正通则和附录2个。
据介绍,除了收载品种有较大幅度的增加,《第二增补本》还着重强调保障药品的安全性和提高药品质量可控性。如针对当前热点的中药材问题,《第二增补本》一部增加了中药注射剂重金属及有害物质残留量的限量要求,修订了中药材及饮片二氧化硫残留量的限量值。
“《第二增补本》在附录中新增了聚合酶链式反应(PCR)法鉴别药材,同时在农药残留测定法中也对有机氯类农药残留新增了检查方法。”国家药典委秘书长张伟说。
据中药专家介绍,中药的同名异物或同物异名现象普遍存在,以及伪品、混淆品和误用品等,对中药制剂的质量、药效等都有直接影响。而且,即使是同种药材,由于产地不同也表现出质量和疗效上的差异,这些问题对中药材鉴别方法提出了新的挑战,依赖经典形态分类以及传统鉴别方法已无法满足鉴别的需要。而以PCR为基础的DNA分子标记鉴别技术在中药材真伪鉴别、多基源品种的鉴别中表现出极高的准确率和重现性。
“除在附录中扩大收载一些成熟的新技术方法外,品种正文中也进一步扩大了新技术的应用。”张伟说。
据悉,《第二增补本》已由国家食品药品监督管理总局批准颁布,并将于12月1日起执行。
标准提高满足临床常用
据预计,《中华人民共和国药典》2010年版将有3个增补本陆续于2015年前出版。在对《中华人民共和国药典》2010年版和增补本进行增修订的基础上,将形成《中华人民共和国药典》2015年版。
“预计《中华人民共和国药典》2015版收载的品种将达到6500种,较之2010版的4567个收载品种,将有大幅度的增长。”张伟透露,2015版药典的收载品种预计可以满足国家基本药物目录、国家基本医疗保险、工伤保险和生育保险用药的需求,实现全部覆盖临床常用药品。
此前,国务院印发的《国家食品药品安全“十二五”规划》要求在2015年前,完成6500个药品标准提高工作。据悉,2013年中央财政安排了专项资金13557万元,用于本年度1177个药品标准的修订、完善,并完成34个药典检测方法项目的提高工作,项目执行时间为2013年12月底前,目前任务落实工作已经启动。
来源:医药经济报
为你推荐
 资讯
资讯 超10亿美元,映恩生物创新临床前ADC药物授权GSK
12月4日,映恩生物宣布与GSK已就一项抗体偶联药物(ADC)DB-1324达成独家授权协议。根据协议,GSK将获得全球(不包括中国大陆、香港地区和澳门地区)的独家授权,以推进该ADC药...
2024-12-04 09:56
 资讯
资讯 拜耳在2024年北美放射学会年会上展示其放射学组合创新
拜耳继续推进其全面的放射学产品组合,在开发管线和人工智能(AI)领域的创新都取得了进展。公司将在2024年12月1日至5日在美国芝加哥举行的北美放射学会年会上展示Gadoquatrane...
2024-12-03 15:44
 资讯
资讯 优时比与博锐生物达成战略合作,加速倍捷乐®中国上市进程
在中国,比奇珠单抗已于2024年7月获得中国国家药品监督管理局(NMPA)批准,用于治疗常规疗法效果不佳或不耐受的活动性强直性脊柱炎(AS)成人患者,并于9月获批用于治疗放射学...
2024-12-03 10:35
 资讯
资讯 CPL-01有望开启镇痛新时代,远大生命科学集团与加立生科达成战略合作
根据协议约定,远大生命科学将向加立生科支付首付款,以及里程碑款;同时加立生科授权远大生命科学为其CPL-01项目在中国的独家商业化合作伙伴,并根据协议约定向远大生命科学支...
2024-12-02 09:25
 资讯
资讯 全国中药饮片采购文件正式发布,涉45个品种
本次联合采购中药饮片45个品种,分别为黄芪、党参片、金银花、当归、红花、麦冬、太子参、白芍、川芎、丹参、山药、蒲公英、牡丹皮、桔梗、炙黄芩、白术、炒白芍、炙甘草、茯苓...
2024-11-30 11:20
 资讯
资讯 国家药监局发布医药代表管理办法(征求意见稿)
医药代表应当具有医学、药学或相关专业本科及以上学历(或者中级及以上专业技术职称);具有药品临床理论知识及实践经验,或者具有药品研发、生产、检验、质量管理等岗位工作经...
2024-11-29 18:50
 资讯
资讯 三高共管,三慢共防:2024中国医药城大健康产业论坛“慢病协同共管”专题圆满举办
大会以“三高共管,三慢共防”为主题,聚焦共病共管、心肾保护、跨界融合、慢病管理创新模式、创新产业技术等前沿内容
2024-11-29 15:03
 资讯
资讯 湖南省视觉功能及儿童眼病学术研讨会暨世界近视眼大会成果宣讲会在长沙举办
11月28日,由爱尔眼科湖南省区视光学组、爱尔眼科湖南省区小儿眼科学组主办、长沙爱尔眼科医院承办的“湖南省视觉功能及儿童眼病学术研讨会暨世界近视眼大会成果宣讲会”,在长...
2024-11-29 09:09
 资讯
资讯 一个手功能康复训练仪器的设计
系统由3个模块组成:指示锻炼情况和治疗持续时间,并为气动螺纹管提供动力的驱动泵;穿戴在健康一侧手臂的镜像手环,及穿戴在患肢的康复机器手套。
2024-11-29 09:02
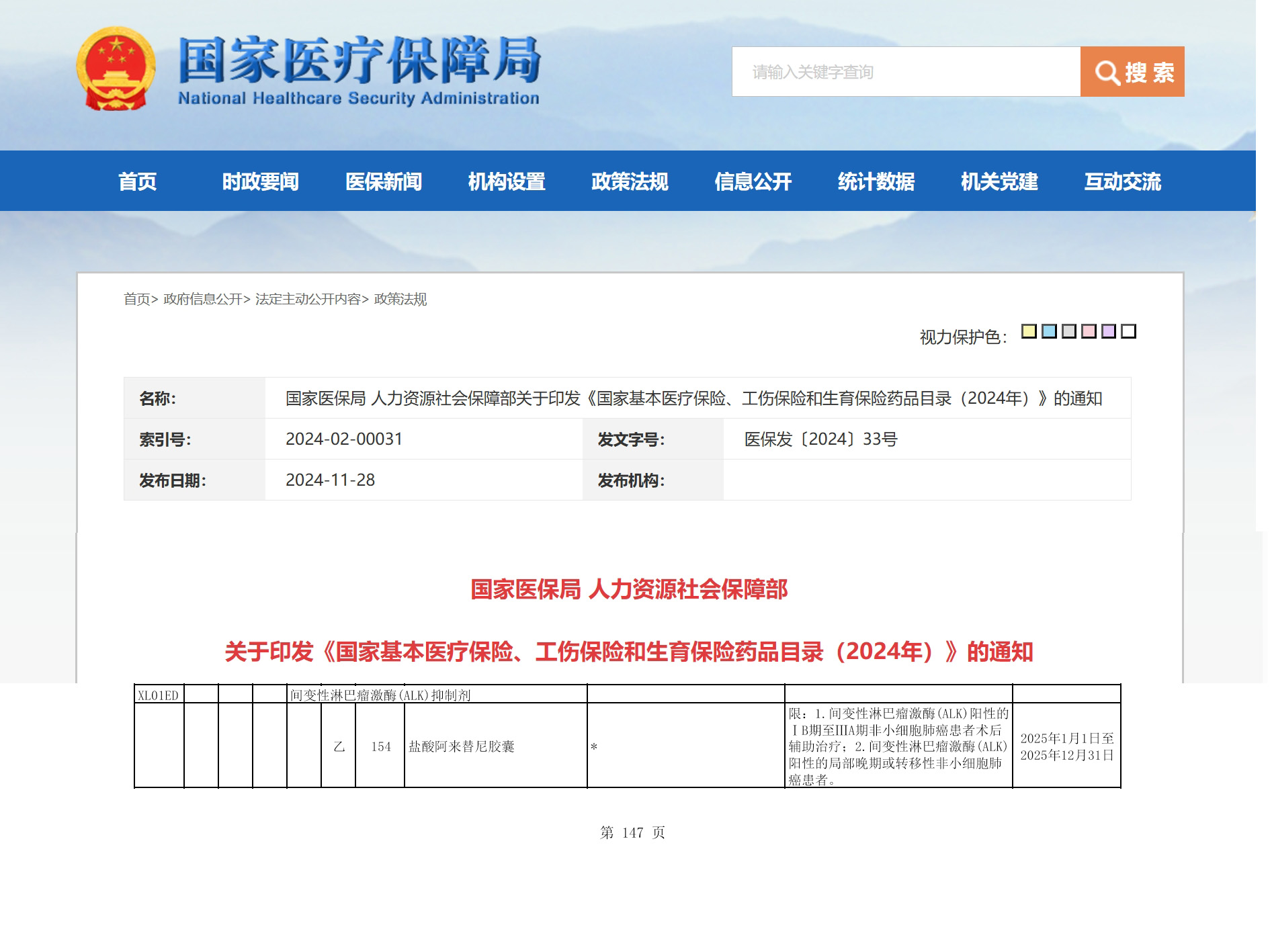 资讯
资讯 阿来替尼ALK阳性早期NSCLC术后辅助治疗适应症成功纳入医保
2024年11月28日,国家医保局公布了《国家基本医疗保险、工伤保险和生育保险药品目录(2025年)》(以下简称:国家医保目录),安圣莎®(通用名:阿来替尼)ALK阳性早期非小细胞...
2024-11-28 18:58
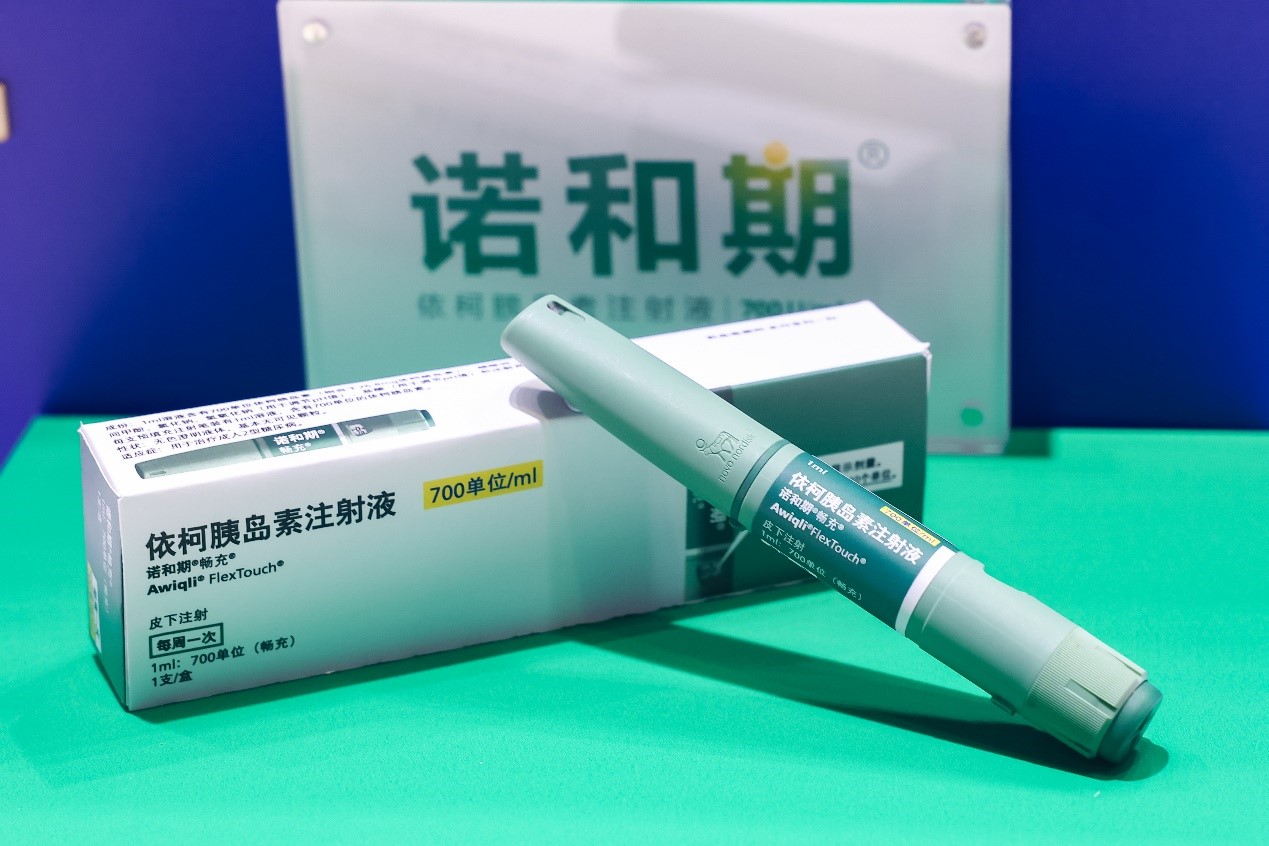 资讯
资讯 全球首个胰岛素周制剂诺和期(依柯胰岛素注射液)成功纳入国家医保目录
11月28日,根据国家医疗保障局最新公布,依柯胰岛素注射液(商品名诺和期®)被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2024年)》。目录将于2025年1月1日起正式执行。
2024-11-28 15:52
 资讯
资讯 一款国产PD-1被首次被纳入,多款“全球新”在列,2024国家医保谈判结果发布(附完整版目录下载链接)
今日(11月28日),2024年版国家医保药品目录调整名单正式公布。
2024-11-28 14:49
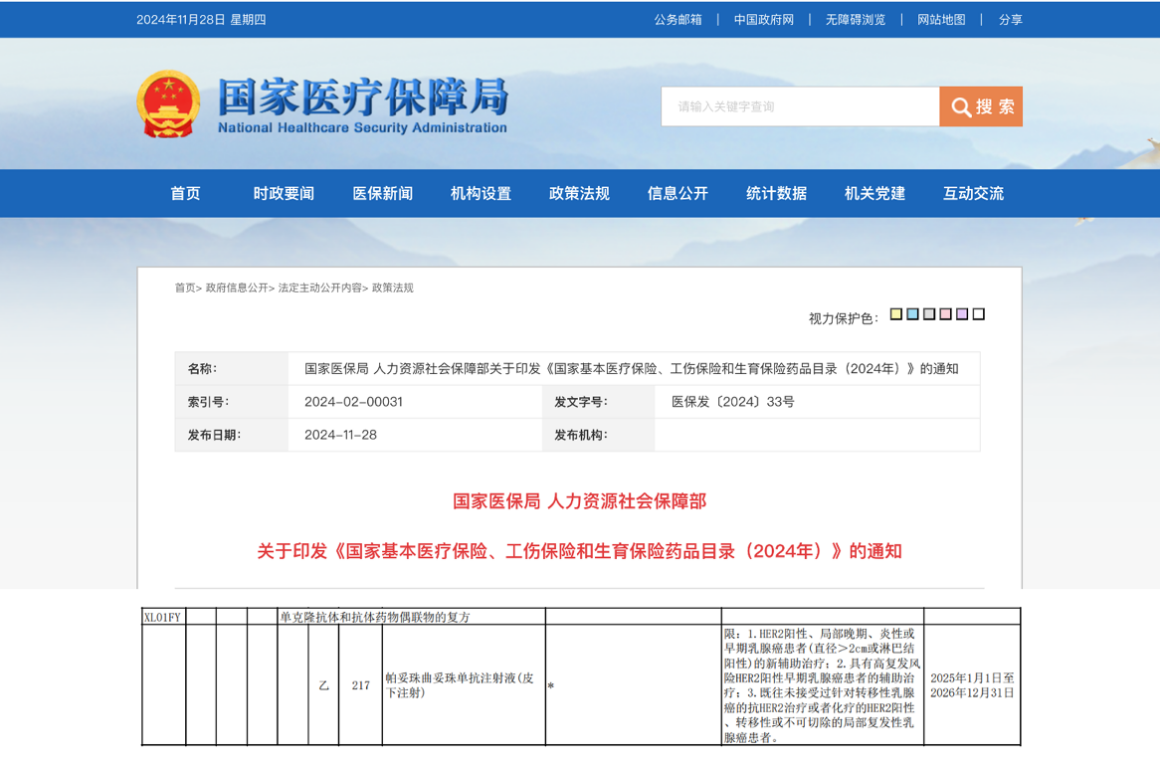 资讯
资讯 首个抗HER2复方皮下制剂赫双妥纳入国家医保目录,5-8分钟靶向治疗助力乳腺癌患者拥抱自由新生
2024年11月28日,国家医疗保障局发布最新公告,罗氏抗HER2乳腺癌皮下生物制剂赫双妥®(通用名:帕妥珠曲妥珠单抗注射液(皮下注射))正式进入《国家基本医疗保险、工伤保险和...
2024-11-28 13:53








