3月14日晚间,云南沃森生物技术股份有限公司(以下简称“沃森生物”)发布公告称, 控股子公司嘉和生物药业有限公司(以下简称“嘉和生物”)自主创新研发的注射用 GB235 单抗药物(新型重组抗 HER2 全人源单克隆抗体) 获得国家食品药品监督管理总局批准进入临床研究。
本药物是嘉和生物自主创新研发并具有全新序列的重组抗 HER2 全人源单抗,其主要适应症包括:治疗既往未曾接受抗 HER2 治疗或化疗的 HER2 阳性转移性乳腺癌。
目前国际上治疗 HER2 阳性转移性乳腺癌的单抗产品主要包括罗氏公司的曲妥珠单抗、 帕妥珠单抗(通用名 Pertuzumab,商品名 Perjeta?) 及抗体偶联药物 T -DM1。 帕妥珠单抗可通过阻断 HER2 受体的二聚化而阻滞其激活, 于 2012 年 6 月经美国 FDA 批准用于治疗 HER2 阳性的转移性乳腺癌。
2017年,曲妥珠单抗全球销售额 74.88 亿美元,帕妥珠单抗全球销售额 23.38 亿美元,T-DM1 全球销售额 9.73 亿美元,上述治疗 HER2 阳性乳腺癌的单抗药物销售额合计已达到 108 亿美元。
目前国内暂无注射用 GB235 同类药品生产上市,但有多家企业有针对相同靶点的类似单抗药物在开展临床申报注册。本产品具有广阔的市场前景。
来源: 新浪医药新闻
为你推荐
 资讯
资讯 圣因生物完成超 1.1 亿美元 B 轮融资,加速 RNAi 疗法全球布局
本轮融资由知名产业机构领投,国际主权基金、中国生物制药、君联资本等十余家机构跟投,全球制药巨头礼来公司战略入局,高瓴创投、启明创投等现有股东持续加码支持,融资规模创...
2025-12-12 16:59
 资讯
资讯 投后估值达21.37亿元,实体瘤细胞治疗领军企业君赛生物递表港交所
君赛生物共有5款在研产品,其中核心产品也是进展最快的是GC101,正开展上市前的关键II期临床试验,有望成为国内首个获批上市的TIL细胞创新药
2025-12-12 09:24
 资讯
资讯 ESMO-IO | ORR达41.7%!君赛生物GC101 TIL治疗晚期后线非小细胞肺癌I期数据首次公布
这不仅是全球首个无需高强度清淋化疗、无需IL-2给药的TIL疗法治疗肺癌的临床研究,也是国内首个公开披露该领域数据的注册性临床研究。
2025-12-12 09:17
 资讯
资讯 君合盟生物启动重组 A 型肉毒毒素治疗成人上肢痉挛状态临床 III 期试验,并完成首例患者入组
该临床试验由复旦大学附属华山医院李放教授和上海市养志康复医院(即上海市阳光康复中心)靳令经教授联合牵头
2025-12-11 21:06
 资讯
资讯 Medidata发布全新调研报告:临床试验AI应用价值凸显,超七成用户反馈“达到或超预期”
基于对来自全球制药公司、生物科技公司及合同研究组织(CRO)中超200位核心决策者的深度调研,报告显示,目前AI在改善患者招募、优化数据管理、控制运营成本和提升试验效率等方...
2025-12-11 20:57
 资讯
资讯 近20年首个全新类别抗菌药物醋酸来法莫林纳入医保,开启中国成人社区获得性肺炎治疗普惠新篇章
该产品继2025年6月30日获得国家药品监督管理局批准用于治疗成人社区获得性肺炎(CAP)后又纳入国家医保目录
2025-12-11 20:50
 资讯
资讯 专注 “生物学 + AI” ,普瑞基准完成超亿元 D 轮融资,加速 AI 驱动新药研发
本轮融资由信立泰、广投资本、申宏中恒基金联合领投,老股东金谷汇枫、聚翊投资持续跟投
2025-12-10 15:55
 资讯
资讯 别把“嗜睡”当懒癌!新型促觉醒药翼朗清®获批,专注维持日间清醒
促觉醒药物翼朗清®(盐酸索安非托片)正式获得中国国家药品监督管理局(NMPA)批准,用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度嗜睡(EDS)的成人患者的觉醒程度。
2025-12-10 11:04
 资讯
资讯 复星医药将其GLP-1产品全球化权益授权辉瑞,总里程碑付款近150亿人民币
12月9日晚间,复星医药发布公告称,公司控股子公司药友制药、复星医药产业与辉瑞共同签订《许可协议》,(其中主要包括)由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)...
2025-12-10 09:12
 资讯
资讯 Capricor Therapeutics公司宣布外泌体疗法Deramiocel在DMD三期中取得积极成果
近日,专注与外泌体疗法的Capricor Therapeutics(纳斯达克代码:CAPR)公司宣布其核心管线Deramiocel在杜氏肌营养不良症关键三期 HOPE-3 研究中取得积极成果。
2025-12-09 16:38
 资讯
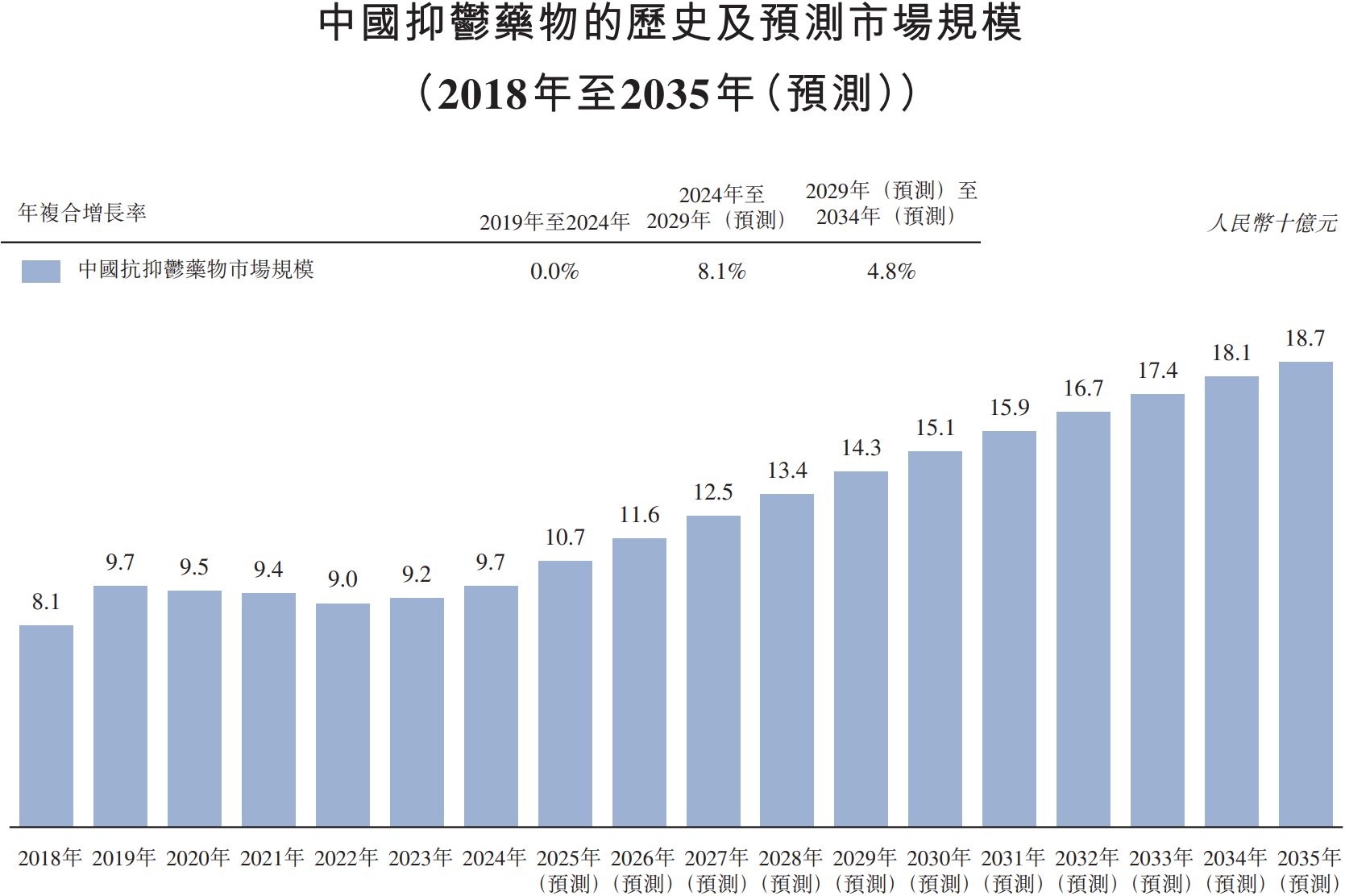
资讯 中药1类创新药剑指抑郁症治疗蓝海,远大医药GPN01360成功达到国内II期临床终点
国产抗抑郁症药物研发取得重大进展。近日,远大医药(0512 HK)的1 1类中药创新药GPN01360国内II期临床研究成功达到临床终点,产品表现出显
2025-12-08 18:27