一、美国生物制药公司Athersys异体骨髓干细胞MultiStem
美国Athersys公司的干细胞药物MultiStem,是来自于异体骨髓的MAPC(multipotent adult progenitor cells),已于2012年7月获美国FDA批准,用于治疗I型粘多糖贮积症(MPS-I),目前有望获批用于治疗急性中风。2017年3月在The Lancet Neurology报道了MAPC治疗中风的临床试验[5]。2011至2015年在美、英33个医学中心开展的2期临床试验,129名中重度急性中风患者,在发病后24-48小时内,静脉输入异体骨髓来源干细胞(MultiStem,MAPC)或者对照组,细胞数量为4x108-12x108(大剂量)。80%患者随访一年,在细胞治疗3个月内病情没有显著改善,但是在细胞治疗一年时,可见细胞治疗组病人持续恢复、残疾程度降低、发生感染的几率也降低[图5]。结果提示该疗法安全、无明显副反应发生。在中风后36小时内给予MAPC干细胞,能通过降低炎症反应、严重感染风险、增强机体的恢复来改善中风患者的预后。2016年9月28日MAPC细胞已获FDA批准进行Ⅲ期临床试验[6]。
图5,MultiStem治疗中风在3个月和一年时安全性、有效性分析[5]
二、比利时TiGenix公司异体脂肪干细胞Cx601
总部位于比利时鲁汶(Leuven)的TiGenix公司,其异体脂肪来源的间充质干细胞(MSC)Cx601 [1],在治疗克罗恩病复杂性肛瘘的3期临床试验中,表现出色,能维持患者症状缓解超过52周。2016年9月Lancet杂志[1]报道了在欧洲7个国家、49所医院开展的随机、双盲临床Ⅲ期试验结果:212名复杂性肛瘘患者患者,107例在接受标准治疗的同时,局部给予一次性注射120×106个Cx601细胞,另一组105名患者接受安慰剂(盐水)治疗作为对照组。干细胞治疗后在第24周时,意向治疗分析ITT(Intertion-to-treat)、mITT(modified intention to treat)、PP(per protocol)均提示细胞治疗组有明显统计学差异[图1]。在注射细胞后第52周,Cx601组的症状缓解率亦显著高于对照组 (59.2%比41.6%)。治疗副作用在两组患者中近似(Cx601组20.4%,对照组26.5%)。Cx601细胞能通过分泌系列细胞因子抑制炎症反应和免疫调节等,治疗因克隆氏病而造成的复杂性肛瘘。目前TiGenix公司正在全球开展Cx601的随机、双盲临床Ⅲ期试验[2],以获得在美国FDA的上市许可。
图1,干细胞治疗后24周时,意向治疗分析提示治疗有明显差异(ITT=Intertion-to-treat,mITT=modified intention to treat,PP=perprotocol)[1]。
三、美国BrainStorm公司自体骨髓来源NurOwn
肌萎缩侧索硬化症(又称运动神经元病、渐冻人症,简称ALS)[图2],截止目前美国FDA只批准了2个治疗药物:第一个药是Rilutek (Riluzole),于1995年12月12日获得批准,能使渐冻症患者生存期延长了三个月。第二个药物是Edaravone(吡唑啉酮自由基清除剂,可降低氧化应激),于2017年5月5日刚刚获美国FDA批准。
2016年3月JAMA Neurol报道了美国BrainStorm公司NurOwn? 治疗ALS的疗效[3]。NurOwn是自体骨髓来源的MSC,在体外采用分化培养基诱导定向分化为能分泌神经营养因子( NTF)的MSC-NTF。Ⅰ期12例ALS患者,给予肌肉内注射(IM)或者蛛网膜内注射(IT)的方法。Ⅱ期14例ALS患者,给予肌肉注射和蛛网膜下腔注射联合的方法。对于早期ALS患者,给予自体MSC-NTF治疗一次,细胞数量是2×106个细胞/kg(IT),和48×106个细胞/kg (IM)。治疗后6个月87%应答,25%病情缓解,ALSFRS疾病进展评分得到改善[图3],FVC疾病进展评分也逐渐改善[图3],提示干细胞治疗能使患者受益,且治疗无明显副作用产生。
图3,NurOwn治疗后ALSFRS评分和FVC评分[3]
2016年7月18日美国BrainStorm公司宣布NurOwn在美国Ⅱ期临床试验结果(美国BrainStorm公司网站http://ir.brainstorm-cell.com/)。在美国3个医院进行随机、双盲、对照、多中心临床试验,48例ALS患者,其中36例接受MSC-NTF(联合IM+IT),12例作为对照[图4]。细胞经肌肉和椎管内注射一次,随访6个月。可见干细胞治疗明显延缓了ALS疾病的进程,患者症状得到缓解,能产生有效应答,且治疗安全、无明显副反应。2016年12月19日美国BrainStorm公司宣布开始Ⅲ期临床试验[4]。
图4,NurOwn治疗ALS应答分析[4]
参考文献
1、Panés J, et al. Expandedallogeneic adipose-derived mesenchymal stem cells (Cx601) for complex perianalfistulas in Crohn's disease: a phase 3 randomised, double-blind controlledtrial.Lancet. 2016 Sep 24;388(10051):1281-90
2、Tigenix公司官网:
http://tigenix.com/wp-content/uploads/2017/06/170613
3、Petrou P, et al. Safetyand Clinical Effects of Mesenchymal Stem Cells Secreting Neurotrophic FactorTransplantation in Patients With Amyotrophic Lateral Sclerosis: Results ofPhase 1/2 and 2a Clinical Trials. JAMA Neurol. 2016 Mar;73(3):337-44
4、BrainStorm公司官网:http://ir.brainstorm-cell.com/
5、Hess DC, et al. Safetyand efficacy of multipotent adult progenitor cells in acute ischaemic stroke(MASTERS): a randomised, double-blind, placebo-controlled, phase 2 trial. TheLancet Neurology, 2017 Mar 17
6、Athersys公司官网:
http://www.athersys.com/releasedetail.cfm?ReleaseID=991195
来源:澎湃健康 作者:王博士
为你推荐
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
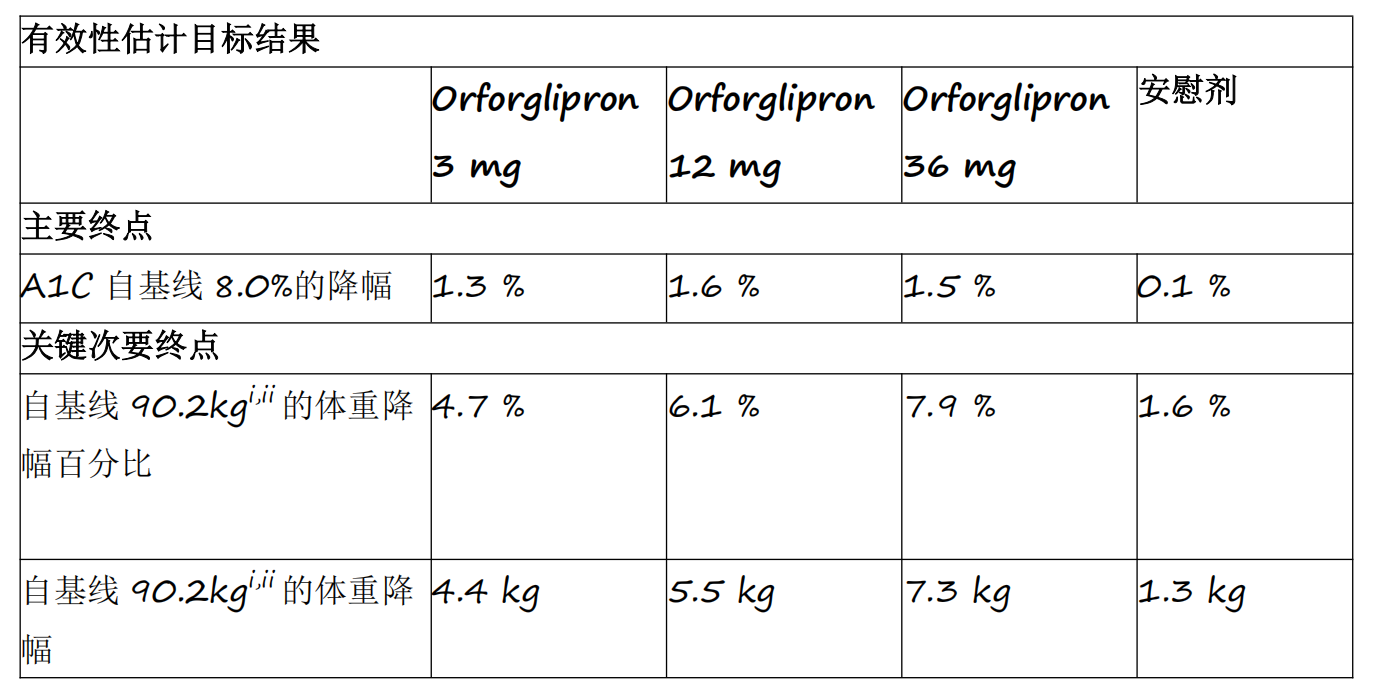
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12
 资讯
资讯 扬帆出海正当时:Cytiva 为中国生物药企绘制全球合规航海图
峰会聚焦法规解读、国际监管环境、中国生物药企业出海案例等关键议题,通过专家分享和深入解读,为中国生物药企提供全球化战略指导和合规支持;
2025-04-15 17:00
 资讯
资讯 全国肿瘤防治宣传周:礼来携手信达生物、和黄医药加速赋能本土医药创新
礼来携手本土合作伙伴信达生物、和黄医药齐聚上海,共话本土医药创新发展,探索加速惠及中国肿瘤患者的新模式
2025-04-15 16:27
 资讯
资讯 ADC明星企业映恩生物港交所上市,开盘高开91.33%
上市首日,其股价开盘高开91 33%,随后涨幅迅速扩大至127 06%,午间收报214 80港元,市值突破178 66亿港元,成为近年来港股18A生物科技公司中最亮眼的IPO案例之一。
2025-04-15 13:19