CAR-T疗法终于迎来首个彩蛋!
Kymriah获批上市
今日(8月31日),FDA官网宣布,批准诺华的CAR-T疗法Kymriah(tisagenlecleucel)上市,用于治疗罹患B细胞前体急性淋巴性白血病(ALL),且病情难治或出现两次及以上复发的25岁以下患者,这是人类历史上批准的首款CAR-T疗法,也是在美国境内FDA批准的首款基因疗法!
此前,Kymriah曾于7月12日获得FDA肿瘤药物专家咨询委员会(ODAC)以10:0的投票结果一致推荐,当时预计是FDA会在10月3日前依据专家意见做出最终审批决定,而最终的获批上市比预计的提前了一个多月的时间。
FDA生物制剂评估中心总监Peter Marks对此表示:“Kymriah是首例以细胞为载体的基因治疗方法,可满足儿童和年轻人对这种严重疾病的重要需求。这类患者存在非常有限的选择,而Kymriah的出现不仅为这些患者提供了一种新的治疗方案,更重要的是在临床试验中可以显示出有希望的缓解率和提高存活率的治疗方案。
ALL是一种病发于淋巴细胞的癌症,在ALL患者中,异常细胞会在骨髓中大量增殖,影响红细胞、白细胞、血小板等其他正常血细胞的生成,因此,ALL患者会出现贫血、瘀青、易出血等症状。同时,该疾病恶化进展程度非常快,是美国最常见的儿童癌症,据美国癌症研究所估计,每年约有3100名年龄在20岁以下的患者被诊断为ALL,ALL可以是T-细胞或B细胞来源,B细胞是最常见的,而Kymriah此次被批准用于患有B细胞ALL的儿科和年轻成人患者,适用于复发难治性ALL患者,这类患者所占比例有15-20%。
CAR-T疗法的治疗流程
Kymriah是一种基因修饰的自体T细胞免疫治疗,每个剂量的Kymriah是使用个体患者自己的T细胞(称为淋巴细胞的一种白细胞)产生的定制化治疗,患者的T细胞被收集并送到制备中心,在那里进行遗传修饰(嵌合抗原受体或CAR的新基因表达),其指导T细胞靶向并杀死具有表面上的特异性抗原(CD19),一旦细胞被修饰,在它们被注入到患者体内时可以杀死癌细胞。
Kymriah的安全性与疗效在一个多中心的临床试验中得到了验证,这个临床试验招募了63名罹患难治性或复发性B细胞前体ALL的儿童和青年,在治疗的3个月内,CAR-T疗法带来的总体缓解率达到了83%。
有哪些副作用
不过,Kymriah治疗也存在潜在的严重副作用,可能会产生例如细胞因子释放综合征(CRS)的风险警告,因为CRS的存在,会引起高热和流感样症状,因为CAR-T细胞的快速增殖,也产生神经系统损伤的重度损伤反应,CRS和神经系统事件都可能危及生命。
此外,Kymriah的其他严重副作用还包括严重感染、低血压(低血压)、急性肾损伤、发热和氧气减少(缺氧),大多数症状出现在输入Kymriah后1至22天。由于CD19抗原也存在于正常的B细胞上,而Kymriah也会破坏产生抗体的正常B细胞,因此存在长时间感染的增加风险。
分两种剂量
Kymriah的用药剂量包括两种:
50kg以下,0.2-5*106 个CAR阳性T细胞/kg体重,静脉注射;
50kg以上,0.1-2.5*108个CAR阳性T细胞/kg体重,静脉注射。
疗程包括首先进行淋巴细胞清除化疗:氟达拉滨(30mg/m2,静脉注射,每天一次,连续4天)联合环磷酰胺(500mg/m2,静脉注射,开始注射氟达拉滨时每天一次,连续2天)。淋巴细胞清除化疗完成后的2-14天内,静脉注射Kymriah。
关于给药
用37℃水浴或者干法解冻Kymriah,直到无可见冰,切勿在37℃保存,Kymriah解冻后可在室温(20-25℃)保存30分钟,因此需在患者治疗准备全部完成后确定解冻时间,给药前准备好托丽珠单抗及必要急救设备,同时,给药前30-60分钟先给患者术前用药对乙酰氨基酚和苯海拉明或者其他H1抗组胺药物。
由于Kymriah是自体T细胞疗法,包装袋是病人专用的,给药前应确认袋子上患者信息,注射前要检查包装袋是否有破损,如有破损,不要给药,可以即刻拨打诺华电话1-844-4KYMRIAH。
如包装袋有泄露,应转移到其他无菌袋中,避免污染,肉眼观察解冻后有无细胞团,小的细胞团在手动轻摇后可消失,如果细胞团不消失,请勿给药。拨打诺华电话1-844-4KYMRIAH。
定价47.5万美元
对于最受关注的Kymriah价格,诺华方面表示称为Kymriah的定价为47.5万美元,接近此前分析师预测价格范围的下限:40-75万美元。诺华称第一个月内将在20个中心提供Kymriah,随后将增加到35个中心,诺华同时提到,正在与美国医疗保险与医疗补助服务中心(CMS)讨论”按疗效付费“的定价方案。
此次Kymriah的获批上市,给同样研究CAR-T疗法的同类公司带来了巨大的鼓励,今年也可称的上是CAR-T疗法的丰收大年,就在前两天,吉利德与Kite Pharma联合宣布,双方董事会已经达成最终收购协议,吉利德将以每股180美元的现金价格收购Kite,溢价29%。该项交易金额约为119亿美元,采用全现金收购,预计整个交易将在2017年第四季度完成。也就在本月,Kite Pharma的首款CAR-T疗法axicabtagene ciloleucel(原名KTE-C19)获FDA”通行证“,这张通行证意味着监管机构将对该产品的上市快速得到支持,KTE-C19会不会成为第二个获批上市的CAR-T疗法,我们拭目以待!
原文检索
《FDA approval brings first gene therapy to the United States》
《FDA approves first 'living drug' that uses gene therapy to fight cancer》
医谷链
《为了CAR-T!吉利德119亿美元全现金收购Kite Pharma》
《诺华疗法获FDA专家10:0一致投票推荐,或将迎来全球首个获批的CAR-T疗法上市》
来源:医谷网
为你推荐
 资讯
资讯 带状疱疹疫苗“遇冷”,百克生物2024年净利润腰斩
近日,国内疫苗龙头企业百克生物发布2024年年报,数据显示,其报告期内实现营收12 29亿元,同比下降32 64%;归属于上市公司股东的净利润2 32亿元,同比下降53 67%。对于营收...
2025-04-23 12:59
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
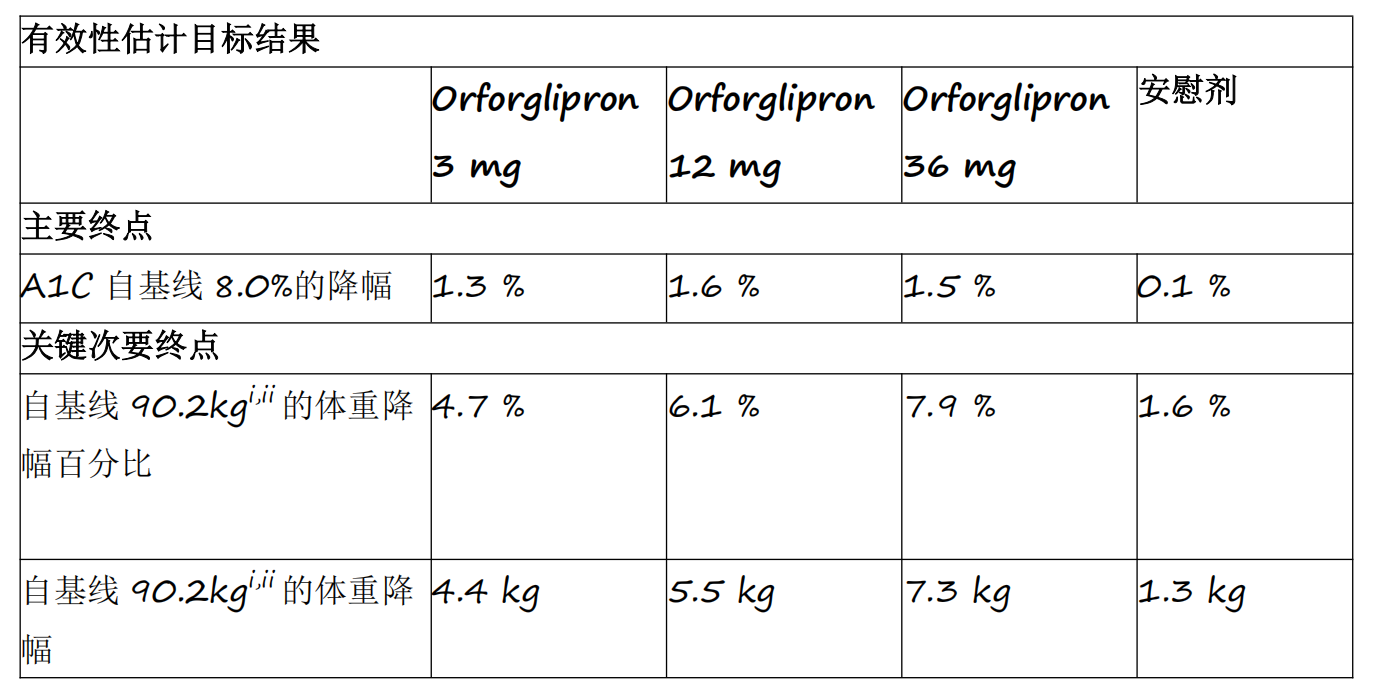
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12












