中国药品监管部门正在启动多项不同于传统临床研究的“真实世界研究”(Real World Study, 简称RWS),并探讨如何将其运用到监管框架中。
健康点近日独家获悉,此举将用于评判上市药品的真实疗效与审评审批阶段是否一致,解决新药使用环节中的若干数据盲区——药物性价比是否值得列入支付压力日益增高的医保清单,以及患者用药过程中的生命质量改善程度。
中国医药创新促进会执行会长宋瑞霖8月25日告诉健康点记者,对真实世界数据的研究是中国未来的方向,国家食药监总局(SFDA)正在进行相关调研,人保部今年7月更新“国家基本医疗保险的药品目录”只是第一步。SFDA召开了多场真实世界研究的研讨会,探讨用什么样的研究方法最科学,既要控制成本,又能提高疗效。
在“第二届中国医药创新与投资大会”媒体见面会上,宋瑞霖坦陈,新药上市后的IV期临床评估、药物经济学评价,“在中国是一个短板”,药企通常只把药物当做一种商品,而今要回归医疗的本质,考量药物对患者新增的获益,以及社会为此付出的成本之间的关系。纵观世界各国,医保作为药品支付方,今后的改革方向,一定是向着以价值为导向的改革转化。
监管框架变革?跨国公司遭“数据拷问”
无独有偶,美国药监局(FDA)近日在联邦公报上宣布,将于2017年9月12日举行公开研讨会讨论真实世界数据(real-world data, 简称RWD)和真实世界证据(real-world evidence, 简称RWE)在其监管决策制定过程中的使用。
自1962年美国国会立法,将药物临床试验作为药品上市申请不可缺少的关键步骤之后,药物临床试验面临的一次根本性变革。2016年底,美国国会通过了奥巴马呼吁的《21世纪治愈法案》。该法案将推动美国未来10年生物医学创新研发、疾病治疗及大健康领域发展。法案批准,利用“真实世界证据”取代传统临床试验进行扩大适应症。
北京大学循证医学中心副主任詹思延解释说,真实世界研究是一种基于临床真实的情况采取的一种非随机、开放性、不使用安慰剂的研究。因此,RWE具有很高的外部有效性。与之相比,随机对照试验(RCT)存在人为设计因素,因而也容易遭受人为操纵。
RWD无论是对美国FDA还是中国药监局(CFDA)都具有吸引力。而RWD的具体落实,就落在医学事务部头上。
在真实世界研究峰会期间,中山大学药学院医药经济研究所宣建伟教授提出,真实世界研究对以下利益群体都有帮助:
对医生来说,可以通过RWD研究提升治疗的规范性,并提高患者的治愈率。比如:规范使用双联抗血小板治疗急性冠状动脉综合征(ACS)患者可以起到降低临床并发症及总体治疗费用的效果。但通过对我国部分医院RWD研究发现急性冠状动脉综合征(ACS)患者规范使用双联抗血小板治疗率出院时不到1/2(44.6%),出院后12个月后更是降至不到1/5(19.4%)。通过RWD分析,发现原因并通过提高治疗方案与规范指南的相符性,可以大幅提高ACS患者的治愈率并降低花费。
对制药及医疗器械企业,通过RWD可以有效影响临床干预手段的运用决策及支付。
美国一个真实案例如下:某创新药的制药公司即将上市治疗某一严重疾病的新特药物,其临床RCT研究表明,该创新药和现有治疗药物疗效相当,使用上更加方便,但价格显着高于现有治疗药物。通过RWD分析证明,患者使用该新特效药的依从性远高于传统特效药,而且该创新药物大幅降低了临床并发症及其治疗费用。
对比多种干预措施的有效性,找到针对特定病人的最佳治疗途径,可以帮助医生确定临床上最有效和最具有成本效益的治疗方法。要做到这一点,药企必须获得的真实世界数据包括:医疗保险的报销记录(包含门诊,住院和药房的报销记录)、去除个人信息的人口记录、患者保险记录和药物价格信息。
“真实世界数据”对医保的意义
现任上海罗氏制药有限公司医学部真实世界数据科学家的赵洪鑫介绍了RWD对支付方(尤其是医保部门)的意义。
对付费者来说,为药品的价格合理性提供支持,为医保部门对于是否将药物列入医疗保险报销目录提供决策依据。药企如果能够提供强有力的证据信息,表明自己的产品具有很好的成本-效果比,同时又能表明该产品被列入医保后对于医保基金的影响是在一个可接受的范围内,甚至是能够节省医保费用,显然将对产品的医保申请提供很好的支持。
辉瑞大中华区副总裁、医学事务部负责人谷成明告诉健康点,药物数据生成,正在迅速从“双盲对照研究、随机对照试验(RCT)”,向“真实世界数据研究(RWS)”转化;数据沟通也从“面对面拜访、专家顾问会”,向“数字化渠道的双向沟通”转变。他同时透露,辉瑞正在同有关科研机构、医疗机构合作,开展药物上市后真实使用环境中的RWD研究。
一位跨国药企在华的肝炎事业部负责人告诉健康点,中国医生时常挑战该公司的临床研究数据,“你怎么证明你的数据适用于中国患者?”在上市前,患者筛选流程是否合理;上市后,临床数据是否确凿——都影响到新药在临床环节的使用。
然而,新增的RWE会对药企研发成本带来影响。北京中医药大学基础医学院主任刘建平认为,开展此类研究的前提,首先需要大项目的支持,其次是需要建立或利用现有的医疗信息资源,比如说医保的数据。要想充分利用医疗信息资源,就必须制定标准化的信息采集、储存和集成系统,加上顶层的设计,才有可能产生有价值的研究成果。
药物经济学家成“香饽饽”
上个月,人保部公布了“国家基本医疗保险的药品目录”,与2016年平均零售价相比,谈判药品的平均降幅达44%,最高达70%,大部分进口药品谈判后的支付标准低于周边国际市场价格。其中包括来自跨国制药公司的重磅药物,例如罗氏的赫赛汀(Herceptin)、强生公司的万珂(Velcade)、新基生物的来那度胺(Revlimid)和阿斯利康的替卡格雷(Brilinta)。
拜耳高级卫生经济学结果研究(Health Economy Outcome Research, HEOR)专家吴静静早在此前两年,就感受到市场的异动——新适应症审批和国家医保目录更新的时间一再推迟,原计划准备的市场准入工作一度陷入停滞。在医学事务部早就熟悉业务的产品治疗领域直接相关的心血管专家之外,开始要面对一批药物经济学家、医保管理专家。
一方面,工业和、城镇化、人口老龄化、疾病谱变化、环境变化等因素导致医疗服务需求不断上涨;另一方面,经济增速放缓、医疗资源短缺、资源配置失衡等因素使得医疗服务的供给受限。
面对新药市场准入,吴静静坦陈,无论是医保部门、商业保险机构还是消费者,支付方越来越希望看到,“只有那些真正解决临床需求,并且‘性价比’好的药物才能在市场准入中得到上述专家推荐,而专家意见在医保目录评审过程中起到主导作用。”
传统意义上,新药市场准入更强调临床试验的数据证实其疗效和安全性。如今,跨国药企的医学事务部,需要证明的是——药物经济学研究的成本效益分析证据,以及产品在真实世界中的实际效果、安全性与合理用药等证据。这对产品证据链提出了更高的要求。
一位跨国公司某创新药事业部的负责人告诉健康点,对于药企的医学事务、政府事务、市场部门而言,药物经济学家越来越成为“香饽饽”,出多高的价,都想招到靠谱的专家。
同时,跨国药企的沟通对象正在多元化。从传统的“1P”临床医师(Physician),转变为“5P”——临床医师、药师(Pharmacist)、商业伙伴(Business Partner)、患者(Patient)、支付方式(Payer)。为了兼顾多渠道的医学沟通,吴静静说,“医学部负责准备专业资料,市场部、市场准入部、关键客户部负责专家沟通”的经典模式已经不管用了,需要在医学部内部协调医学顾问团队、医学沟通顾问团队、药物经济学团队、医学信息团队、科学运作团队、药物境界团队。
“真实世界研究大数据,不是要不要建的问题,而是怎么建的问题。”丽珠医药营销市场部总经理杨翔宇告诉健康点,作为本土药企,四年前就在布局真实世界研究和药物经济学评价,确保临床数据真实可信,实现药物安全性、有效性、经济性的统一。他提醒,药企要通过3~5年时间,储备充足、完整的证据链条,搭建药物经济学模型,为新药上市后的定价,以及由此带来的医保支付方式变革提供依据。
来源:健康点healthpoint 作者:梁嘉琳
为你推荐
 资讯
资讯 2025“数据要素×”•行业样板发布:华山医院•联仁健康“医院数据资产化生态平台”成功入选
近日,由中国信息协会大数据分会主办,信息化观察网承办的2025数据要素融合与应用创新峰会在北京举办,并正式对外发布了2025“数据要素×”·行业样板100例。
2025-03-25 16:06
 资讯
资讯 全国肿瘤诊疗规范化提升行动启动会在京召开,夯实高质量肿瘤诊疗体系
2025年3月24日,由国家癌症中心学术支持,北京中康联公益基金会、辉瑞公司主办的全国肿瘤诊疗规范化提升行动启动会在北京召开,全国肺癌和肾癌规范化诊疗质控讲师培育计划也于...
2025-03-25 09:52
 资讯
资讯 生态赋能,新加坡助力全球企业迈向国际化新高度
本文将通过三家具有代表性的企业案例,解析新加坡如何利用其完善的产业生态体系,为全球医疗科技企业提供全方位支持,助力其全球化布局。
2025-03-25 09:35
 资讯
资讯 “关注睡眠健康 聚焦抗衰未来”2025睡眠与健康学术研讨会在四川成功举办
在第二十五个“世界睡眠日”到来之时,为促进国民健康、呼吁人们重视睡眠问题、树立“防未病”意识。2025年3月21日上午由中国保健协会健康管理专业委员会与四川天府亨特生命科技...
2025-03-24 16:54
 资讯
资讯 响应“体重管理年”行动,众安互联网医院助力国民科学减肥
在全民健康意识不断提升的当下,体重管理已成为社会各界关注的焦点。随着国家卫健委等部门对体重管理的重视,以及“体重管理年”行动的推进,越来越多的专业机构开始积极探索科...
2025-03-24 11:40
 资讯
资讯 万益特首次亮相中国发展高层论坛,以重要脏器疗法共筑中国健康未来
2025年3月23日,万益特全球首席执行官陶克瑞(Chris Toth)出席在北京举办的中国发展高层论坛2025年年会。
2025-03-24 11:10
 资讯
资讯 河南如何思考医保即时结算
河南省在统一实施路径基础上,统一增加按日(T+1)、隔日(T+3)、按周(T+7)的结算新模式,定点医药机构根据自身运行实际选择结算周期,而后通过月度结算、年度清算据实拨付;...
2025-03-22 22:30
 资讯
资讯 《提升中药质量促进中医药产业高质量发展的意见》发布
研究修订《野生药材资源保护管理条例》,完善分级保护制度。加强药用野生动植物物种就地和迁地保护。研究制定中药材种子管理办法。加强中药炮制技术传承创新,依法依规对特殊饮...
2025-03-22 11:41
 资讯
资讯 吉利德拓达维® (Trodelvy®)在中国获批用于治疗转移性激素受体阳性、人类表皮生长因子受体2阴性乳腺癌
拓达维®是全球首个获批的靶向Trop-2的抗体偶联药物(antibody-drug conjugate,ADC),2022年已在中国获批用于治疗既往至少接受过二种系统治疗(其中至少1种治疗针对转移性疾病...
2025-03-21 16:46
 资讯
资讯 蚂蚁集团加码医疗AI,发布医院、医生、用户三大产品体系升级
蚂蚁集团正加码AI医疗产业布局,3月21日,其对外公布了在医疗机构、医生、用户三端最新AI产品体系升级。其中,面向医疗机构,蚂蚁联合华为医疗卫生军团、阿里云等推出“蚂蚁医疗...
2025-03-21 16:03
 资讯
资讯 上海首家外商独资医院获颁证
据青浦商务官微信息,近日,上海德达医院已正式获上海市卫生健康委员会颁发“外商独资”医疗机构执业许可证,同时获得外商独资企业营业执照,成为医疗领域开展扩大开放试点政策...
2025-03-21 11:50
 资讯
资讯 维昇药业今日登陆港交所,募资逾1亿美元,成2025港股创新药第一股
成为2025年第一家在港股上市的创新药企业,同时也成为港股首家专注于生长发育及内分泌领域的上市公司。
2025-03-21 11:16
 资讯
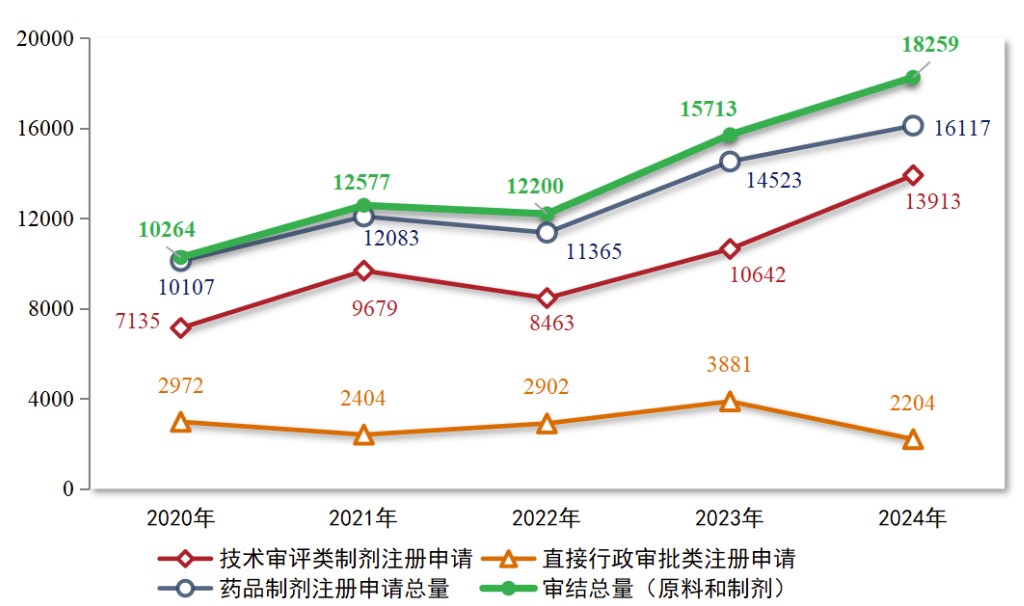
资讯 2024年度药品审评报告(全文)
2024年,药审中心审结各类药品注册申请共18259件(同比增加16 20%),包括药品制剂注册申请16117件(同比增加10 98%),化学原料药注册申请2142件(同比增加80 00%)。
2025-03-20 21:30