8月25日,FDA批准了第2个Humira(阿达木单抗)仿制药上市,来自勃林格殷格翰的Cyltezo(adalimumab-adbm,40 mg/0.8 mL)。批准的适应症包括成人中重度活动性类风湿关节炎、活动性银屑病关节炎、活动性强直性脊柱炎、中重度活动性克罗恩病和溃疡性肠炎、中重度斑块状银屑病,以及4岁以上青少年的多关节型幼年特发性关节炎。
Humira是全球第一个上市的抗TNF-α药物,自2002年首次获得FDA批准上市以来,已经累计创造了近1000亿美元的销售收入,而且直到今天还以每年两位数的增幅刷新单只药品的年度销售记录。Humira在2016年的全球销售额是160.78亿美元,今年上半年的销售额是88.34亿美元,预计2017年可以达到180亿美元。
安进的Amjevita(adalimumab-atto)是FDA批准的第1个Humira仿制药,早在2016/9/23就获得了批准,不过由于AbbVie与安进的专利诉讼仍未解决,安进目前仍未在美国上市销售Amjevita。8月初,勃林格殷格翰也遭到了AbbVie的起诉(见:捍卫Humira,AbbVie指控勃林格殷格翰专利侵权),被指控侵犯Humira的74项专利,因此勃林格殷格翰短期内应该也不会上市销售Cyltezo。
由于受到超过100项专利的保护,Humira并未受到生物类似物的冲击,今年上半年在美国市场的销售额也丝毫未受影响,还增加了20%(58.97亿美元)。AbbVie甚至自信其专利保护期可以持续到2022年。
不过随着仿制药企业的轮番冲击和诉讼数量的显著增加,AbbVie和美国专利商标局的压力都会越来越大。花旗银行分析师Andrew Baum认为:“阿达木单抗类似物上市的时间会比AbbVie预想的要快,Humira的销售额预计在2018年达到峰值,之后开始下滑,2022年会下降至60亿美元左右”。
来源:医药魔方数据(微信号 iyiyaomofang)
为你推荐
 资讯
资讯 国家药监局发布医药代表管理办法(征求意见稿)
医药代表应当具有医学、药学或相关专业本科及以上学历(或者中级及以上专业技术职称);具有药品临床理论知识及实践经验,或者具有药品研发、生产、检验、质量管理等岗位工作经...
2024-11-29 18:50
 资讯
资讯 三高共管,三慢共防:2024中国医药城大健康产业论坛“慢病协同共管”专题圆满举办
大会以“三高共管,三慢共防”为主题,聚焦共病共管、心肾保护、跨界融合、慢病管理创新模式、创新产业技术等前沿内容
2024-11-29 15:03
 资讯
资讯 湖南省视觉功能及儿童眼病学术研讨会暨世界近视眼大会成果宣讲会在长沙举办
11月28日,由爱尔眼科湖南省区视光学组、爱尔眼科湖南省区小儿眼科学组主办、长沙爱尔眼科医院承办的“湖南省视觉功能及儿童眼病学术研讨会暨世界近视眼大会成果宣讲会”,在长...
2024-11-29 09:09
 资讯
资讯 一个手功能康复训练仪器的设计
系统由3个模块组成:指示锻炼情况和治疗持续时间,并为气动螺纹管提供动力的驱动泵;穿戴在健康一侧手臂的镜像手环,及穿戴在患肢的康复机器手套。
2024-11-29 09:02
 资讯
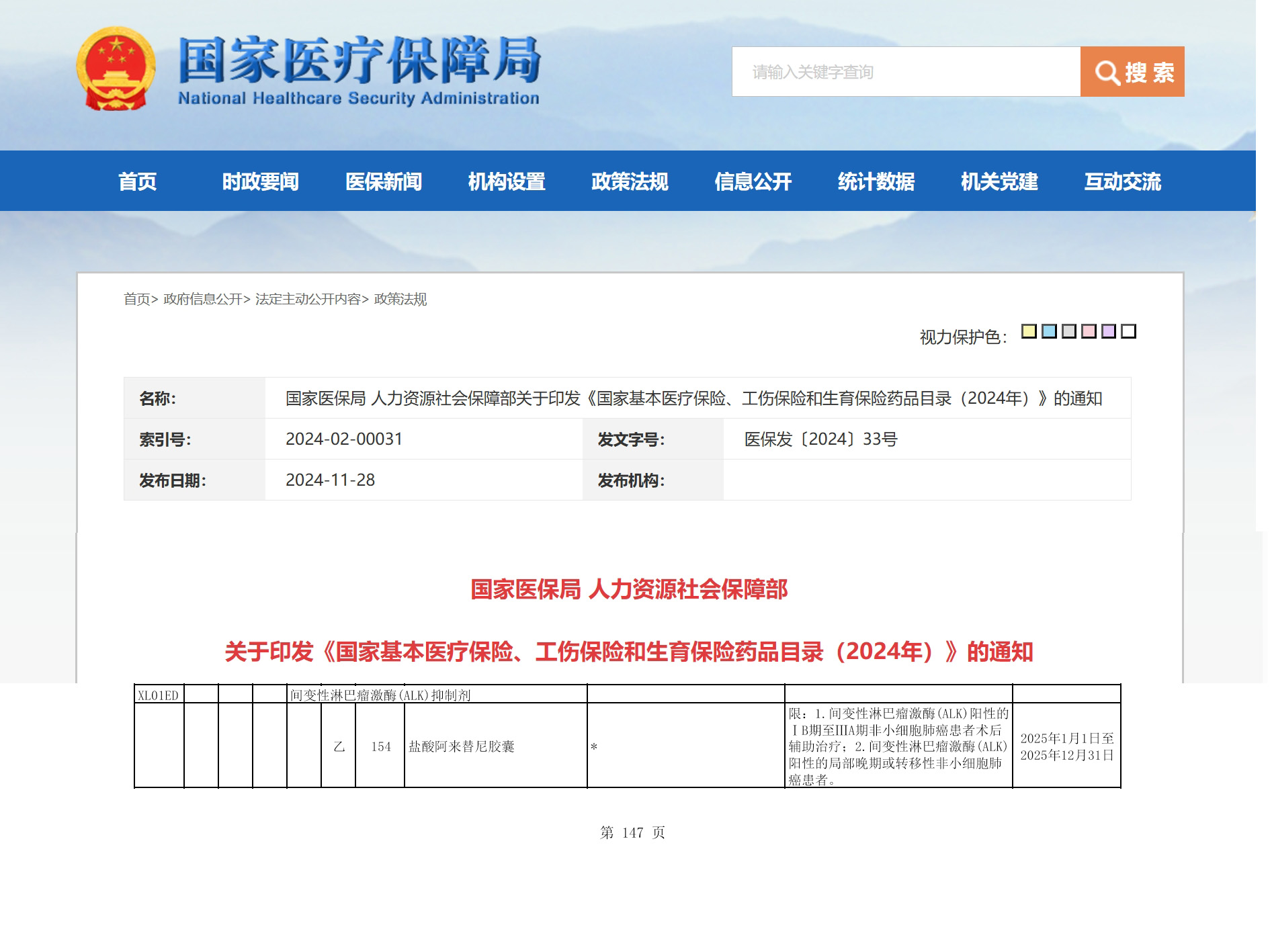
资讯 阿来替尼ALK阳性早期NSCLC术后辅助治疗适应症成功纳入医保
2024年11月28日,国家医保局公布了《国家基本医疗保险、工伤保险和生育保险药品目录(2025年)》(以下简称:国家医保目录),安圣莎®(通用名:阿来替尼)ALK阳性早期非小细胞...
2024-11-28 18:58
 资讯
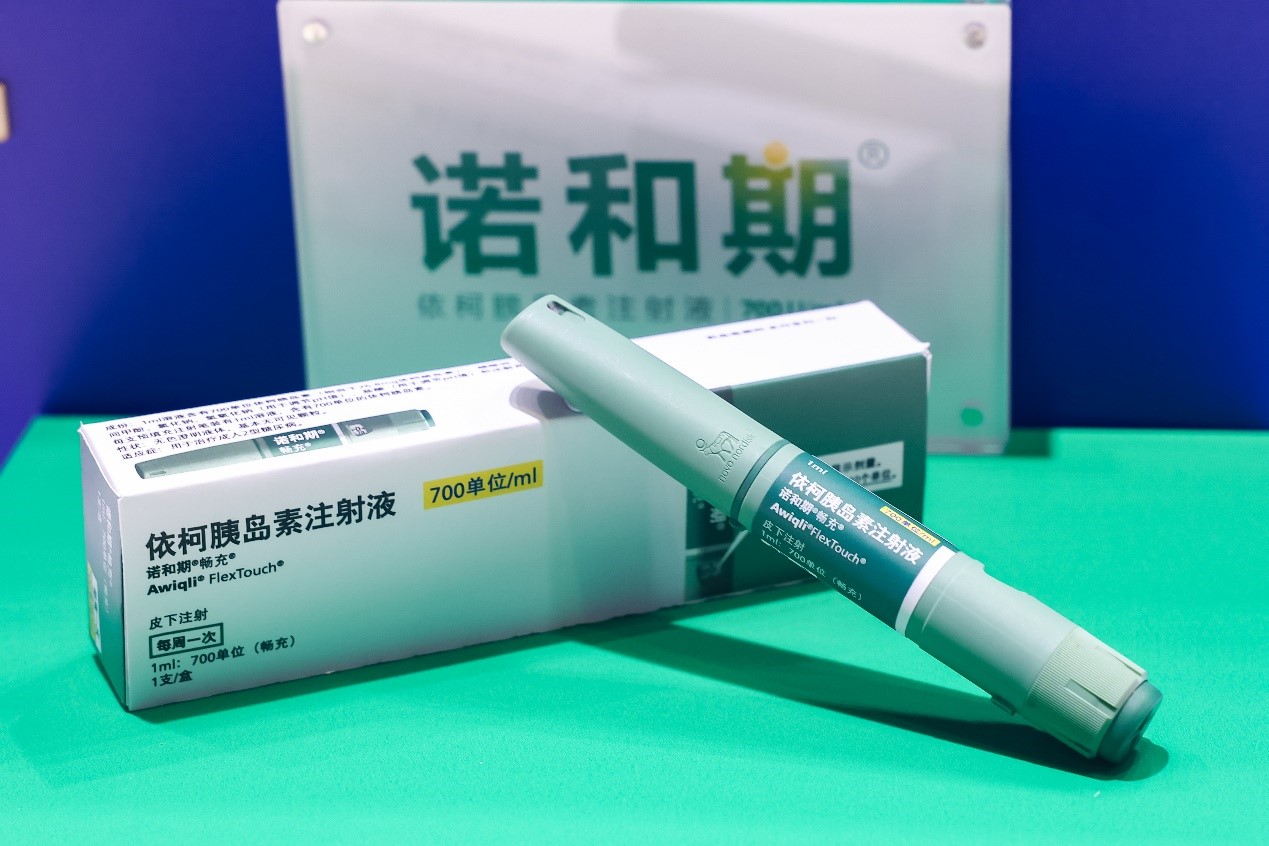
资讯 全球首个胰岛素周制剂诺和期(依柯胰岛素注射液)成功纳入国家医保目录
11月28日,根据国家医疗保障局最新公布,依柯胰岛素注射液(商品名诺和期®)被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2024年)》。目录将于2025年1月1日起正式执行。
2024-11-28 15:52
 资讯
资讯 一款国产PD-1被首次被纳入,多款“全球新”在列,2024国家医保谈判结果发布(附完整版目录下载链接)
今日(11月28日),2024年版国家医保药品目录调整名单正式公布。
2024-11-28 14:49
 资讯
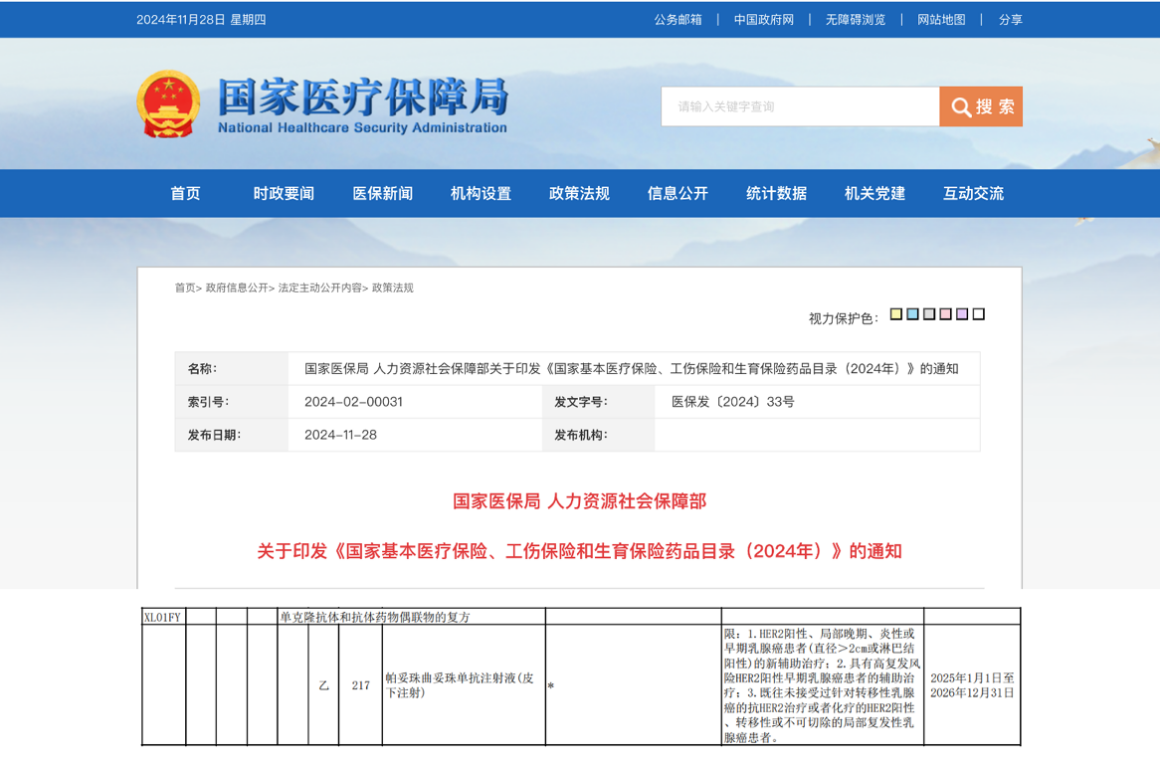
资讯 首个抗HER2复方皮下制剂赫双妥纳入国家医保目录,5-8分钟靶向治疗助力乳腺癌患者拥抱自由新生
2024年11月28日,国家医疗保障局发布最新公告,罗氏抗HER2乳腺癌皮下生物制剂赫双妥®(通用名:帕妥珠曲妥珠单抗注射液(皮下注射))正式进入《国家基本医疗保险、工伤保险和...
2024-11-28 13:53
 资讯
资讯 罕见病创新药盐酸伊普可泮胶囊纳入2024年国家医保药品目录
作为全球首个且唯一获批的特异性补体旁路B因子抑制剂和成人阵发性睡眠性血红蛋白尿症(PNH)口服单药疗法,纳入医保会大大提升患者用药可及性及便利性,为PNH患者带来新的治疗选择。
2024-11-28 13:09
 资讯
资讯 强生2款创新药物纳入新版国家医保目录,惠及更多中国患者
今日(11月28日),在国家医疗保障局公布的《国家基本医疗保险、工伤保险和生育保险药品目录(2024版)》(以下简称:国家医保目录)中,强生的2款创新药物收获了好消息,包括兆...
2024-11-28 12:25
 资讯
资讯 深化创新产品布局 远大生命科学集团获得幽门螺杆菌创新治疗药物独家商业化权益
根据协议条款,远大生命科学将独家负责TNP-2198在中国大陆、香港、澳门的市场推广和商业化销售。丹诺医药将继续负责TNP-2198针对幽门螺杆菌的后续全部临床、非临床和药学研究、...
2024-11-28 09:28
 资讯
资讯 2024青年防艾公益行动在京启动,防艾主题艺术作品在全国11座城市亮相
在第37个“世界艾滋病日”到来之际,由中国性病艾滋病防治协会与中国青年报社共同主办、吉利德科学公益支持的“2024青年防艾公益行动”正式启动。
2024-11-27 18:51
 资讯
资讯 推动智能实验室进化,安捷伦在Analytica China 2024展示技术与服务创新
近日,第12届慕尼黑上海分析生化展隆重举行,安捷伦科技公司如期亮相。本届展会,安捷伦以“创新不止,深谙所需”为主题,重点展示一系列创新的技术与服务,借以诠释公司对科学...
文/史士云 2024-11-27 17:21









