美国食品和药物管理局(FDA)近日授予了6个药物孤儿药地位(ODD),分别为:(1)MimiVax公司免疫治疗性疫苗SurVaxM(DRU-2017-5947)治疗胶质母细胞瘤(脑部肿瘤的一种类型);(2)InDex公司实验性抗炎药cobitolimod治疗溃疡性结肠炎儿科患者;(3)Ocugen公司OCU300(brimonidine tartrate,酒石酸溴莫尼定)治疗眼部移植物抗宿主病;(4)Omero公司MASP2靶向性单抗药物OMS721治疗IgA肾病;(5)Polaryx公司口服小分子药物PLX-200治疗罕见儿科疾病——晚期婴儿型神经元蜡样脂褐质沉积症(LINCL);(6)Kadmon公司口服酪氨酸激酶抑制剂(TKI)tesevatinib治疗携带表皮生长因子受体(EGFR)激活突变非小细胞肺癌(NSCLC)。
在美国,罕见病是指患病人群少于20万的疾病类型。获得孤儿药地位,意味着制药公司在药物研发和商业化方面将获得各种激励措施,如临床试验费用相关的税收抵免、FDA用户费减免、临床试验设计中FDA的协助,以及药物获批上市后为期7年的市场独占期。
(1)SurVaxM:免疫治疗性疫苗,靶向癌细胞存活蛋白survivin
SurVaxM由MimiVax开发,这是一种精心设计的免疫治疗性疫苗,具有潜在的广泛抗癌作用,能以多种不同的方式刺激免疫系统识别并杀死表达survivin的癌细胞,帮助控制肿瘤生长和复发。survivin是一种存在于多种不同类型癌症中的细胞存活蛋白,帮助癌细胞抵抗常规的治疗药物。目前,MimiVax公司正在开展一项II期临床研究,评估SurVaxM联合标准护理药物治疗新诊胶质母细胞瘤患者的疗效和安全性。截止目前,该项研究所取得的中期数据非常鼓舞人心。
胶质母细胞瘤细胞是成年群体中最常见的脑部肿瘤类型,据估计,在美国每年大约确诊1.4万例患者。MimiVax是一家临床阶段的生物技术公司,专注于开发和商业化免疫治疗性疫苗和靶向疗法,用于癌症的治疗。SurVaxM是MimiVax公司的先导药物,除了胶质母细胞瘤之外,该公司也正在开展一项I期临床,调查SurVaxM治疗多发性骨髓瘤(MM)的潜力。
(2)cobitolimod:首创TLR9激动剂,局部抗炎,安全性非常高
Cobitolimod(Kappaproct,DIMS0150)由InDex公司开发,这是一种首创的(first-in-class)新型Toll样受体9(TLR9)激动剂,可在大肠提供一种局部的抗炎作用,诱导黏膜愈合和缓解溃疡性结肠炎(UC)临床症状,帮助中度至重度UC患者恢复正常的生活。cobitolimod具有非常有限的系统吸收(即全身吸收),这种特性赋予了该药与许多已上市药物相比具有非常鲜明的良好安全性。目前,cobitolimod已完成治疗中重度UC的临床概念验证,来自4项安慰剂对照的临床研究数据表明,无论从监管和临床角度来看,cobitolimod对中重度UC最相关的多个终点均表现出统计学上的显著改善,这些终点包括关键的临床症状,如便血、大便次数、黏膜愈合,同时表现出非常好的安全性。
InDex是一家瑞典制药公司,专注于免疫性疾病治疗领域,cobitolimod是该公司最重要的资产,目前已进入后期临床开发。除了cobitolimod之外,InDex也开发出了受专利保护的药物开发平台——基于DNA的免疫调节序列(DIMS),有可能被用于各种免疫性疾病的治疗。
(3)OCU300:高度选择性α2-AR激动剂,治疗oGVHD使90%患者受益
OCU300(brimonidine tartrate,酒石酸溴莫尼定)是一种高度选择性α2-肾上腺素能受体(α2-AR)激动剂,于1996年上市用于治疗开放性青光眼,具有非常良好的安全记录。
目前,Ocugen公司正通过FDA的505(b)(2)途径开发OCU300用于眼部移植物抗宿主病(oGVHD)的治疗,该公司将在不久之后启动III期临床项目,评估OCU300联合一种纳米乳液(nanoemulsion)的治疗潜力。此前开展的一项探索性观察性研究的事后分析显示,oGVHD患者接受OCU300治疗后,大约90%的患者获得了较好的疗效,且无明显的副作用。
oGVHD是一种常见的并发症,发生于40%-60%接受同种异体造血干细胞移植(Allo-SCT)或骨髓移植的患者。受自身免疫性炎症驱动,oGVHD可引起严重的眼表疾病,随时间推移显著降低患者生活质量,同时因视觉障碍限制日常活动。目前尚无获批的药物。
Ocugen是一家临床阶段的生物制药公司,致力于开发创新性的药物,用于眼部疾病的治疗,包括oGVHD、视网膜色素变性、视网膜地图样萎缩、湿性年龄相关性黄斑变性(wet-AMD)和糖尿病视网膜病变。除了OCU300之外,该公司还有2个药物处于临床开发,包括:(1)OCU100,这是一种重组N-末端片段的晶状体上皮细胞衍生的生长因子(LEDGF);(2)ICU200,这是一种抗血管生成肿瘤抑素融合蛋白,开发用于wet-AMD的治疗。所有这3种产品都拥有强大的国际专利。
(4)OMS721:靶向MASP-2单抗,治疗IgA肾病使尿蛋白水平实现前所未有的降低
OMS721由Omeros公司开发,这是一种全人源化单克隆抗体,靶向甘露聚糖结合凝集素相关丝氨酸蛋白酶2(MASP-2),后者是一种新颖的促炎蛋白,是补体系统的主要激活途径——凝集素途径的效应酶。补体系统在炎症反应中发挥作用,可由组织损伤或微生物感染而激活。重要的是,抑制MASP-2似乎并不妨碍抗体依赖性经典补体激活途径,后者是针对感染的获得性免疫反应的关键组成部分。
在全球范围内,IgA肾病是最常见的原发性肾小球疾病,仅在美国大约有12-18万例,约占到了全部透析患者比例的10%。大约40%的患者在确诊后的20年内会发展为终末期肾病,这是一种危及生命的疾病。
来自II期临床研究的数据显示,IgA肾病患者接受OMS721治疗期间和治疗后,尿蛋白水平表现出前所未有的降低。在IgA肾病中,升高的尿蛋白与预后不良相关。基于这些数据,今年6月FDA还授予了OMS721治疗IgA肾病的突破性药物资格。Omeros公司计划在今年晚些时候启动III期临床的患者招募工作。之前,FDA还授予了OMS721治疗非典型溶血尿毒综合征(aHUS)的快速通道地位,这也是该药的第2个III期临床项目。此外,Omeros公司还将启动OMS721第3个临床项目,治疗干细胞移植相关血栓性微血管病(TMA)。
此前,FDA还授予了OMS721治疗补体介导的TMA的孤儿药地位以及治疗aHUS的快速通道地位。
(5)PLX-200:口服小分子药物,可调节溶酶体功能
PLX-200是一种被重新开发改变用途(re-purposed)的口服小分子药物,具有良好的安全性,目前Polaryx公司正开发该药作为一种患者友好的药物,用于LINCL及其他NLC疾病的长期治疗。
LINCL是一种常染色体隐性遗传的神经退行性疾病,患者寿命从六岁至十几岁。目前,尚无患者友好的治疗方案可供选择。LINCL由Cln2基因发生突变引起,导致三肽肽酶1(TPP1)功能不足和或丧失,而这会造成蜡样脂褐质在神经元和其他细胞中的积累。患者症状表现从癫痫开始,之后是智能和语言发育倒退、肌阵挛性共济失调、锥体束征,视觉障碍通常在4-6岁出现并迅速发展为只有明/暗意识。
PLX-200能结合视黄醇X-受体α(RXRα),后者结合PPARα形成PPARα/RXRα异源二聚体从而上调脑细胞中TPP1 mRNA的表达。PLX-200也激活PPARα,增强脑细胞中转录因子EB(TFEB)的水平。TFEB结合参与溶酶体生物合成的相关基因的启动子部位,激活相关基因的转录及蛋白表达。由于TFEB对溶酶体基因表达的影响,因此能够调节溶酶体功能。
(6)tesevatinib:新型口服TKI,能够穿越血脑屏障杀死脑转移癌细胞
Tesevatinib由Kadmon公司开发,这是一种口服酪氨酸激酶抑制剂(TKI)。此次治疗携带表皮生长因子受体(EGFR)激活突变非小细胞肺癌(NSCLC)也是该药在FDA方面获得的第二个孤儿药地位,之前,该药于2016年被授予治疗常染色体隐性遗传性多囊性肾病(ARPKD)的孤儿药地位。
目前,Kadmon公司正在开展II期临床研究,调查tesevatinib治疗已发生脑和/或软脑膜转移的EGFR突变阳性NSCLC以及胶质母细胞瘤的疗效和安全性。该公司也计划在今年第三季度启动tesevatinib治疗ARPKD和常染色体显性遗传性多囊性肾病(ADPKD)的临床研究。
tesevatinib是一种能够穿越血脑屏障进入中枢神经系统的口服TKI,而现有EGFR抑制剂并不能很好地穿越血脑屏障,导致对发生脑转移的癌细胞疗效有限。去年底在国际肺癌研究学会(IASLC)第17届世界肺癌大会上公布的II期临床数据显示,tesevatinib能够迅速缓解临床症状并缩小颅内肿瘤体积,接受tesevatinib治疗的13例患者中,有11例中枢神经系统肿瘤未进一步恶化,其中8例在接受治疗14天内临床症状得到缓解,对其中4例患者开展的后续MRI检测显示颅内病灶得到改善。
来源:新浪医药新闻 作者:newborn
为你推荐
 资讯
资讯 带状疱疹疫苗“遇冷”,百克生物2024年净利润腰斩
近日,国内疫苗龙头企业百克生物发布2024年年报,数据显示,其报告期内实现营收12 29亿元,同比下降32 64%;归属于上市公司股东的净利润2 32亿元,同比下降53 67%。对于营收...
2025-04-23 12:59
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
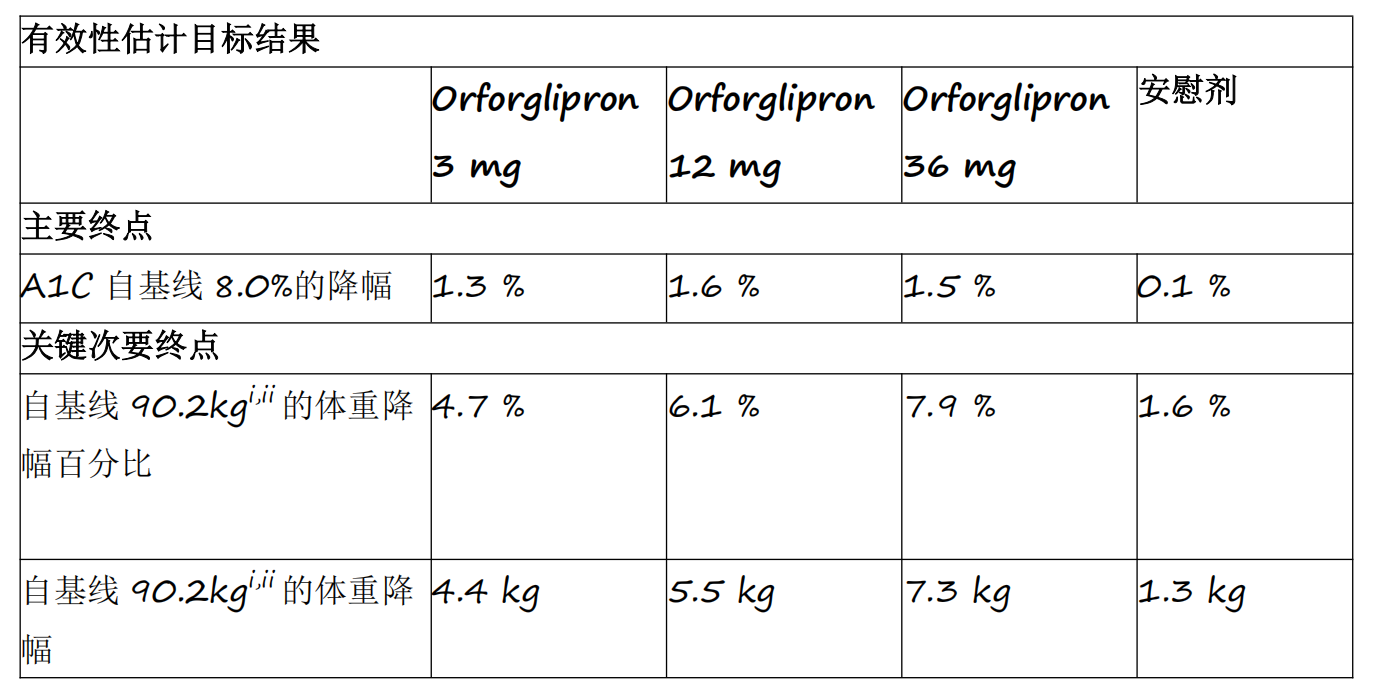
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12









