近日,FDA批准Puma公司Nerlynx (neratinib)上市,用于早期HER2+乳腺癌患者的扩展辅助治疗(术后使用Herceptin之后的维持治疗),以降低乳腺癌复发风险。Nerlynx是FDA批准的首个扩展辅助疗法。
乳腺癌是美国范围最常见的癌症形式之一。根据美国国家癌症研究所(NCI)估计,2017年将约有252710名妇女被诊断患有乳腺癌,其中40610名女性将死于该疾病。同时依据NCI数据,乳腺癌患者中HER2+患者的比例大约为15%。
据悉,Nerlynx是一种激酶抑制剂,主要通过阻断促进细胞生长的几种蛋白酶而起作用。在2840例早期HER2阳性、在近两年内完成了trastuzumab治疗的乳腺癌患者随机试验中,研究人员评估了Nerlynx的安全性和有效性。该研究还测量了试验开始之后癌症复发或死亡发生的时间。经过两年疗程后,经Nerlynx治疗的患者中94.2%没有发生癌症复发或死亡,而接受安慰剂的患者为91.9%。
neratinib组最常见的不良反应包括腹泻、恶心、腹痛、疲劳、呕吐、皮疹、肿胀和口疮、食欲减退、肌肉痉挛、消化不良、肝功能损伤(AST或ALT水平升高)、皮肤干燥、体重减轻、泌尿系统感染等,同时,孕期或哺乳的女性不应服用Nerlynx,因为它可能会对发育中的胎儿或新生婴儿造成伤害。
患者在首次接受neratinib治疗前,需要在用药前56天患者使用loperamide预防严重腹泻,患者如果发生4级以上腹泻或最低剂量下发生2级腹泻将需要停止使用Neratinib。这个批准没有ER阳性限制,也没有黑框警告,是对Puma公司最有利的标签,专家预测Neratinib到2022年销售可达12.5亿美元。
原文检索
《FDA approves new treatment to reduce the risk of breast cancer returning》
来源:医谷网
为你推荐
 资讯
资讯 3.15曝光,稳健医疗收深交所紧急关注函
针对3 15晚会曝出的“翻新”问题,深圳交易所3月16日紧急发布关注函,要求稳健医疗自查并说明公司是否知悉、参与报道所述违规业务,和涉事违规公司是否存在交易往来或者应予说...
2025-03-16 15:20
 资讯
资讯 北京:今年9月起免费为初一女生接种HPV疫苗
今年9月开始,北京将为有意愿的新入学初一在校女生免费接种HPV疫苗,并在10月底前完成第一剂接种,于2026年5月底前,完成接种对象第二剂接种。
2025-03-15 17:10
 资讯
资讯 与国内公司达成新合作,开拓药业开始大力押注化妆品生意了?
近日,开拓药业发布公告称,其全资附属公司苏州开拓与杭州涂麦科技订立品牌与销售运营合作协议,两家公司将就开拓药业的化妆品,包括但不限于防脱、祛痘、美白等产品领域,开展...
2025-03-14 17:07
 资讯
资讯 38年研发突破,罗氏获批中国首个PIK3CA突变的靶向创新药伊赫莱,为乳腺癌患者带来新选择
2025年3月11日,中国国家药品监督管理局(NMPA)正式宣布批准了伊赫莱®(通用名:伊那利塞片)联合哌柏西利和氟维司群,适用于内分泌治疗耐药(包括在辅助内分泌治疗期间或之后...
2025-03-14 14:52
 资讯
资讯 BMS 2.86亿美元收购了一家CAR-T疗法公司
近日,百时美施贵宝(BMS)宣布将以每股5 00美元的全现金交易方式收购2seventy bio(TSVT US),总股本价值约为2 86亿美元,交易预计将在2025年第二季度完成。
2025-03-13 16:28
 资讯
资讯 启明医疗正式复牌:以长期主义开启高质量发展新阶段
此次复牌标志着启明医疗彻底解决了公司治理问题,并重新建立了内部控制体系,是公司回应市场关切、重塑行业信心的关键一步。
2025-03-13 09:13
 资讯
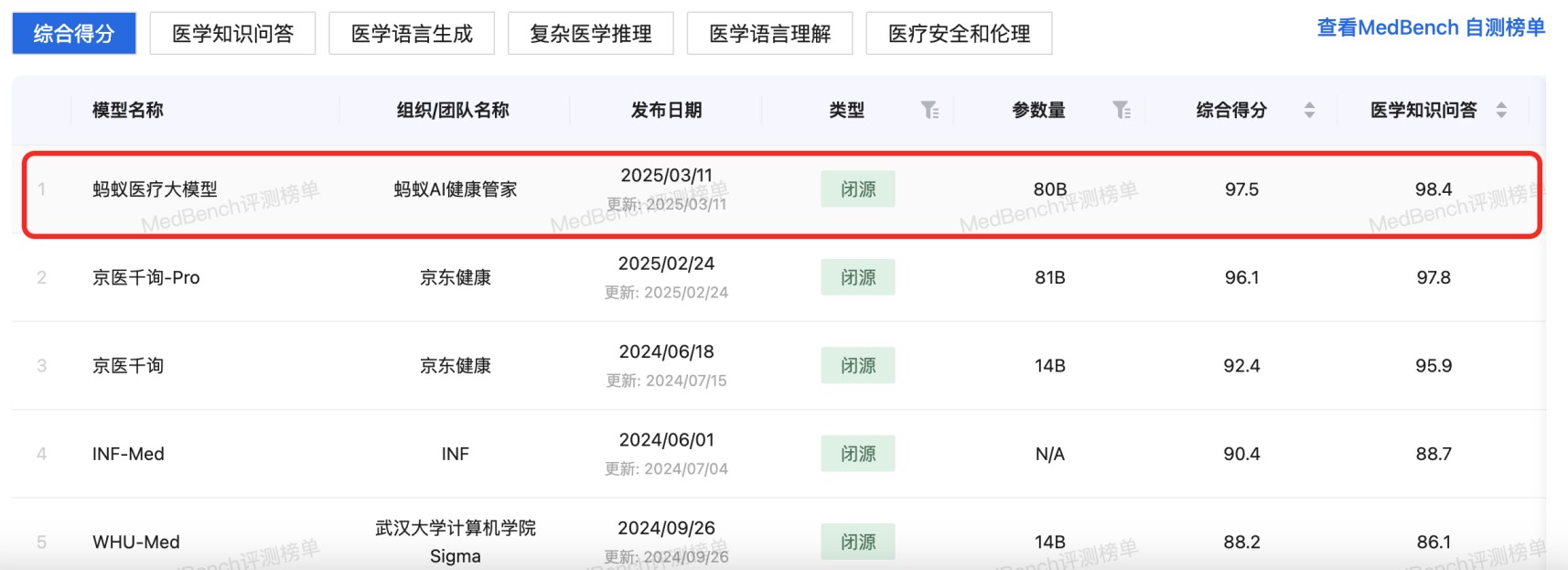
资讯 原生多模态+千亿级数据训练,蚂蚁医疗大模型拿下MedBench测评“双料”冠军
近日,记者发现,国内权威医疗大模型评测平台MedBench在官网更新了榜单。多个医疗AI产品及研究团队入榜,其中蚂蚁AI健康管家团队研发的蚂蚁医疗大模型以评测榜单97 5、自测榜单...
2025-03-12 15:47
 资讯
资讯 业绩增速持续承压,爱美客超13亿元收购了一家韩国医美公司
近日,爱美客发布公告称,基于公司战略规划和经营发展需要,其全资子公司 Imeik(HK)Limited(简称“爱美客香港”)与 Aisheng Shourui (HK) Limited(简称“首瑞香港”...
2025-03-12 10:47
 资讯
资讯 重见光明,聂爷爷的笑容回来了——重庆爱尔助孤寡白内障患者重燃生活希望
对于陈茂盛院长和重庆爱尔眼科医院(总院)的医护人员来说,聂爷爷的重见光明正是他们不断追求的动力。
2025-03-12 09:41
 资讯
资讯 无双医疗完成C轮近1.5亿元融资,加速心脏节律管理创新产品研发和商业化
本轮融资由天士力资本领投,现有股东启明创投、苏高新金控、康裕资本继续加持,为无双医疗在心脏节律管理(CRM)领域的创新产品研发和商业化进程注入了强劲动力。
2025-03-12 09:38
 资讯
资讯 卫美健康完成A轮亿级融资,加速县域基层医疗大模型应用落地
本轮融资资金将主要用于卫美健康“奇点医问”医疗大模型的研发投入与迭代进化,加强医疗细分领域的算法研究,构建升级全国服务网络体系,进一步扩大卫美健康在县域以及基层AI医...
2025-03-12 09:19
 资讯
资讯 突发,上市公司双成药业宣布终止跨界重组
昨日晚间(3月10日),双成药业发布公告称,公司原拟以发行股份及支付现金的方式向奥拉投资、Win Aiming等25名交易对方购买其持有的宁波奥拉半导体股份有限公司100%股份,并拟...
2025-03-11 13:44
 资讯
资讯 百时美施贵宝公布颂狄多®(氘可来昔替尼)POETYK PsA-2 III期试验最新数据 证实其在治疗成人银屑病关节炎中优于安慰剂
治疗第 16 周时,颂狄多治疗组患者的 ACR和 PASI应答率显著高于安慰剂组,且患者报告生活质量有更明显改善。与安慰剂和阿普米司特相比,颂狄多耐受性良好,安全性特征与既往...
2025-03-11 09:38