目前减肥药物研发中需要关注的问题
1.对于体重的降低(>10kg)和持续控制仍是减肥药物开发的首要目标
通过减少能量摄入和增加身体活动为重点的生活方式改变,实现临床上显著的体重减轻(>5%),可以改善CVD的危险因素,延缓或预防2型糖尿病的进展,并促进更好的生活质量。但实际操作中肥胖者通过生活方式改变达到正常体重或维持体重减轻的可能性较低。
锻炼和营养调节虽然可以在短期内有效,但是很多患者长期维持体重减轻少于5%。使用目前上市的抗肥胖药物,可以获得2-9kg的平均体重减轻。但大多数肥胖者对于体重减轻不足10kg不满意,同时为避免伴随而来潜在的终身服药成本和副作用,因此可能会选择停药。此外体重维持是患者停药的主要问题,因为有些人可能比服药前更严重。
体重减轻是大多数临床试验的主要结果,但减肥药物应通过各种终点进行评估,如心脏代谢风险标志物,发病率和死亡率以及生活质量。预防进一步体重增加也可能是一些患者的合适目标。
2.安全性问题是减肥药物开发伴随而来的关注点
由于严重的安全问题,数种上市应用的减肥药物被迫撤市,这也越来越引起了监管机构的关注。鉴于此,监管机构要求所有减肥药物提供预先指定的心血管安全数据。对于作用于CNS的药物,应该监测抑郁和焦虑,例如调节单胺系统的药物(Tesofensine和安非他酮/唑尼沙胺)重点要关注脱靶带来的不良心血管和精神病学反应,并且需要长期随访。一些作用于外周的药物在多种组织中的作用机制了解的很少。因此可能出现意想不到的副作用,例如用Beloranib治疗的患者发生血栓栓塞事件。对于肽激素类似物,免疫原性的风险是另一个重要的安全问题,可能会导致开发的失败,例如由于产生抗体而导致米曲肽/普兰林肽的开发暂停。
3.对于并发症的有益作用越来越受到重视
除了可接受的安全性资料外,肥胖药物应符合有效性的某些最低标准。这不仅适用于体重减轻,还适用于对糖尿病,CVD和NASH等肥胖症的合并症的有益作用。重要的是,治疗必须长期有效,以维持体重减轻,并且有效性可能受到受体脱敏和迟发性的限制。
另外值得注意的是,目前可用药物维持的体重减轻尚未显示可降低心血管发病率或死亡率,尽管最近的结果表明利拉鲁肽可能具有心脏保护作用。时间将告诉新的减肥药物是否会对这些重要变量产生有益的影响,并应努力确定哪些亚组的肥胖者将受益于大部分的治疗。
目前减肥药物开发思路
模仿能量体内平衡的自然参与的激素是通过药理学手段达到与减肥手术对肥胖的同样作用,这是一个令人兴奋的研究思路。胃旁路手术改变膳食诱导的食欲调控激素的释放,包括GLP-1,PYY,CCK,生长素释放肽,OXM,胰高血糖素,FGF21和胆汁酸。这就产生了一个假设,即减肥手术的效果是由几种协同激素变化共同作用来减少对食物摄取。鉴于此,针对于不止一种厌食途径,并且最佳地消耗能量,可以实现大幅度减肥。因此,稳态反应调节可能不仅仅由单一化合物来影响调节食物摄取机制而引起的体重减轻。例如GLP-1 /胰高血糖素双重激动剂的发展潜力巨大,并且增加GIP的作用似乎更有效。进一步与PYY组合也可能减肥,以避免体重减轻后的能量消耗减少可能成为实现减肥手术对肥胖及其并发症显著效果的关键。这种外源激素的皮下给药是最直接的。然而,内源性肠激素释放的药理学刺激可能更有效,因为除了内分泌的全身效应之外,食欲控制也可能通过局部刺激肠,门静脉和肝脏中的迷走神经传入来介导。
尽管在这个领域进行了广泛的研究,但是我们并不完全了解控制能量稳态的生理机制。阐明涉及控制食欲和能量消耗的中枢和外周途径以及体重增加的机制将有助于发现和开发更集中和有效的肥胖治疗药物。
目前减肥药物的研究目标
目前正在开发中的减肥药物
用于治疗肥胖症的几种药物目前正处于临床II或III期阶段。中枢性药物通过CNS直接作用,因此需要渗透血脑屏障。其他化合物通过外周组织发挥其作用,尽管有些也可能间接地将厌食症信号传递给CNS(例如通过迷走神经传入)。最后,一些药物依赖于这两种机制。以前已经批准或研究了大量的治疗用于其他适应症,而不是肥胖症,例如2型糖尿病。
1.中枢作用
①MCR4激动剂
MCR4一直是一些药物的靶点。第一代由于脱靶产生的不良反应,特别是增加血压和剂量依赖性阴茎勃起而在第II/III期临床试验宣告失败。有些则是由于缺乏疗效而停药。相比之下,可注射的MCR4激动剂Setmelanotide从临床前灵长类动物试验扩展到肥胖者(美国)的I/II期试验中显示出有希望的结果,表现出增加静息能量消耗和12周后2.5%至4.8%显著的体重减轻,无任何不良的心血管效应。Setmelanotide也被FDA指定为孤儿药物,用于治疗Prader-Willi综合征和MCR4基因突变患者的肥胖。
②NPY受体拮抗剂
靶向下丘脑中的NPY途径显示出不太有希望的结果。在非常低热量饮食后,II期临床试验显示未能减轻体重增加,之后NPY5受体拮抗剂MK-0557被终止。Velneperit在2013年被停止使用,尽管初步报告说,在治疗1年后,与脂质变化有关得腰围减少至少5%,但II期试验数据显示与奥利司他的药物组合没有临床显著的体重减轻。另外口服的NPY5拮抗剂S-237648目前在日本处于II期临床阶段,预计在2016年完成(JapicCTI-153001)。
③单胺神经递质调节剂
单胺神经递质的调节,包括多巴胺,5-羟色胺和去甲肾上腺素,可以通过增强POMC神经元活性和干扰中脑回流途径来有效抑制食欲。然而,当干扰单胺体系时,主要应关注心血管事件不良和精神病发病风险(例如自杀风险,成瘾)的风险。在II期临床试验(丹麦)中,最初用于阿尔茨海默氏症和帕金森氏症的去甲肾上腺素/ 5-羟色胺/多巴胺再摄取抑制剂特索芬辛(Tesofensine)降低了食欲,并产生了剂量依赖性的体重下降,0.25,0.5和1mg分别下降了6.5%,11.2%和12.6%,而安慰剂组为2%。特索芬辛改善了葡萄糖和脂质代谢,并减小了腰围,在延伸的研究中,体重下降持续了1.5年。在161名参与者中,90%的患者在0.5mg剂量下达到了至少5%的体重下降,但是观察到显著的心率升高。一些患者报告了副作用,如口干,失眠和轻度至中度的胃肠道疾病,但是药物的耐受性普遍较好,尽管不利影响可能被报告不足。根据这些调查结果,特索芬辛可能有两倍于目前上市药物的体重下降作用。丹麦的II期临床试验已经完成,2016年计划在墨西哥和阿根廷进行III期临床试验。
去甲肾上腺素再摄取抑制剂安非他酮与抗惊厥GABA受体激动剂唑尼沙胺组合得治疗潜力是通过安非他酮/唑尼沙胺SR来实现的。安非他酮/唑尼沙胺SR已经在美国完成了约1500名受试者参与的II期临床试验。24周后体重减轻7.5-9.2%,安慰剂组为0.4-1.4%,48周后,体重减轻12-15%,优于现行批准的抗肥胖药物。该药改善了心脏代谢风险标志物,如腰围,甘油三酯,胰岛素敏感性和血压,并且与严重的不良反应无关。最常见的副作用是头痛,恶心和失眠。
2.外周作用
①影响营养物质转运的药物
a.胰腺脂肪酶抑制剂
胰腺脂肪酶抑制剂西替利司他(Cetilistat)与奥利司他具有相似的作用机制,已经在欧洲和美国进行了广泛的II期临床试验,并已在日本完成了II期计划,并等待开展执行。52周后,西替利司他治疗优于安慰剂,降低体重,HbA1c和LDL胆固醇。然而,体重减轻仅为2.8%,而安慰剂组为1.1%。多中心研究报道了西替利司他和奥利司他对于二甲双胍治疗的2型糖尿病肥胖患者具有类似的体重降低作用,但由于胃肠道副作用,西替利司他导致较少的停药。
b.碳水化合物水解抑制剂
虽然脂肪酶抑制剂通过促进脂肪吸收不良而减轻体重,但咀嚼型碳水化合物水解抑制剂PAZ-320通过阻止复合碳水化合被的酶分解成单糖,从而降低葡萄糖,果糖和其它单糖用于肠吸收的可利用性。预计在澳大利亚、中国、欧洲、香港、韩国和美国针对2型糖尿病和肥胖症受试者的III期试验已于2015年底完成,但结果尚未报道。
c.钠/葡萄糖共转运蛋白抑制剂
肾小管中钠/葡萄糖转运蛋白(SGLT)2的抑制增加尿葡萄糖排泄,另外SGLT1的抑制可能改变肠道中的葡萄糖吸收。卡格列净(Canagliflozin,双重SGLT1+2抑制剂)已经被批准用于2型糖尿病,但现在已被重新用于治疗肥胖症。在肥胖2型糖尿病患者中,使用卡格列净,300mg/天,共26周,体重减轻为3.3%(2.9kg),血糖控制改善,血压降低。然而,与安慰剂相比,卡格列净的生殖器和尿道感染和渗透性利尿相关不良事件的发生率更高。卡格列净与芬特明(Phentermine)得组合使用似乎具有协同作用,体重减轻6.9%。在新进入的美国II期临床研究中,26周后,卡格列净与芬特明的组合应用优于卡格列净和芬特明单一疗法(1.3%和3.5%)。另一种SGLT-2抑制剂LIK-066也是针对美国肥胖症受试者的II期临床试验(NCT02470403)。最近,针对2型糖尿病患者的心血管结局试验CANVAS (NCT01032629)的临床结果显示增加2型糖尿病患者骨折、肢体截肢、酮症酸中毒和肾损伤的风险。相比之下,用于治疗2型糖尿病(EMPA-REG)的另一种SGLT-2抑制剂依帕列净(Empagliflozin)的心血管结局试验显示,在降低心血管和全因死亡率以及肾脏保护作用方面取得了令人印象深刻的成果。然而,依帕列净尚未获得肥胖治疗的许可。
②靶向脂肪、肌肉和/或肝组织的药物
a.甲硫氨酸氨肽酶-2和血管生成抑制剂
脂肪组织的扩张需要毛细血管网络的连续重塑,即动态血管生成。由于肥胖和相关疾病例如CVD,2型糖尿病和恶性肿瘤涉及血管生成的病理形成,因此抑制血管生成可能具有作为肥胖症新型治疗策略的潜力。甲硫氨酸氨基肽酶-2 (MetAP2)抑制剂最初是由于其抗血管生成特性而被开发为实体瘤疗法,但现已被证明可有效降低体重。MetAP2抑制剂发挥其抗肥胖作用,不仅通过抑制血管生成,而且通过不同的信号级联刺激能量消耗和脂肪利用。皮下给药的MetAP2和血管生成抑制剂Beloranib最近处于II期临床试验阶段,但由于血栓栓塞事件发生率增加,现在已经终止了开发。Beloranib造成令人印象深刻的减肥13%,而安慰剂组为3.1%。在最高剂量下,95%和74%的肥胖受试者分别实现>5%和>10%的体重减轻。此外,与安慰剂相比,该药物改善了几种心脏代谢风险标志物,包括脂肪量、腰围、肝脏脂肪、血糖控制、β细胞功能和胰岛素敏感性。第二代MetAP2抑制剂ZGN-1061目前处于治疗严重和复杂肥胖症的I期临床试验阶段。用于治疗NASH和腹部肥胖的肝靶向MetAP2抑制剂(ZGN-839)也正在进行临床试验。
b.血管生成和基质金属蛋白酶抑制剂
基质金属蛋白酶(MMPs)是通过其分解细胞外基质而参与组织重塑和血管生成的内蛋白酶。较高水平的MMP与CVD和肥胖有关。虽然大多数减肥药物都集中于减轻总体重,但口服MMP抑制剂ALS-L1023特别适合作用于与肥胖代谢风险密切相关的内脏脂肪。ALS-L1023正在韩国开发,已进入III期临床试验阶段。126名患者的II期临床研究表明,每天口服1200mg,12周后,CT评估的内脏脂肪减少了15%。效果优于安慰剂,无明显不良事件。基于这些发现,ALSL1023似乎在减少内脏脂肪方面比运动更有效。
c.成纤维细胞生长因子受体4 (FGFR4)抑制剂
FGFR4除了其他外周组织外还在肝脏中高度表达,并且参与脂肪储存,能量消耗和体重的调节。反义寡核苷酸IONISFGFR4Rx通过下调FGFR4起作用。肥胖小鼠中使用10周可以显著抑制肝脏FGFR4表达,并伴有20%的体重降低(包括肝脏脂肪含量降低)以及葡萄糖代谢和脂质水平的改善。能量消耗增加,但食物摄入不受影响。皮下给药后,药物分布到周围组织,但不能进入心肌,不会穿过血脑屏障,因此希望可以避免心脏和CNS副作用。ONIS-FGFR4R在美国启动了II期临床试验(NCT02476019),以支持在人体中的安全性。该公司还在开发治疗糖尿病和NASH的另外四种反义药物。
d.AMP活化蛋白激酶(AMPK)激活剂
AMPK在调节细胞和全身代谢中起关键作用,并被诸如运动等细胞应激激活,其消耗细胞ATP导致AMP相应上升。在肝脏、肌肉和脂肪组织中的AMPK活化启动了催化过程,导致葡萄糖,脂肪酸和甘油三酯的氧化增加,同时葡萄糖,糖原,脂肪酸,胆固醇和甘油三酯的储存减少。因此,通过运动或药理学手段激活AMPK,已成为逆转肥胖症代谢异常的潜在途径。已经证明用植物来源的AMPK激活剂白藜芦醇治疗肥胖人可以模拟能量限制的有益代谢作用。MPK激活剂MB-11055在韩国目前处于肥胖症的II期临床试验阶段。
e.β2-肾上腺素能受体激动剂
长效β2-肾上腺素能受体激动剂昔萘酸沙美特罗(Salmeterol Xinofoate),主要用于减少局部区域皮下脂肪的美容目的。它通过脂肪细胞上的β2-肾上腺素能受体的局部激活起作用,导致注射部位脂肪的脂肪分解和斑点减少。该化合物通过一系列多次皮下注射给药,目前正在美国进行肥胖症的研究。54位健康成年人使用昔萘酸沙美特罗治疗4周后,加入强效类固醇以减少肿胀,减少腹围和皮肤厚度。预计160名肥胖受试者的另一次美国II期临床试验结果将会很快公布(NCT01180465)。
3.外周和中枢作用
①GLP-1受体激动剂
几种肠激素调节能量稳态,改变这些激素的餐后分泌似乎对减肥手术后的体重减轻很重要。因此,模仿胃旁路手术后观察到的餐后肠激素反应已成为治疗肥胖的策略越来越受到关注。GLP-1受体激动剂最初被开发用于治疗2型糖尿病,但是除了改善血糖控制之外,已被证明可以减轻体重。GLP-1激动剂利拉鲁肽在2015年被批准用于肥胖。
目前正在评估每周至每月给药的几种长效GLP-1受体类似物。这些长效药物将需要更少的注射频率并提供更稳定的血液浓度,增加依从性,并避免峰值水平更可能引起副作用,特别是恶心。许多化合物用于治疗2型糖尿病也处于开发后期或已上市上,其体重减轻为次要终点。Langlenatide是一种长效的毒蜥外泌肽-4类似物,每周/每月皮下给药,用于治疗2型糖尿病和肥胖。在欧洲,韩国和美国进行297例肥胖受试者的II期临床试验中,每周8mg的剂量,为期20周,扣除安慰剂的体重降低为7.3 kg。设计为每周一次的艾塞那肽(Exenatide) ER (NCT02496611;NCT02794402)和Semaglutide在全球几个国家都处于II期临床试验。在对30例无2型糖尿病肥胖患者的研究中,Semaglutide在12周后引起5.0kg的体重减轻,而安慰剂组为1.0kg体重增加。另外一个包括935名肥胖受试者的II期临床试验目前正在多个地方(欧洲,美国,加拿大,澳大利亚和以色列 - NCT02453711)进行。值得注意的是,近来有报道称,用Semaglutide治疗2年(SUSTAIN-6)的肥胖型2型糖尿病患者(n=3297),可观察到心血管和血糖控制的改善以及体重降低4.3kg。口服Semaglutide已经完成了632例肥胖2型糖尿病患者的III期临床试验,每日摄入40mg Semaglutide,26周后证明了血糖控制和体重减轻5.7 kg。每周一次皮下注射1mg Semaglutide后,观察到了相似的改善作用。此外,艾塞那肽(ITCA650)处方已被设计用于通过可植入的皮下渗透性微型泵的输送,其尺寸类似于火柴棒,从单次植入可提供长达1年的治疗。
②PYY和胰岛淀粉样多肽
除了GLP-1之外,已经探索了包括PYY,OXM,生长素释放肽,PP和胰岛淀粉样多肽在内的几种肠和胰源激素作为减肥药的可能。PYY通过外周和CNS中的Y2受体,特别是下丘脑ARC起作用,并且对食物摄取具有有效的抑制作用。尽管对啮齿动物和人类的研究已经显示出有希望的结果,但长效PYY3-36类似物AC-162352的进一步开发已被终止。在美国,胰淀素类似物普兰林肽(Pramlintide)在肥胖症的第II期临床试验中显示出持续的体重减轻一年。然而,普兰林肽作为单一疗法的开发停止了,而倾向于有利于组合方法。
③胰高血糖素和OXM
胰高血糖素通过在BAT中诱导产热来增加啮齿动物和人类的静息能量消耗。结合胰高血糖素的作用增加能量消耗,GLP-1降低食欲并对抗胰高血糖素的糖尿病作用,已经在临床前试验中证明了这个有趣的结果。双重激动剂概念的基础是从L细胞分泌的天然肠激素OXM,同时作用于GLP-1和胰高血糖素受体以控制能量内稳态。OXM的长效类似物在I期临床试验阶段(NCT02692781),但关键的一步是确定达到最大体重减轻而不损害葡萄糖耐量的GLP-1/胰高血糖素受体拮抗剂的比例。几家公司正在尝试构建最佳单分子GLP-1/胰高血糖素双重激动剂—六种药物在I期临床试验中,至少有一种药物处于II期临床试验(TT-401)中,用于糖尿病和肥胖症。此外,同时靶向GLP-1,胰高血糖素和GIP(胃抑制肽)的受体的肽三聚体已被证明是高效的并且优于啮齿动物模型中的双重激动剂。在啮齿动物中,该三重激动剂产生显著的体重减轻,葡萄糖代谢改善,并逆转肝脏脂肪变性,从而接近减肥手术引起的代谢改善。
④瘦素组合物
瘦素替代成功地治疗由先天性瘦素引起的早发性肥胖症,但当对肥胖受试者使用时,结果令人失望。这是通过肥胖症的瘦素抵抗状态来解释的,尽管瘦素单一疗法可能仍然可用作以前减肥的个体的体重维持治疗。然而,一些分子可能恢复对瘦素的反应性。在II期临床试验中,瘦素类似物美曲普汀(Metreleptin)和胰岛淀粉样多肽类似物普兰林肽的组合产生比单一疗法或安慰剂更大和更持续的体重减轻。然而,研究结果暂停后,美曲普汀中和抗体的进一步开发已经停止。瘦素类似物和其他减肥剂(例如毒蜥外泌肽-4,成纤维细胞生长因子21或GLP-1 /胰高血糖素激动剂)的不同组合处于临床前开发阶段。
参考文献
Christoffer Martinussen,Kirstine Nyvold Bojsen-Moller,Maria Saur Svane,Thomas Fremming Dejgaard& Sten Madsbad (2017) Emerging drugs for the treatment of obesity,Expert Opinion on Emerging Drugs,22:1,87-99,DOI: 10.1080/14728214.2017.1269744
来源:药渡(微信号 Pharmacodia) 作者:走进心时代
为你推荐
 资讯
资讯 圣因生物完成超 1.1 亿美元 B 轮融资,加速 RNAi 疗法全球布局
本轮融资由知名产业机构领投,国际主权基金、中国生物制药、君联资本等十余家机构跟投,全球制药巨头礼来公司战略入局,高瓴创投、启明创投等现有股东持续加码支持,融资规模创...
2025-12-12 16:59
 资讯
资讯 投后估值达21.37亿元,实体瘤细胞治疗领军企业君赛生物递表港交所
君赛生物共有5款在研产品,其中核心产品也是进展最快的是GC101,正开展上市前的关键II期临床试验,有望成为国内首个获批上市的TIL细胞创新药
2025-12-12 09:24
 资讯
资讯 ESMO-IO | ORR达41.7%!君赛生物GC101 TIL治疗晚期后线非小细胞肺癌I期数据首次公布
这不仅是全球首个无需高强度清淋化疗、无需IL-2给药的TIL疗法治疗肺癌的临床研究,也是国内首个公开披露该领域数据的注册性临床研究。
2025-12-12 09:17
 资讯
资讯 君合盟生物启动重组 A 型肉毒毒素治疗成人上肢痉挛状态临床 III 期试验,并完成首例患者入组
该临床试验由复旦大学附属华山医院李放教授和上海市养志康复医院(即上海市阳光康复中心)靳令经教授联合牵头
2025-12-11 21:06
 资讯
资讯 Medidata发布全新调研报告:临床试验AI应用价值凸显,超七成用户反馈“达到或超预期”
基于对来自全球制药公司、生物科技公司及合同研究组织(CRO)中超200位核心决策者的深度调研,报告显示,目前AI在改善患者招募、优化数据管理、控制运营成本和提升试验效率等方...
2025-12-11 20:57
 资讯
资讯 近20年首个全新类别抗菌药物醋酸来法莫林纳入医保,开启中国成人社区获得性肺炎治疗普惠新篇章
该产品继2025年6月30日获得国家药品监督管理局批准用于治疗成人社区获得性肺炎(CAP)后又纳入国家医保目录
2025-12-11 20:50
 资讯
资讯 专注 “生物学 + AI” ,普瑞基准完成超亿元 D 轮融资,加速 AI 驱动新药研发
本轮融资由信立泰、广投资本、申宏中恒基金联合领投,老股东金谷汇枫、聚翊投资持续跟投
2025-12-10 15:55
 资讯
资讯 别把“嗜睡”当懒癌!新型促觉醒药翼朗清®获批,专注维持日间清醒
促觉醒药物翼朗清®(盐酸索安非托片)正式获得中国国家药品监督管理局(NMPA)批准,用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度嗜睡(EDS)的成人患者的觉醒程度。
2025-12-10 11:04
 资讯
资讯 复星医药将其GLP-1产品全球化权益授权辉瑞,总里程碑付款近150亿人民币
12月9日晚间,复星医药发布公告称,公司控股子公司药友制药、复星医药产业与辉瑞共同签订《许可协议》,(其中主要包括)由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)...
2025-12-10 09:12
 资讯
资讯 Capricor Therapeutics公司宣布外泌体疗法Deramiocel在DMD三期中取得积极成果
近日,专注与外泌体疗法的Capricor Therapeutics(纳斯达克代码:CAPR)公司宣布其核心管线Deramiocel在杜氏肌营养不良症关键三期 HOPE-3 研究中取得积极成果。
2025-12-09 16:38
 资讯
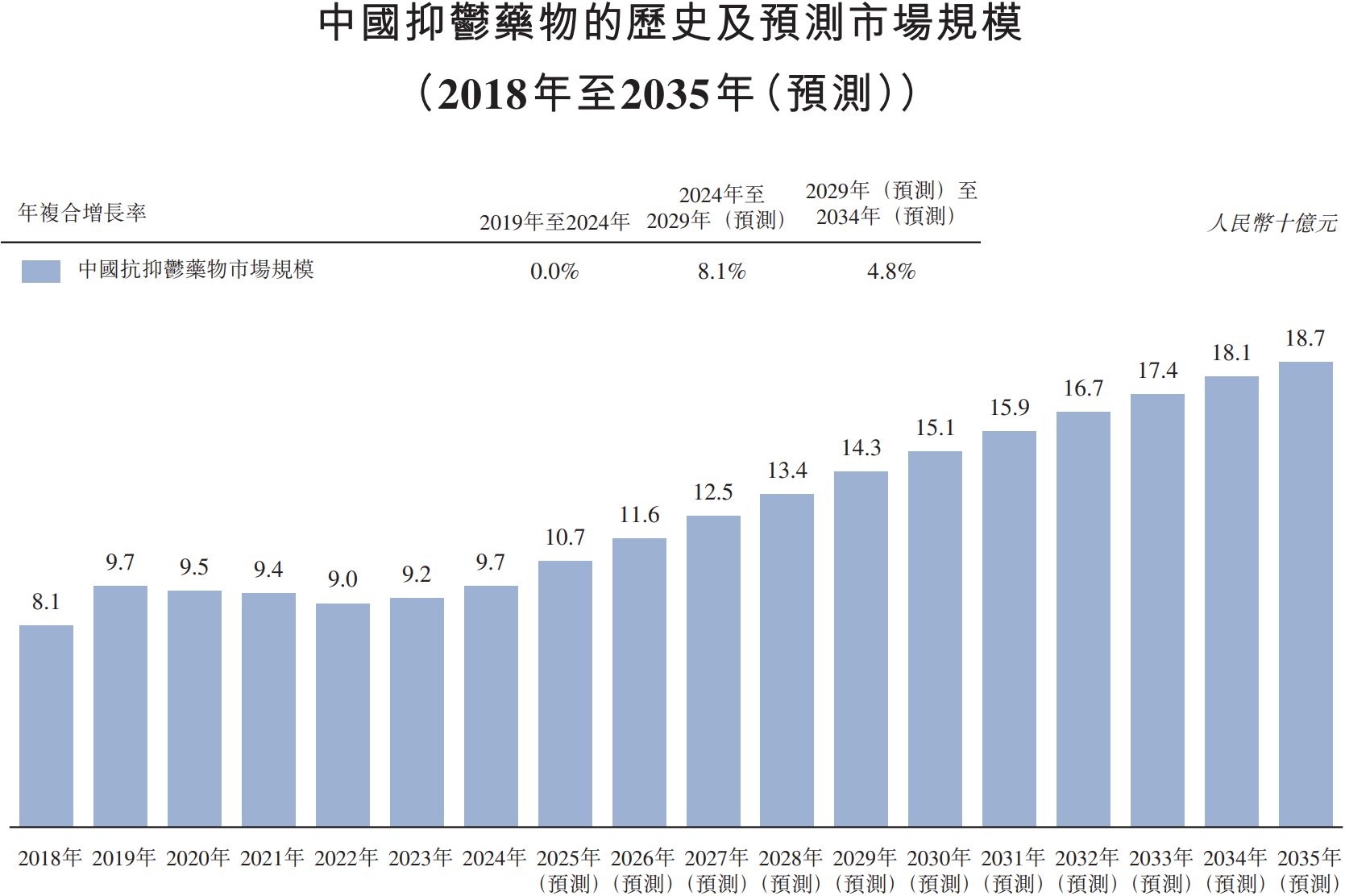
资讯 中药1类创新药剑指抑郁症治疗蓝海,远大医药GPN01360成功达到国内II期临床终点
国产抗抑郁症药物研发取得重大进展。近日,远大医药(0512 HK)的1 1类中药创新药GPN01360国内II期临床研究成功达到临床终点,产品表现出显
2025-12-08 18:27