Kite Pharma与诺华(Novartis)公司靶向CD-19抗原的CAR-T细胞疗法已经进入了FDA审批的最后阶段,它们有望成为在2017年第一批被FDA批准的CAR-T细胞疗法。近日,这两家公司同时在欧洲血液学协会(European Hematology Association)第22届年会上发布了各自疗法的最新临床试验数据分析结果。
Kite Pharma公布是使用axicabtagene ciloleucel (axi-cel, KTE-C19)治疗难治性,侵袭性非霍奇金淋巴瘤(NHL)的多中心临床2期试验结果。Axi-cel已于今年5月获得了FDA颁发的优先审评资格。在名为ZUMA-1的临床试验中,101名患有弥漫性大B细胞淋巴瘤(DLBCL),原发性纵隔B细胞淋巴瘤(PMBCL)或转化滤泡淋巴瘤(transformed follicular lymphoma)的患者接受了剂量为2X106细胞/公斤体重的axi-cel治疗。这些患者的肿瘤都属于难治性或复发性肿瘤。ZUMA-1试验达到了它的主要终点:在调整的意向治疗人群(modified intent-to-treat population) 中的客观缓解率(ORR) 达到82%,其中完全缓解率(CR) 达到54%。患者的临床肿瘤亚型、难治程度、肿瘤级别以及淋巴瘤国际预后指数(International Prognostic Index)等重要变量并没有对他们的临床反应产生显著影响。Axi-cel达到的CR水平比历史上的对照组CR水平高出7倍。而且在平均为期8.7个月的跟踪调查中,大约有一半的患者仍然保持有临床反应。
诺华公司公布的是使用CTL019治疗复发性或难治性DLBCL患者的开放标签,多中心临床2期试验的中期分析结果。CTL019已于今年3月获得了FDA颁发的优先审评资格,4月又获得了FDA颁发的突破性疗法认定。在名为JULIET的临床试验中,位于10个国家的85名患者接受了一次CTL019治疗。这些患者的肿瘤在已经接受过至少两种不同疗法后仍然复发或恶化,而且他们不适合使用干细胞移植疗法。JULIET临床试验也达到了它的主要终点。在51名跟踪调查时间超过3个月或提前结束试验的患者中,最佳总缓解率(best overall response rate) 达到59%, 其中包括43%的CR和16%的部分缓解(PR)。所有达到完全缓解的患者在数据截止时仍然处于完全缓解状态。
▲CTL019的治疗流程(图片来源:诺华官网)
CAR-T细胞疗法的副作用也是值得关注的临床数据。在这方面,axi-cel导致3级或3级以上细胞因子释放综合征(cytokine release syndrome, CRS)的患者比例为13%, 而CTL019为26%。Axi-cel导致3级或3级以上神经系统不良事件的患者比例为28%,而CTL019为13%。
这两项临床试验结果表明无论是axi-cel还是CTL019都表现出高缓解率和可控的副作用。让我们预祝它们在更多的临床试验中取得好结果,为癌症患者造福。
参考资料
[1] European Hematology Association: Clinical and Biologic Covariates of Outcomes in ZUMA-1: A Pivotal Trial of Axicabtagene Ciloleucel (axi-cel; KTE-C19) in Patients with Refractory Aggressive non-Hodgkin Lymphoma (NHL)
[2] European Hematology Association: Global Trial of the Efficacy and Safety of CTL019 in Adult Patients with Relapsed or Refractory Diffuse Large B-cell Lymphoma: An Interim Analysis of the JULIET Study
来源:药明康德(微信号 WuXiAppTecChina)
为你推荐
 资讯
资讯 带状疱疹疫苗“遇冷”,百克生物2024年净利润腰斩
近日,国内疫苗龙头企业百克生物发布2024年年报,数据显示,其报告期内实现营收12 29亿元,同比下降32 64%;归属于上市公司股东的净利润2 32亿元,同比下降53 67%。对于营收...
2025-04-23 12:59
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
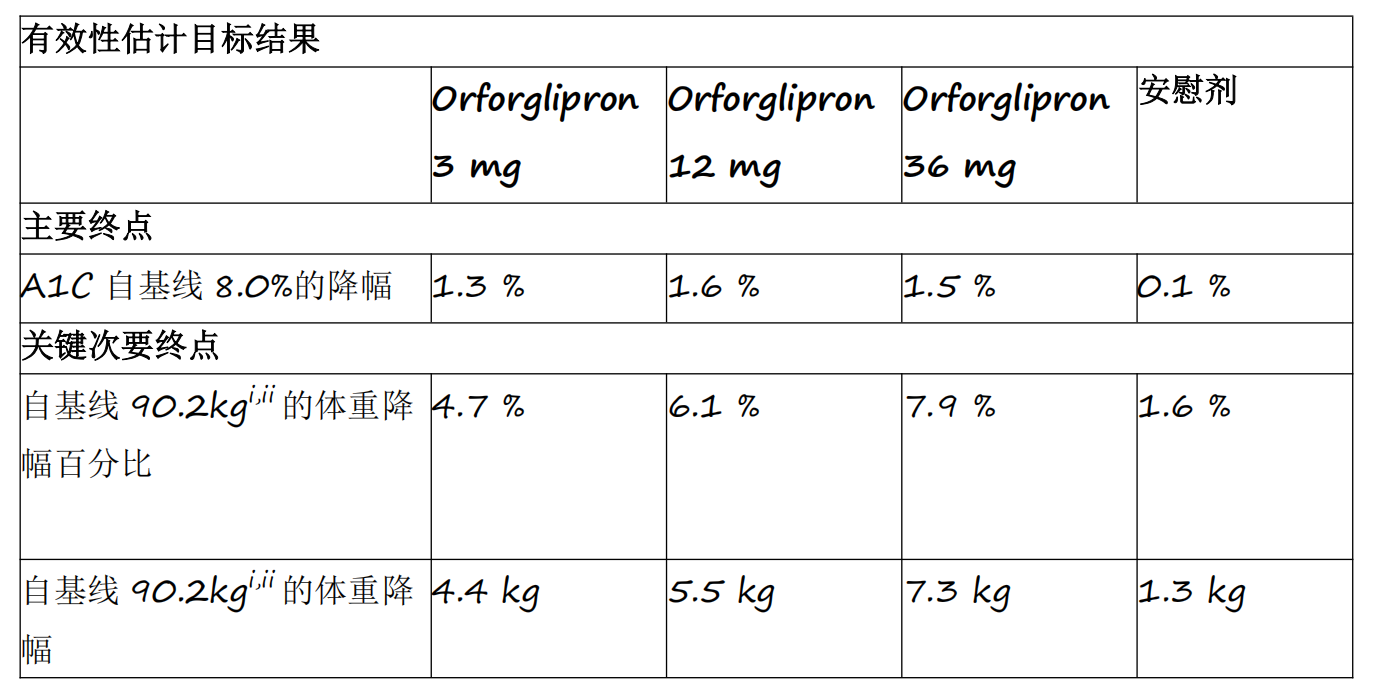
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12










