急性淋巴细胞性白血病简介
急性淋巴细胞性白血病(ALL)是一种起源于淋巴细胞的B系或T系细胞在骨髓内异常增生的恶性肿瘤性疾病。异常增生的原始细胞可在骨髓聚集并抑制正常造血功能,同时也可侵及骨髓外的组织,如脑膜、淋巴结、性腺、肝等。我国曾进行过白血病发病情况调查,ALL发病率约为0.67/10万。在油田、污染区发病率明显高于全国发病率。ALL儿童期(0~9岁)为发病高峰,可占儿童白血病的70%以上。ALL在成人中占成人白血病的20%左右。目前依据ALL不同的生物学特性制定相应的治疗方案已取得较好疗效,大约80%的儿童和30%的成人能够获得长期无病生存,并且有治愈的可能。目前,对于ALL病因及发病机制尚未完全清楚,但与一些危险因素有关,主要是遗传及家族因素;环境影响及基因改变。
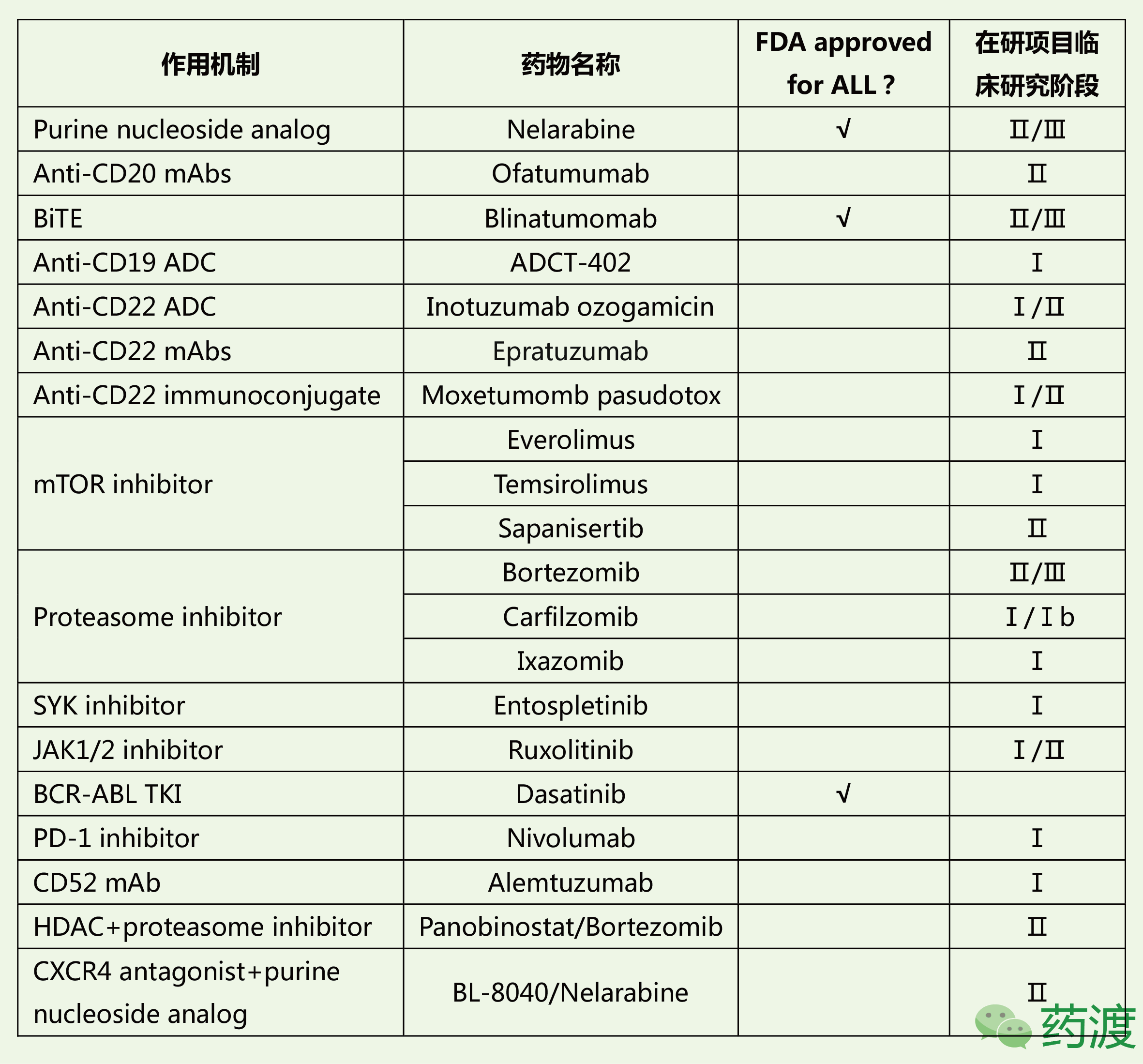
目前针对ALL的标准治疗方案所使用药物多为上世纪九十年代前所开发。近些年,随着对于ALL发病机制的深入研究,以及新型靶点的发现,一些新型药物获得FDA批准进入该病治疗领域,同时有大量候选药物也处在不同研发阶段。本文即按照作用机制的不同,对ALL治疗领域现有及主要在研药物做一简要盘点。
嘌呤核苷类似物
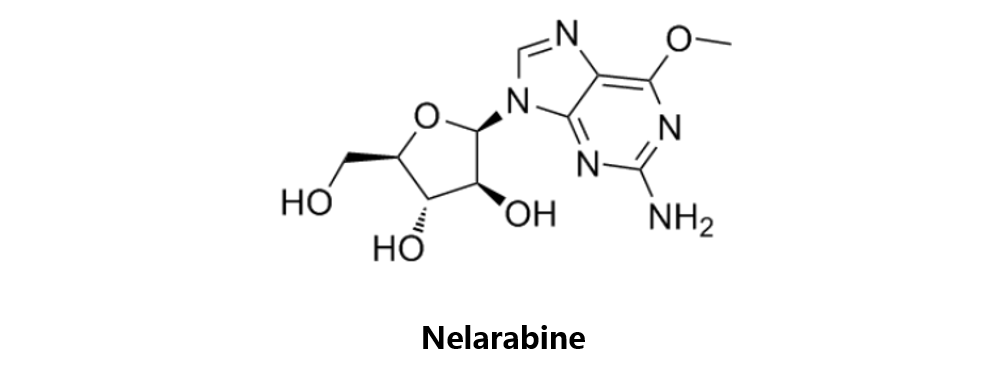
Nelarabine
奈拉滨由GSK原研,与2005年10月28日获得美国FDA批准,之后分别于2007年8月22日及10月19日获得EMA及PMDA批准,商品名分别为Arranon(美国和日本)和Atriance(欧洲)。
该药物是一种核苷代谢抑制剂,可以转变成具有活性的5‘三磷酸盐。后者可在白血病母细胞中逐渐积聚,并与DNA整合而导致DNA合成的抑制,促进细胞凋亡。该药用于治疗曾经接受过至少两种化疗方案但无效或病情反复的急性T细胞型淋巴细胞白血病及T细胞型淋巴母细胞淋巴瘤。近期有两项代码为NCT02619630和NCT02881086的Ⅱ期及Ⅲ期临床试验正在进行中,分别用于高风险T细胞型ALL的巩固和维持治疗,以及T细胞型ALL的巩固治疗。该药物对对不同肿瘤细胞的IC50为0.067-2.15 μM。
Anti-CD20单抗及ADC类药物
CD20表达于除浆细胞(分泌免疫球蛋白的B细胞)外的发育分化各阶段的B细胞的表面,通过调节跨膜的钙离子流动直接对B细胞起作用,在B细胞增殖和分化中起重要的调节作用。它在95%以上的B细胞性淋巴瘤中表达,而在造血干细胞、血浆细胞和其他正常组织中不表达。目前靶向于CD20的单抗及抗体偶联药物主要有Rituximab、Ofatumumab及Obinutuzumab。
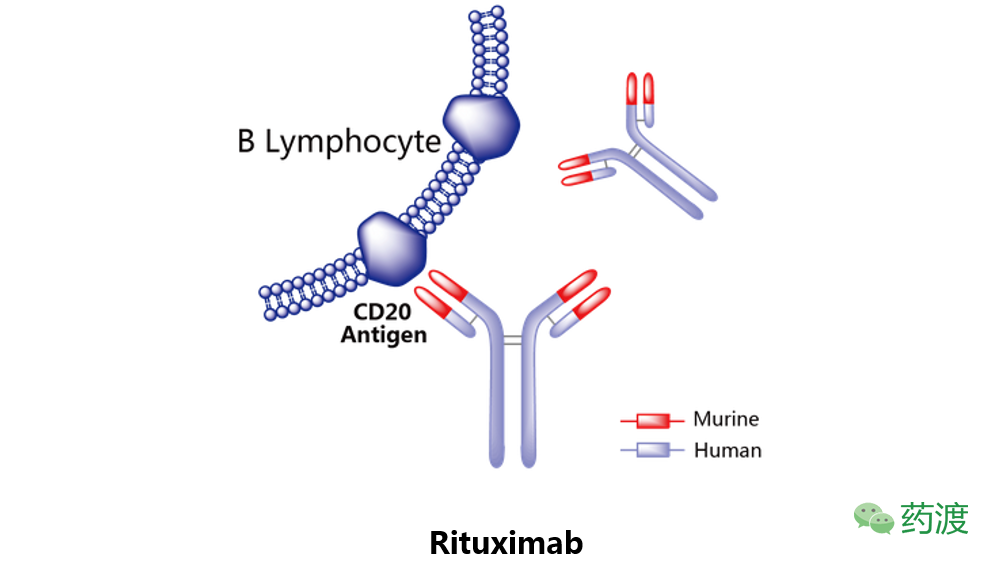
Rituximab
利妥昔单抗由百健和罗氏联合研发,于1997年获得美国FDA批准上市,并分别于1998年及2001年获得EMA及PMDA批准。2008年4月21日被中国CFDA批准上市,并由百健和罗氏在美国、欧洲、日本和中国销售,商品名为Rituxan及MabThera。
利妥昔单抗是一种靶向于CD20的人鼠嵌合型单克隆抗体,其与表达在B淋巴细胞表面的CD20抗原结合,通过补体依赖的细胞毒作用(CDC)和抗体依赖的细胞毒作用(ADCC)杀伤肿瘤B细胞。该药批准的适应症为非霍奇金淋巴瘤、慢性淋巴细胞白血病、类风湿性关节炎、肉芽肿血管炎和显微镜下多血管炎。当同标准治疗方案及巩固性化疗联合使用时,Rituximab可显著改善CD20阳性ALL患者的痊愈率及整体生存率。
Ofatumumab
由Genmab原研,于2009年10月26日获得美国FDA批准,并分别于2010年及2013年获得EMA及PMDA批准上市,并由Genmab,诺华和GSK在美国、欧洲和日本市场共同研发和销售,商品名为Arzerra。
Ofatumumab是一种全人源IgG1k型单克隆抗体,能结合表达于正常B淋巴细胞和B细胞慢性淋巴性白血病(CLL)表面的CD20分子,并通过补体依赖的细胞毒作用(CDC)和抗体依赖的细胞毒作用(ADCC)杀伤肿瘤B细胞。该药物适应症为慢性淋巴细胞性白血病(CLL)。目前一项Ⅱ期临床试验中,该药物同hyper-CVAD联合用于新确诊的ALL患者,且中期数据进展良好。
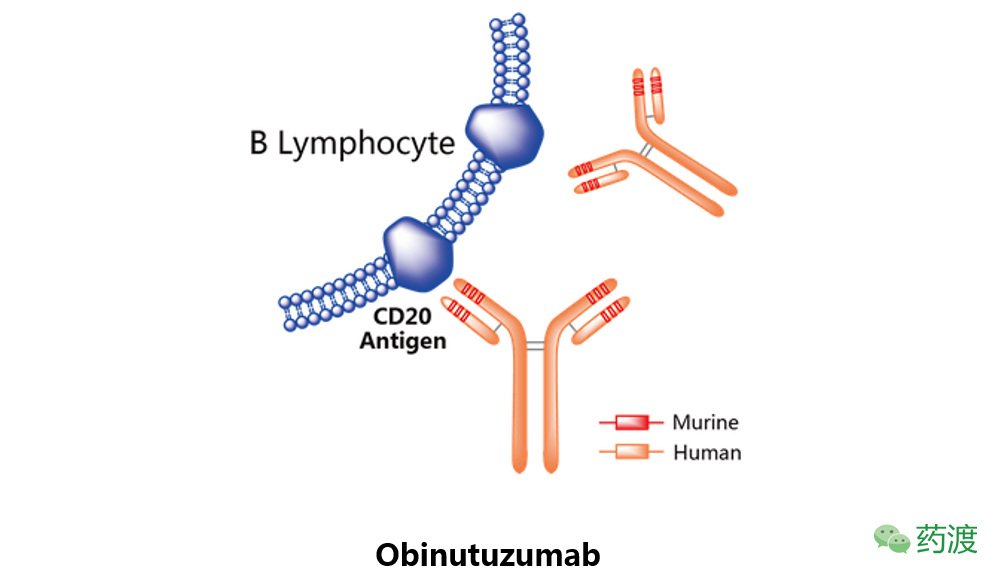
Obinutuzumab
由基因泰克研发,于2013年11月1日获得美国FDA批准,2014年7月23日获得EMA批准上市,并由罗氏在美国和欧洲市场销售,商品名为Gazyva和Gazyvaro。
该药物是一种人源化IgG1单克隆抗体,与表达在B淋巴细胞表面的CD20抗原结合,通过补体依赖的细胞毒作用(CDC)和抗体依赖的细胞毒作用(ADCC)杀伤肿瘤B细胞。该药物的批准适应症为慢性淋巴细胞性白血病和滤泡性淋巴瘤。相比于Rituximab及Ofatumumab,Obinutuzumab表现出更少的CDC及ADCC等细胞毒性。该药物在早期B淋巴细胞性ALL中的应用正在探索中。
Anti-CD19单抗及ADC类药物
在正常的淋巴组织中,CD19位于生发中心细胞(B细胞和滤泡树突状细胞)、套区细胞和滤泡间散在的细胞。在肿瘤组织中,CD19阳性见于绝大多数的B细胞肿瘤,浆细胞淋巴瘤以及T细胞肿瘤阴性。研究表明,CD19在14%弥漫性大B细胞淋巴瘤、30%的T细胞丰富的B细胞淋巴瘤和75%的移植后B淋巴增殖性疾病中阴性,在经典霍奇金病中的R-S细胞亦不表达。总体上大约有80%的ALL淋巴母细胞高表达CD19分子。目前靶向于CD19的单抗及抗体偶联药物主要有Blinatumomab、Denintuzumab Mafodotin及ADCT-402。
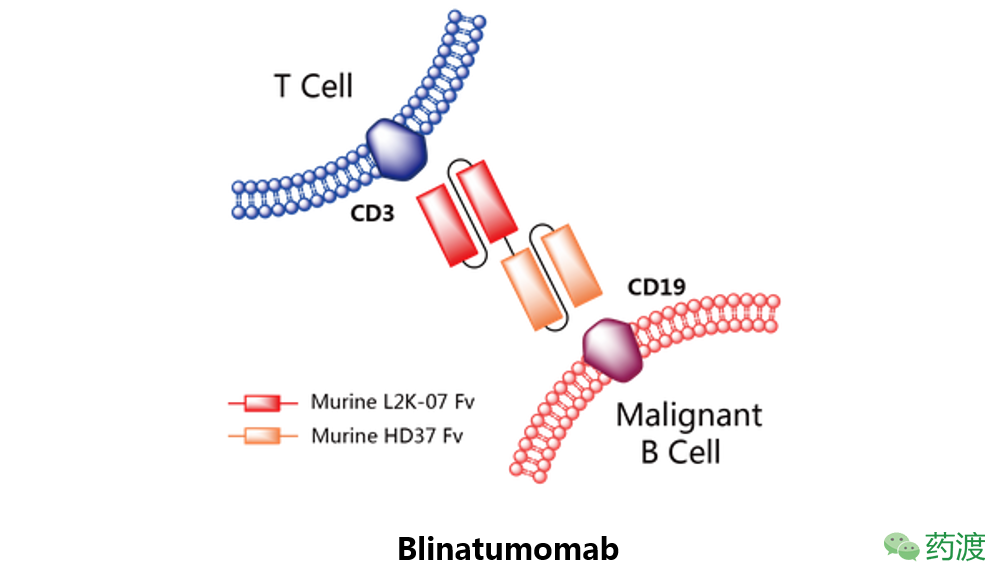
Blinatumomab
由安进研发,于2014年12月3日获得美国FDA批准,2015年11月23日获得EMA批准上市,并由安进在美国市场销售,商品名为Blincyto。该药物是一种双特异性scFv抗体,靶向于CD19和T细胞CD3,在CD3+T细胞和CD19+的B系淋巴细胞间形成突触,诱导CD19+的细胞定向裂解。该药批准的适应症为费城染色体阴性的复发难治的B细胞起源的急性淋巴性白血病(ALL)。目前多项针对Blinatumomab的临床试验仍在进行中,以研究其在不同类型的ALL患者中的应用。该药物副作用包括细胞因子释放综合征和神经毒性,需要在使用时密切监控。
Denintuzumab Mafodotin
Seattle Genetics原研,一种潜在的治疗急性淋巴细胞性白血病、滤泡性淋巴瘤和弥散大B细胞淋巴瘤的CD19抗体与微观蛋白拮抗剂mafodotin的抗体偶联药物。在此前的一项Ⅰ期临床研究中效果良好,目前处于Ⅱ期临床试验阶段。
ADCT-402
ADC Therapeutics原研,一种潜在的治疗急性淋巴细胞性白血病和非霍奇金淋巴瘤的抗CD19单抗与DNA损伤细胞毒性药物pyrrolobenzodiazepine二聚体的抗体偶联药物。当通过内吞作用进入细胞内部后,偶联药物可以交联并抑制DNA的复制,从而抑制表达CD19肿瘤细胞的增殖。目前针对ADCT-402的一期临床项目NCT02669264正在进行中,用以评估对R/R B细胞型ALL患者的效果。
Anti-CD22单抗及ADC类药物
CD22分子普遍存在于正常B细胞及B细胞相关恶性肿瘤,其对BCR细胞信号转导的抑制作用已被广泛认可。近些年来对CD22分子的研究主要集中在胞内信号传导通路、生物学功能及抗体靶向治疗上,并且取得了许多突破性进展。目前靶向于CD22的单抗及抗体偶联药物主要有Inotuzumab Ozogamicin、Moxetumomb Pasudotox、Coltuximab Ravtansine及Epratuzumab。
Inotuzumab Ozogamicin
辉瑞及优时比原研,是一种用于治疗急性淋巴细胞白血病的靶向CD22的抗体偶联药物。2013年,该药物被欧洲EMA认定为治疗急性淋巴细胞白血病的孤儿药。2016年在欧洲提交上市申请,曾进行过治疗非霍奇金淋巴瘤(NHL)的临床三期试验,但因结果不乐观而被终止。目前针对Inotuzumab Ozogamicin正在开展的临床试验主要有NCT01925131、NCT01371630及NCT01664910。
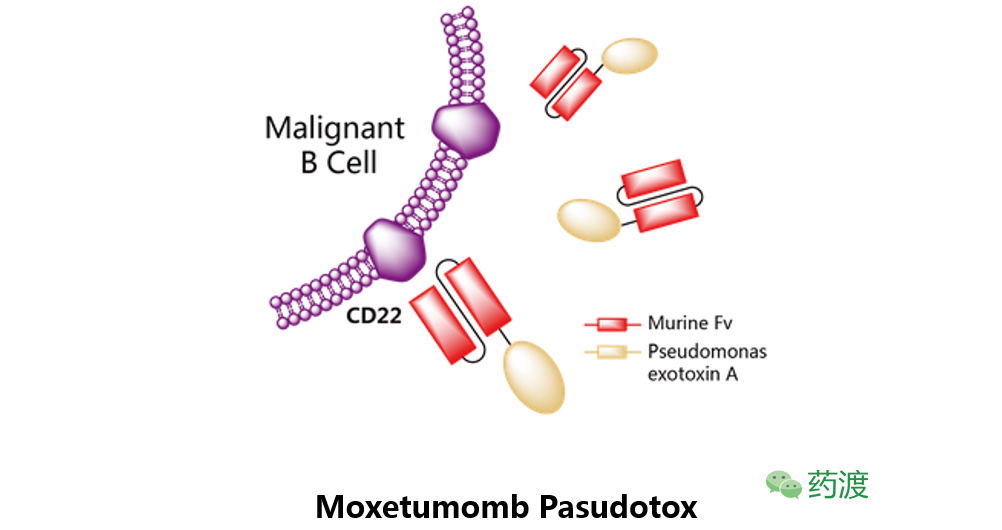
Moxetumomb Pasudotox
最初由美国国家癌症研究所研发,之后授权给阿斯利康子公司MedImmune。该药物是一种重组的靶向于CD22的抗毒素,目前处于治疗毛细胞白血病的临床三期研究阶段,以及治疗儿童急性淋巴细胞性白血病的临床二期试验阶段。2013年,Moxetumomb Pasudotox被欧洲EMA认定为治疗B淋巴细胞性白血病/淋巴瘤的孤儿药。目前针对ALL的临床项目代码为NCT01891981。
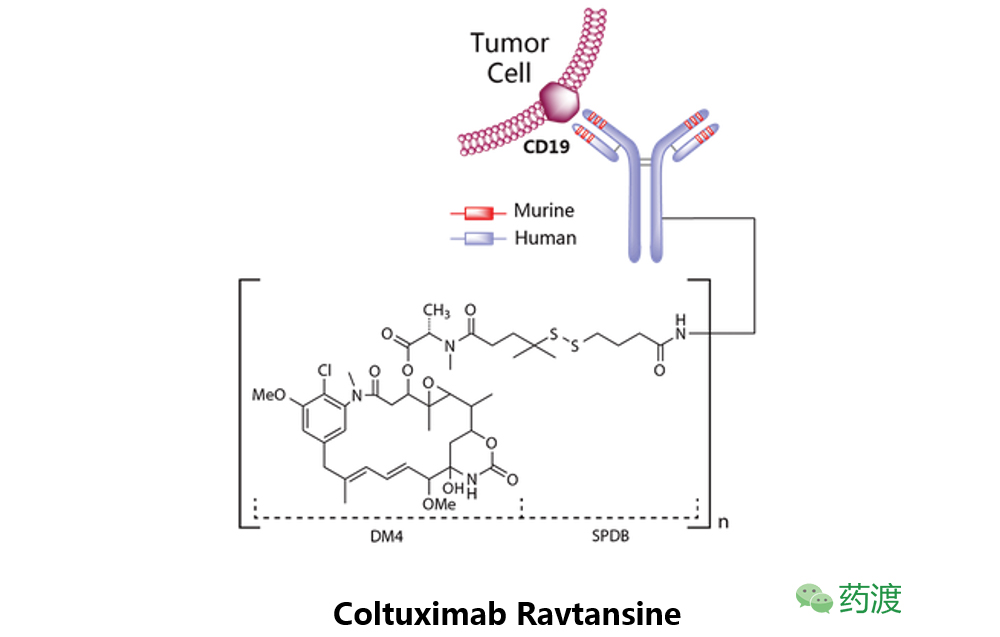
ColtuximabRavtansine
该药是利用ImmunoGen公司的TAP技术开发的抗体偶联药物,之后Sanofi获得了该药物的共同研发和商业化的授权。赛诺菲与2014年终止了该药物的开发,ImmunoGen公司于2015年收回该药物的研发权。Coltuximab Ravtansine是一种靶向于D19的单克隆抗体与微观蛋白拮抗剂DM4的偶联药物,目前处于临床二期研究阶段,用于治疗弥漫大B细胞淋巴瘤。该药曾进行过治疗急性淋巴细胞性白血病ALL的临床二期研究,但目前该项研究已经终止。
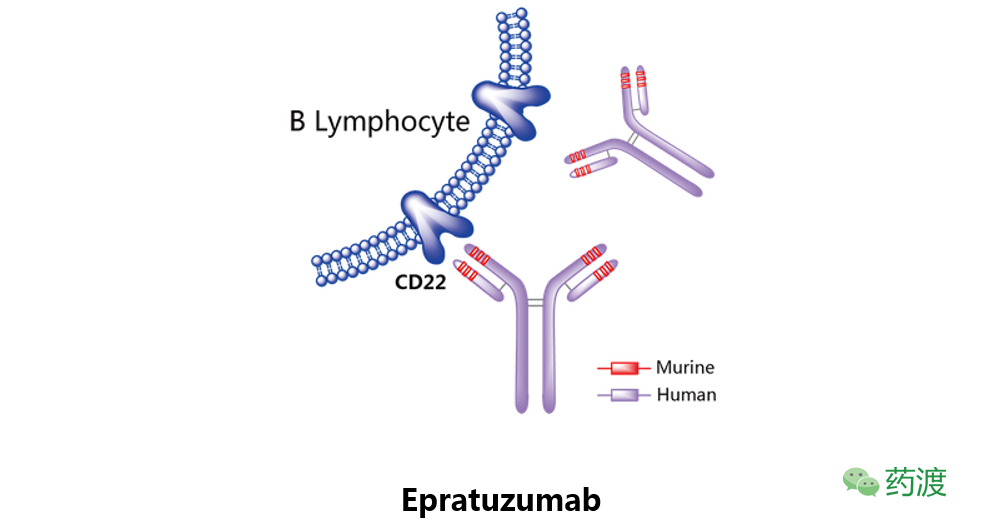
Epratuzumab
最初由Immunomedics开发,之后授权给优时比进行自身免疫疾病的研发。Epratuzumab是一种靶向于CD22的单克隆抗体,目前处于治疗系统性红斑狼疮的临床三期研究阶段,以及急性淋巴细胞性白血病和Sjogren综合征的临床二期试验阶段。曾进行过治疗非霍奇金淋巴瘤的临床研究,但该研究已被终止。该药物已被美国FDA认证为治疗非霍奇金淋巴瘤(1998年)和急性淋巴细胞性白血病ALL(2008年)的孤儿药。2005年,美国FDA将其治疗系统性红斑狼疮申请列入快速审批名单。
Anti-CD52单抗药物
Alemtuzumab
CD52存在于36-66%的淋巴细胞中。Alemtuzumab是一种靶向于CD52的人源化单克隆抗体,其与T淋巴细胞和B淋巴细胞表面的CD52结合,并通过补体依赖的细胞毒作用和抗体依赖的细胞毒作用杀伤肿瘤细胞。该药物用于治疗多发性硬化症和慢性B淋巴细胞白血病,并于2001年5月7日获得美国FDA批准,后续也已获得EMA及PMDA批准上市销售。由于严重的免疫抑制副作用,并且缺乏有效的临床效果数据支持,该药物在ALL中应用较少。目前正在开展代号为NCT02689453的临床项目,用以评估同重组人IL-15联用对R/R型急慢性成人T细胞淋巴瘤的疗效。
mTOR抑制剂类药物
靶向mTOR的抑制剂类药物主要作用机理为通过与FKBP-1结合形成复合体,从而抑制mTOR信号的传递,目前在研药物主要有Everolimus、Temsirolimus及Sirolimus。
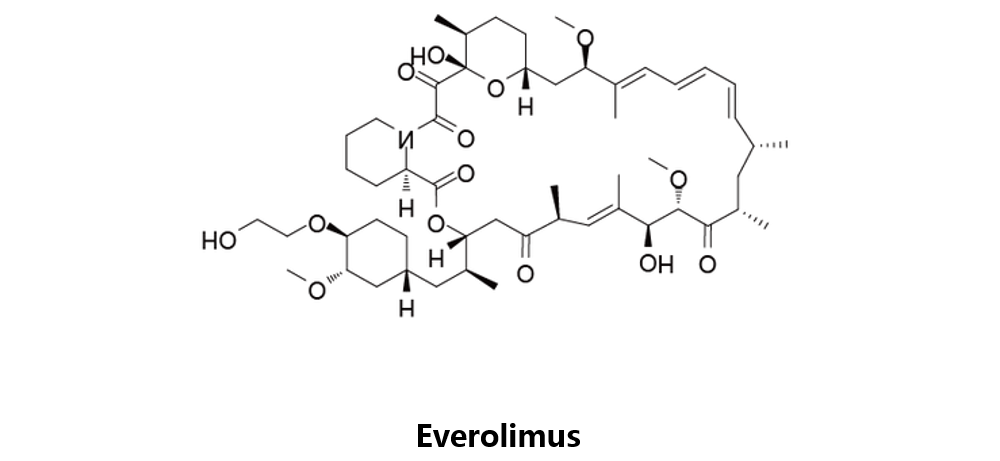
Everolimus
由诺华开发,于2009年3月30日获得美国FDA批准。依维莫司是普如动物雷帕霉素靶蛋白mTOR的抑制剂,用于治疗肾细胞癌,目前作为防止器官移植排斥反应的免疫抑制剂用。来自意大利的一项研究表明,Everolimus同Akt抑制剂MK-2206间存在协同效应,目前临床试验的重点在评估该药物对化学治疗药物产生抗性的ALL患者的疗效。
Temsirolimus
辉瑞原研,于2007年5月30日通过美国FDA的上市审批,并以商品名Torisel上市销售。替西罗莫司是mTOR受体特异性抑制剂,它能干扰肿瘤细胞内调控增殖、生长以及存活相关蛋白的生成。虽然替西罗莫司自身具有活性,但在体内也可能被转换成雷帕霉素。因此,它的活性更多的倾向于是调控代谢而不是作为前体药物。该药物适用于晚期肾细胞癌和套细胞淋巴瘤。针对该药物在ALL领域的三项临床研究正在开展中,分别是NCT00084916,NCT01403415及NCT01614197。
Sirolimus
辉瑞原研,于1999年9月15日获得美国FDA批准上市,商品名为Rapamune。西罗莫司抑制抗原和细胞因子所引起的T细胞活化、增殖和B细胞活化及其导致的抗体产生。该药物获批适应症为预防在13岁以上接受肾脏移植患者中出现的器官排异。目前该药物在ALL患者应用中的一期临床项目(NCT00874562)正在进行中。
蛋白酶体抑制剂类药物
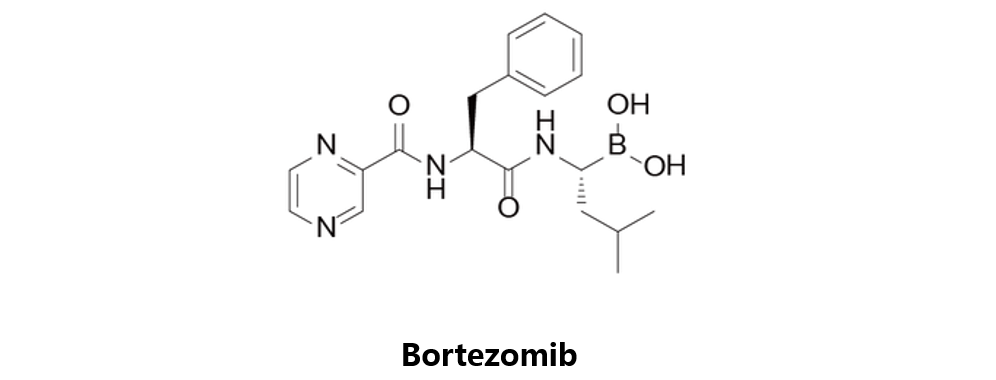
Bortezomib
硼替佐米由Millennium开发,于2003年5月13日获得美国FDA批准,商品名为Velcade。该药物是可逆的26S蛋白酶体抑制剂,适应症为多发性骨髓瘤和已接受至少一种优先疗法的套细胞淋巴瘤。在临床前研究中,Bortezomib单一药物对ALL疗效不显著,但同Dexamethasone、Asparaginase、Vincristine、Doxorubicin及Cytarabine等药物联用时存在协同效应。在名为TACL的二期临床研究中,Bortezomib的整体响应率为73%;另外还有多项该药物同化疗药物联合应用的二期临床研究正在进行中。
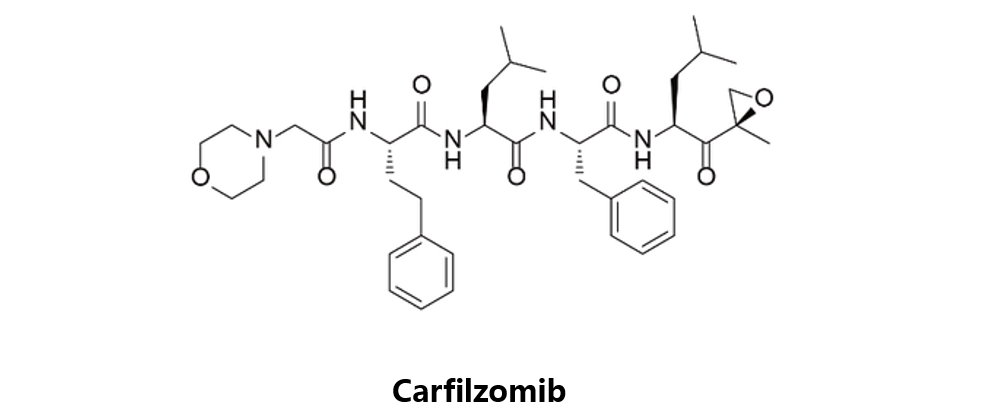
Carfilzomib
Onyx原研,于2012年7月20日获得FDA批准上市,后该公司被安进收购,商品名为Kyprolis。卡非佐米是四肽环氧酮类蛋白酶体抑制剂,该药适用于此前接受过至少两个优先疗法证实疾病尚在发展或最近一次治疗完成的60天内的患者的多发性骨髓瘤的治疗。相比于Bortezomib,Carfilzomib具有更强的蛋白酶体抑制活力,更少的脱靶效应。代号为NCT01137747的一项临床试验对Carfilzomib治疗AML或ALL的效果做了对比,但结果至今尚未公开。其他两项一期临床试验,NCT02293109及NCT01303821正在开展中,分别研究Carfilzomib同hyper-CVAD联用的最大耐受剂量及在复发性ALL患者中的安全性及耐受性。
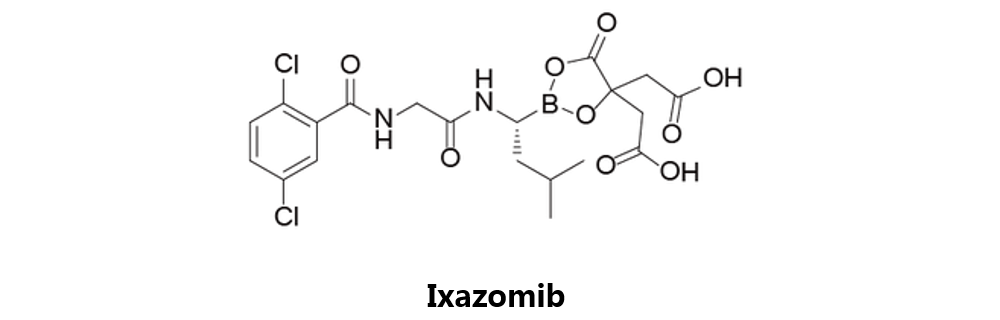
Ixazomib
由武田旗下的千年制药研发,于2015年11月20日获得美国FDA批准上市,商品名为Ninlaro。2011年因其治疗多发性骨髓瘤而获得美国FDA和欧盟EMA的孤儿药资格。该药物是一种蛋白酶体抑制剂,通过抑制多发性骨髓瘤细胞的酶活性从而阻止癌细胞的生长和存活来发挥作用。作为多发性骨髓瘤的二线用药,该药需要联合来那度胺和地塞米松治疗多发性骨髓瘤。目前该药正在开展一期临床试验,用以评估其与化疗药物联用对ALL的治疗效果(NCT02228772)。
表观遗传学靶点-HDAC抑制剂类药物:
组蛋白去乙酰化酶(histone deacetylase,HDAC)是一类蛋白酶,对染色体的结构修饰和基因表达调控发挥着重要的作用。组蛋白去乙酰化酶通过组蛋白的去乙酰化(去除乙酰基),使DNA更紧地缠绕在组蛋白上,从而导致这些DNA不易被基因转录因子接触。结果导致与细胞分化、细胞周期阻滞、肿瘤免疫、受损细胞凋亡等有关的蛋白的表达受到抑制,这些因素都会促使癌症的发展。组蛋白去乙酰化酶抑制剂能有选择性地恢复这些癌症抑制因子和其它抗癌基因的表达。组蛋白去乙酰化酶抑制剂还可以间接地抑制血管生成因子的表达,帮助阻断对肿瘤的血液供应。
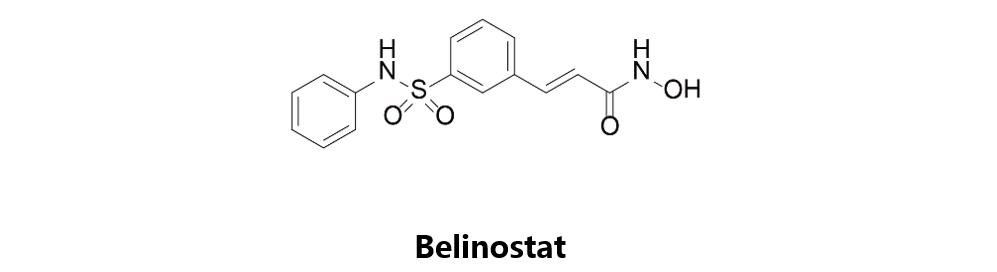
Belinostat
CuraGen Pharmaceutical原研,于2014年7月3日获得美国FDA批准,由Spectrum在美国上市销售,商品名为Beleodaq。Belinostat是一种组蛋白去乙酰化酶抑制剂,选择性的引起乙酰化的组蛋白和其它蛋白质在肿瘤细胞中累积,适用于治疗复发性或难治性的外周T细胞淋巴瘤(PTCL)。该药物与Bortezomib曾联合用药开展对多种肿瘤类型的治疗效果评估(NCT00348985),但研究结果尚未公开。
Vorinostat
默沙东原研,于2006年10月6日获得美国FDA批准上市,后于2011年7月1日获得PMDA批准,商品名为Zolinza。伏立诺他是一种组蛋白去乙酰化酶(HDAC)抑制剂,通过抑制HDAC活性有助于减缓或终止肿瘤细胞生长基因的激活。该药适用于有进展性,持久性或复发性皮肤T-细胞淋巴瘤(CTCL)患者的治疗。该药物曾开展与Decitabine及化疗联合使用治疗复发性ALL的二期临床试验(NCT01483690),由于毒性因素该项目被终止。
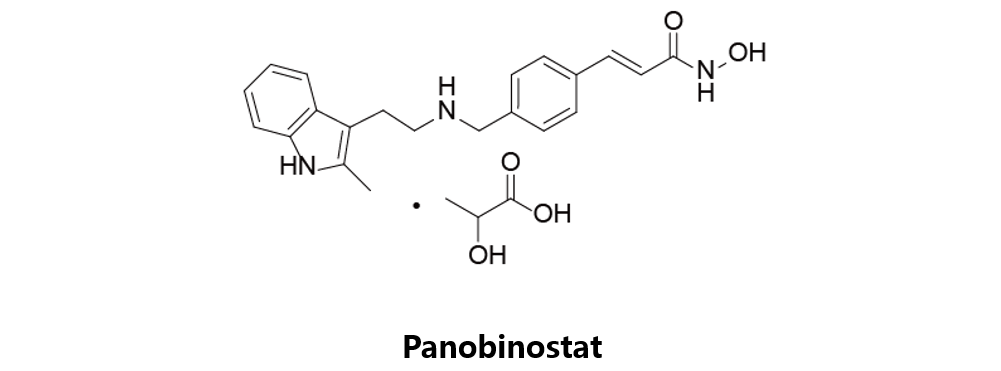
Panobinostat
诺华原研,于2015年2月23日获得美国FDA批准上市,并在同年获得EMA及PMDA批准,商品名为Farydak。Panobinostat是一种组蛋白去乙酰化酶抑制剂,能够在nM水平上抑制HDACs活性。它是首个用于治疗多发性骨髓瘤的HDAC抑制剂,与硼替佐米和地塞米松联合使用,用于治疗至少接受过两次疗法的多发性骨髓瘤。该药物目前在同Bortezomib,liposomal vincristine联用开展一项二期临床研究(NCT02518750),用于儿童及成人中复发性T细胞ALL的抢救性治疗。
BTK抑制剂类药物
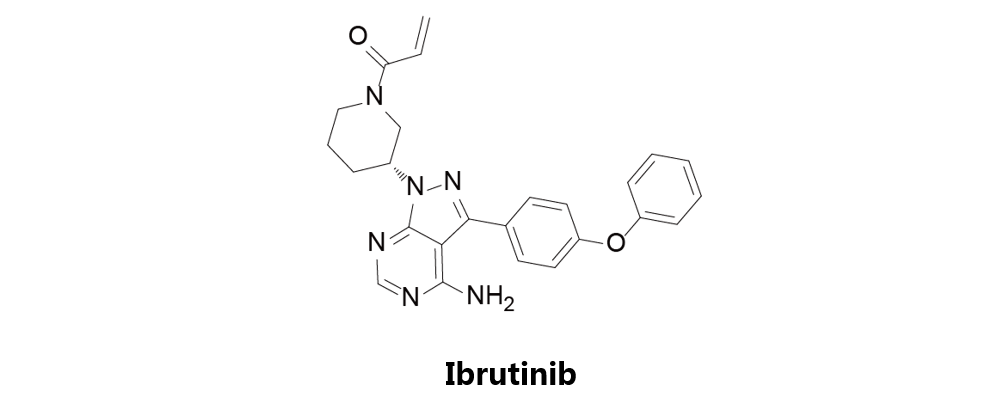
Ibrutinib
由Pharmacyclics和强生研发,于2013年11月13日获得美国FDA批准上市,商品名为Imbruvica。依鲁替尼是第一种BTK抑制剂,可以与BTK活性位点中的半胱氨酸残基形成共价键,从而抑制其活性。该药获批适应症为曾接受至少一次既往治疗的套细胞淋巴瘤(MCL)及曾接受至少一次既往治疗的慢性淋巴细胞性白血病(CLL)。Ibrutinib曾开展一项而期临床试验(NCT02129062)用以评估其对于R/R型B细胞ALL的疗效,但该研究于2016年被终止。目前Ibrutinib与Blinatumomab联用开展了一项针对成年R/R B细胞型ALL患者的二期临床研究(NCT02997761)。
RTK抑制剂类药物
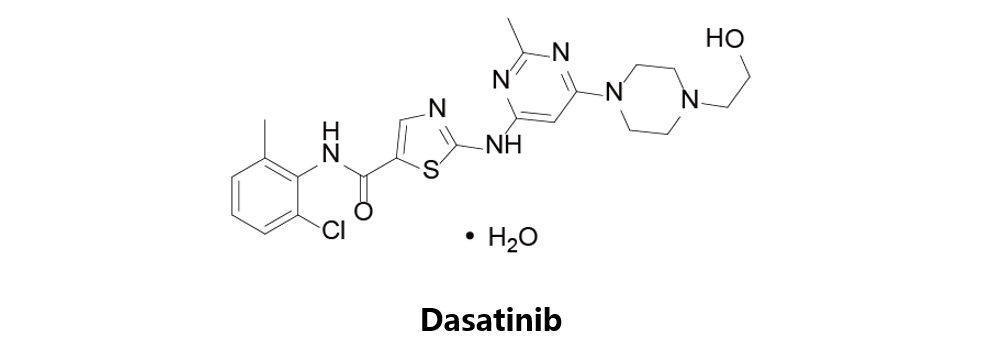
Dasatinib
由美国百时美施贵宝公司原研,于2006年6月28日获得美国FDA批准上市,商品名为Sprycel。达沙替尼是一种多靶点的受体酪氨酸激酶抑制,用于治疗慢性骨髓细胞性白血病和急性淋巴细胞白血病(ALL)。
Bcl-2抑制剂类药物
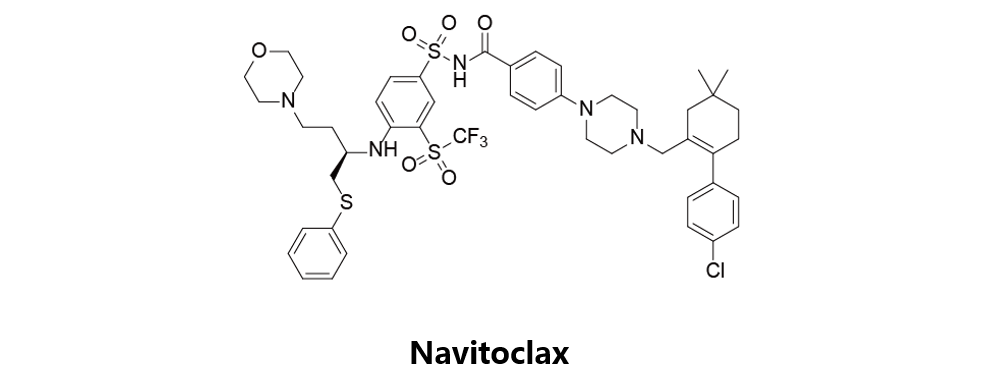
Navitoclax
又名ABT-263,由艾伯维原研,曾进入临床二期用于治疗前列腺癌、慢性淋巴细胞白血病和淋巴瘤,但目前该项研究已终止。该药物也曾针对不同类型的ALL开展相关研究,但剂量限制性血小板减少的副作用使得其研发之路困难重重。
Venetoclax
又名ABT-199,艾伯维公司原研,于2016年4月11日获得美国FDA批准,并于同年12月5日获得EMA批准,商品名为Venclexta。该药物是一种Bcl-2蛋白抑制剂,用于治疗带有17p基因缺失突变且曾接受过至少一种治疗的慢性淋巴细胞性白血病患者。该药物在ALL中的疗效尚未开展相关研究。
JAK-STAT抑制剂类药物
JAK-STAT信号通路是一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程,也是药物研发的热门靶点,参见《Janus激酶(JAK)抑制剂类药物研发现状》。
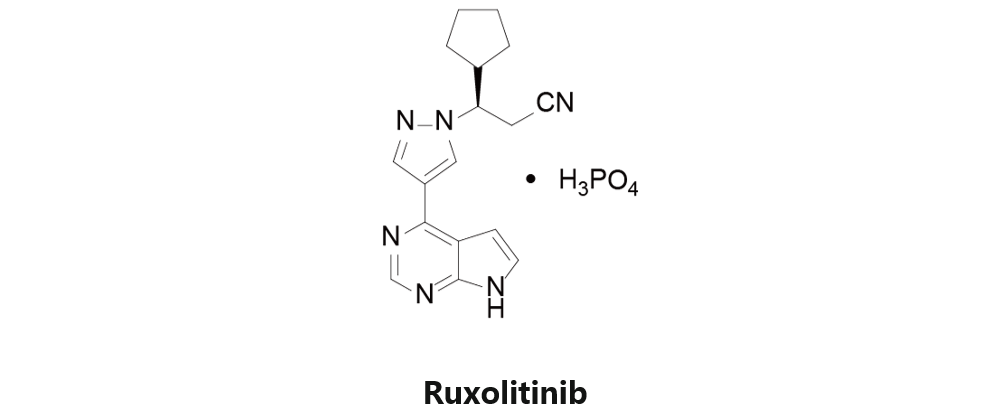
Ruxolitinib
由Incyte和诺华联合开发,于2011年11月16日获得美国FDA批准上市,商品名为Jakafi。Ruxolitinib是一种JAK1/2抑制剂,适用于中等或高位骨髓纤维化的治疗,包括原发性骨髓纤维化、真性红细胞增多症骨髓纤维化和原发性血小板增多症骨髓纤维化患者。肿瘤异体移植模型中,Ruxolitinib可降低白血病症状。目前该药物针对ALL患者的各项临床试验多集中于评估其与各类化疗手段联用的治疗效果,包括NCT02723994、NCT02494882和NCT02420717等项目。
PD-1抑制剂类药物:
Nivolumab
由小野制药和百时美施贵宝联合研发,于2014年12月22日获得美国FD批准,商品名为Opdivo。Nivolumab是一种全人源单克隆抗体,作为程序性死亡受体PD-1的阻断剂,能够结合PD-1并解除PD-1通路对T细胞的抑制作用。该药物批准的适应症包括黑色素瘤、肾细胞癌、鳞状细胞非小细胞肺癌、经典型霍奇金淋巴瘤等。该单抗药物针对ALL的效果尚不清楚,两项一期临床研究,NCT02819804及NCT0287995正在进行中,分别用以研究同其他药物联用时对R/R Ph+ ALL患者及R/R CD19+前体B细胞ALL患者的治疗效果。
PARP抑制剂类药物
PARP (poly ADP-ribose polymerase)是DNA修复酶,是细胞凋亡核心成员胱天蛋白酶(caspase)的切割底物。PARP抑制剂通过抑制肿瘤细胞DNA损伤修复、促进肿瘤细胞发生凋亡,从而可增强放疗以及烷化剂和铂类药物化疗的疗效。
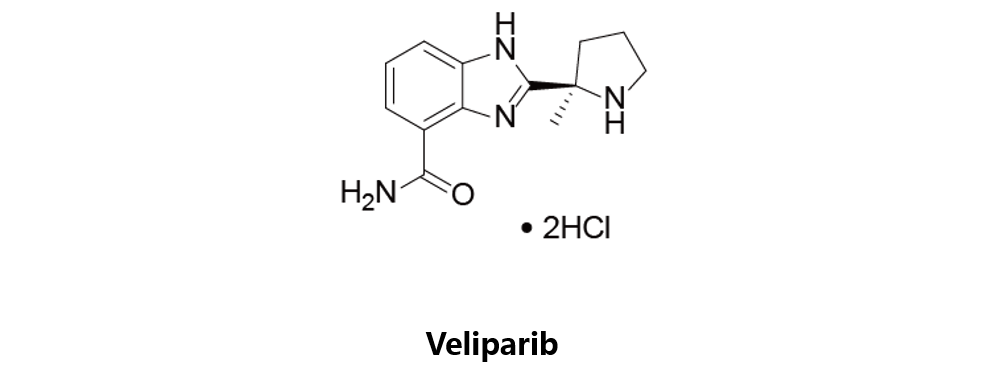
Veliparib
艾伯维原研,PARP抑制剂,目前处于临床三期阶段,与卡铂联用治疗BRCA缺陷型乳腺癌,或与卡铂或紫杉醇联用治疗非小细胞肺癌。在代号为NCT01139970的一期临床试验中,Veliparib同Temozolomide联用以评估对多种亚型ALL患者的疗效;而另外两项研究NCT00588991与NCT01326702则用于评估在联合用药时,对R/R 型ALL患者的疗效。
FLT3抑制剂类药物
长久以来,人们一直认为FLT3是白血病的重要靶点之一,以内该受体在绝大多数淋巴母细胞中是过表达的,并且在某些特定类型的淋巴癌中突变率很高。然而迄今为止,尚未有治疗白血病的FLT3抑制剂类药物面世。
Midostaurin
诺华制药原研,于2016年11月在美国申报新药上市申请,用于治疗恶性黑色素瘤。米哚妥林于2009年获得FDA治疗急性骨髓性白血病AML的孤儿药资格。该药同时处在治疗急性淋巴细胞性白血病ALL的临床二期研究阶段。其中代号为NCT00866281的研究因为药效不佳而被终止。
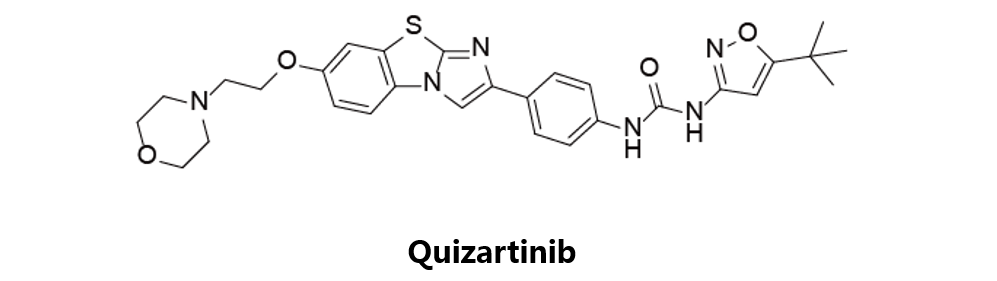
Quizartinib
第一三共原研,目前处于临床三期阶段,用于治疗急性骨髓性白血病(AML)。2009年,该化合物因治疗AML分别获得FDA及EMA授予孤儿药资格。目前在研临床项目为NCT01411267,用以探索该药物对R/R儿童ALL或AML的疗效。
Lestaurtinib
由Kyowa Hakko Kirin开发,后在美国授权给Cephalon。目前lestaurtinib正在进行治疗急性淋巴细胞性白血病(ALL)的临床三期试验和急性骨髓性白血病(AML)的临床二期研究。该药物也曾进行过多发性骨髓瘤、前列腺癌和斑块状银屑病的而期临床研究,但目前这些研究已经终止。
注:本文所涉及抗体类药物的示意图来源于药渡数据库。
参考文献
1. Man, L.M., Morris, A.L. & Keng, M. Curr Hematol Malig Rep (2017) 12: 197. doi:10.1007/s11899-017-0380-3
2. https://en.wikipedia.org/wiki/Acute_lymphoblastic_leukemia
3. https://www.cancer.gov/types/leukemia/hp/adult-all-treatment-pdq
来源:药渡(微信号 Pharmacodia)
为你推荐
 资讯
资讯 悦唯医疗完成近亿元A++轮投资,加速重症冠心病诊疗全流程创新器械研发与国产替代
此次融资将主要用于深化冠心病诊疗全流程创新器械和脉动式左心室辅助系统等新产品的研发,以及加速已获准上市的心脏稳定器等产品的市场推广。
2025-04-03 09:28
 资讯
资讯 海尔盈康一生启动孤独症儿童关爱行动,创新罕见病可持续公益新生态
本次活动聚焦孤独症儿童的诊疗,探讨交流AI赋能全流程防治康体系创新、前沿性生物科技诊疗技术等话题,旨在通过生态联盟的力量推动医学研究、科技创新与人文关怀的融合,让“星...
2025-04-03 09:11
 资讯
资讯 《NPJ digital medicine》刊发李冬梅教授团队成果:AI赋能高效识别眼睑肿物
亚太眼整形外科学会主席、中华医学会眼科分会眼整形眼眶病学组副组长李冬梅教授团队携手爱尔数字眼科研究所,在《NPJ digital medicine》(影响因子:12 4)学术期刊发表团队...
文/李林 2025-04-02 10:27
 资讯
资讯 默克全球执行副总裁周虹:合作与创新是默克未来五年战略的两大关键词
近日,德国默克医药健康全球执行副总裁、中国及国际市场负责人周虹带领医药健康中国及国际市场管理团队开启了2025年度首次“中国行”。
2025-04-01 17:11
 资讯
资讯 首个且唯一,阿斯利康PD-L1单抗获FDA批准治疗肌层浸润性膀胱癌
度伐利尤单抗联合吉西他滨和顺铂作为新辅助治疗,随后度伐利尤单抗作为根治性膀胱切除术后的辅助单药治疗,用于治疗肌层浸润性膀胱癌成年患者。
2025-04-01 14:37
 资讯
资讯 全国首个,湖北为脑机接口医疗服务定价
昨日(3月31日),据“湖北发布”消息,湖北省医保局发布全国首个脑机接口医疗服务价格,其中,侵入式脑机接口置入费6552元 次,侵入式脑机接口取出费3139元 次,非侵入式脑机...
2025-04-01 11:03
 资讯
资讯 一款国产创新流感药,获批
近日,据国家药监局官网信息显示,青峰医药下属子公司江西科睿药自主研发的1类创新药玛舒拉沙韦片(商品名:伊速达)正式获批上市,用于既往健康的12岁及以上青少年和成人单纯性...
2025-04-01 10:22
 资讯
资讯 26省联盟药品集采启动,聚焦妇科用药和造影剂
近日,山西省药械集中招标采购中心发布《关于做好二十六省联盟药品集中带量采购品种数据填报工作的通知》,开展相关采购数据填报工作。
2025-03-31 21:48
 资讯
资讯 优时比罗泽利昔珠单抗注射液(优迪革)中国获批,全球首个且唯一双亚型创新药治疗全身型重症肌无力
作为唯一人源化、高亲和力且具备创新修饰结构的IgG4单抗,关键Ⅲ期MycarinG试验证实罗泽利昔珠单抗注射液(优迪革®)较安慰剂显著改善全身型重症肌无力患者的多个临床终点与结局。
2025-03-31 15:58
 资讯
资讯 从手术麻醉到生命全周期护航,麻醉学科发展拓宽生命边界
3月26日,由中华医学会麻醉学分会、中国医师协会麻醉学医师分会等23家学协会共同举办的2025年中国麻醉周学术活动的启动仪式举办,该活动以“生命之重,大医精诚——守生命保驾护...
2025-03-31 15:30
 资讯
资讯 欧狄沃联合逸沃成为中国目前唯一获批的肝细胞癌一线双免疫联合疗法
欧狄沃联合逸沃对比仑伐替尼或索拉非尼,可显著改善不可切除肝细胞癌一线患者的总生存期(OS),客观缓解率(ORR)可改善近3倍,中位缓解持续时间(mDOR)达30个月
2025-03-31 13:45
 资讯
资讯 罗氏制药榜首 “现金牛” 产品罗可适(奥瑞利珠单抗)在华获批:开启多发性硬化症一年两次治疗新时代
罗氏制药今日(3月31日)宣布,其旗下创新药罗可适®(Ocrevus®,通用名:奥瑞利珠单抗注射液 ocrelizumab injection)正式获得中国国家药品监督管理局批准,每六个月静脉输...
2025-03-31 13:39
 资讯
资讯 三生有幸,医者仁心:三生制药向全体医药工作者致敬!
3月30日是国际医师节,由三生制药公益支持的以“三生有幸,医者仁心”为主题的公益活动,携手20位医生代表,以寄语海报的形式,共同向全体医护人员表达诚挚的祝福与关爱。
2025-03-30 17:38