总局办公厅关于印发食品药品监管总局2017年政务公开工作实施方案的通知
食药监办〔2017〕65号
总局机关各司局、各直属单位:
现将《食品药品监管总局2017年政务公开工作实施方案》印发给你们,请结合工作实际,认真抓好贯彻落实。
食品药品监管总局办公厅
2017年5月6日
附 食品药品监管总局2017年政务公开工作实施方案
为全面贯彻党的十八届三中、四中、五中、六中全会精神和中共中央办公厅、国务院办公厅《关于全面推进政务公开工作的意见》及其实施细则要求,坚持稳中求进工作总基调,全面推进食品药品监管工作决策、执行、管理、服务、结果公开(以下统称“五公开”),按照《国务院办公厅关于印发2017年政务公开工作要点的通知》(国办发〔2017〕24号)要求,制订本方案。
一、推进“放管服”改革信息公开
以清单管理推动简政放权,及时公开总局权力清单、行政审批事项清单和中央指定地方实施行政许可事项汇总清单。(法制司负责,已完成)完成总局成立以来规范性文件清理工作并向社会公开。(法制司牵头,相关司局配合)
二、加大食品药品监管信息公开力度
(一)做好行政处罚信息公开。公开食品药品安全违法行为处罚信息,进一步规范食品药品行政处罚决定文书制作,加强对全系统行政处罚信息公开工作的指导和考核,督促各地依法开展行政处罚信息公开。(稽查局负责)
(二)做好“四品一械”抽检信息公开。完善食品抽检信息工作制度,指导地方加强食品抽检信息公布工作,定期公布全国食品抽检总体情况、发现的主要问题和不合格食品核查处置情况。(食监三司负责)建设新媒体发布平台,强化食品安全定期常态性抽检信息公开机制,增强公众获取抽检结果、了解食品知识的便利度。(食监三司、新闻宣传司分别负责)定期公布国家药品、医疗器械、化妆品产品监督抽检信息,主动公开药品、医疗器械、化妆品产品抽检质量公告。(药化监管司、器械监管司分别负责)
(三)做好药品医疗器械审评审批信息公开。做好药品上市审批信息公开,每月发布批准上市药品公告信息。(药化注册司负责)按月发布批准注册医疗器械产品公告。按照国务院标准化行政主管部门的相关规定,做好医疗器械国家标准和行业标准的公开工作。(器械注册司负责)
(四)做好药品医疗器械监督检查信息公开。做好2017年国家药品检查计划和2017年境外检查的信息公开工作,做好药品生产企业和经营企业飞行检查信息公开工作,及时公开检查结果,指导督促地方公布召回产品、停产整顿、收回或撤销证书等情况。(药化监管司负责)做好医药代表登记备案信息公开工作,积极研究制订医药代表登记备案管理办法,督促相关单位及时公开医药代表相关信息,便于社会查询和监督。(药化监管司负责)做好医疗器械生产企业和经营企业飞行检查信息公开工作,在总局网站设置专栏公开现场检查情况、企业停产处理情况和检查组成员等信息。继续做好相关生产企业不合格医疗器械产品召回信息公开工作。(器械监管司负责)
三、全面落实“五公开”工作机制
(一)将“五公开”要求落实到公文办理程序。总局各司局拟制公文时,要明确主动公开、依申请公开、不予公开等属性,随公文一并报批,拟不公开的,要依法依规说明理由。对拟不公开的政策性文件,报批前应先送总局政务公开工作机构审查。起草政府政策性文件代拟稿时,应对公开属性提出明确建议并说明理由;以总局或国务院食品安全办名义上报的发文请示件没有明确公开属性建议的,或者没有依法依规说明不公开理由的,总局办公厅按规定予以退文。(办公厅牵头,各司局具体落实)
(二)将“五公开”要求落实到会议办理程序。提请总局局务会、局长办公会议审议的重大法律规章和重要政策措施,除依法应当保密的外,决策前应向社会公开征求意见,有关意见和采纳情况一并提请会议审议。将公开作为制定会议方案的重要内容,提前安排谋划新闻报道和信息公开方式,需要公开相关信息的,在会后及时向社会公开。重要行政决策如存在重大分歧,可以根据工作需要,召开专家公开论证会,或邀请利益相关方与会。(各司局负责落实,办公厅审核)
(三)建立健全主动公开目录和公开内容动态扩展机制。坚持以公开为常态、不公开为例外,推进主动公开目录体系建设,在全面梳理总局应公开内容基础上,制定主动公开基本目录,并实时更新、动态管理。对涉及公众利益、需要社会广泛知晓的电视电话会议,除涉及国家秘密的外,会议召集部门应提前与新闻宣传司沟通,由新闻宣传司根据需要及时通过网络媒体、新媒体等向社会公开。(新闻宣传司牵头,各司局配合)
(四)做好建议提案办理结果公开工作。进一步做好全国人大代表建议和全国政协委员提案办理结果公开工作,对涉及公共利益、社会广泛关注的建议提案,原则上应公开答复全文,及时回应关切,接受群众监督。(办公厅牵头,各司局配合)
四、进一步健全解读回应机制
切实落实《关于全面推进政务公开工作的意见》及其实施细则关于做好政策解读回应的相关规定。建立健全政务舆情监测、会商、分析、回应、评估机制,对收集到的舆情加强研判,区别不同情况,进行分类处理。充分利用新闻发布会、政策吹风会等方式,主动回应重大舆论关切,释放信号,引导预期。按照“谁起草、谁解读”的原则,做到政策性文件与解读方案、解读材料同步组织、同步审签、同步部署。严格执行特别重大、重大突发事件最迟5小时内发布权威信息、24小时内举行新闻发布会的时限要求,落实通报批评和约谈制度,确保回应不超时、内容不敷衍。(新闻宣传司牵头,各司局配合)
五、加强政务公开平台建设
进一步加强和改进政府网站内容建设,做好监测和评估工作。要用好管好政务新媒体,明确开办主体责任,健全内容发布审核机制,强化互动和服务功能,切实解决更新慢、“雷人雷语”、无序发声、敷衍了事等问题。入驻国务院客户端。(新闻宣传司牵头,各司局配合)
六、依法规范依申请公开工作
畅通依申请公开受理渠道,依法保障公众信息需求。进一步规范依申请公开答复工作,严格按照法定时限答复,增强答复内容针对性并明示救济渠道,答复形式要严谨规范。对依申请公开工作中发现的依法行政方面问题,要及时向相关单位提出工作建议。对公众申请较为集中的政府信息,可以转为主动公开的,应当主动公开。(办公厅牵头,各司局具体落实)
七、加强组织保障
加强督查评估,将政务公开纳入对地方的食品药品安全工作考核体系,所占分值权重不低于4%。(办公厅牵头,相关司局配合)
医谷链
《来真的,各部门完成深化医药卫生体制改革2017年重点工作任务时间截点出来了》
来源:CFDA
为你推荐
 资讯
资讯 四同药品价格治理已基本实现,正建设全国挂网药品价格一览表
目前,我们正在建设全国挂网药品价格一览表,全量汇总展示各地挂网价格信息并对首涨、高涨幅等异常价格行为予以标识,敦促各地持续纠正不合理的挂网高价。
2025-01-18 12:15
 资讯
资讯 2025年全国80%左右医保统筹地区基本实现即时结算,2026年底全部实现即时结算
1月16日,国家医疗保障局办公室正式对外发布《关于推进基本医保基金即时结算改革的通知》。根据通知,以全国统一的医保信息平台为支撑,2025年全国80%左右统筹地区基本实现即时...
2025-01-18 11:20
 资讯
资讯 2024年底,60岁及以上人口3.1亿,占全国人口的22.0%
年末全国人口(包括31个省、自治区、直辖市和现役军人的人口,不包括居住在31个省、自治区、直辖市的港澳台居民和外籍人员)140828万人,比上年末减少139万人。全年出生人口954...
2025-01-17 14:56
 资讯
资讯 赛诺菲荣膺“杰出雇主2025”桂冠,连续五年傲立榜首
作为10多年来首个且唯一连续五年荣获此殊荣的企业,赛诺菲再次彰显了其在企业文化、人才战略、多元发展及员工培养等方面的卓越成就。
2025-01-17 11:02
 资讯
资讯 又一款国产三代EGFR-TKI抑制剂获批上市
昨日(1月16日),据国家药监局官网显示,奥赛康药业的1类创新药利厄替尼片(limertinib ASK120067,商品名:奥壹新)获批上市,用于治疗既往接受表皮生长因子受体酪氨酸激酶抑制...
2025-01-17 10:31
 资讯
资讯 增辉生命,默沙东中国再度荣膺“中国杰出雇主”
1月16日,由全球权威的杰出雇主调研机构(Top Employers Institute)颁布的“杰出雇主2025”榜单正式揭晓
2025-01-16 22:48
 资讯
资讯 国家市场监督管理总局发布《医药企业防范商业贿赂风险合规指引》
本指引所称的商业贿赂, 是指采用财物或者其他手段贿赂交易相对方的工作人员、 受交易相对方委托办理相关事务的单位或者个人、 利用职权或者影响力影响交易的单位或者个人,...
2025-01-14 23:38
 资讯
资讯 阿斯利康与宜联生物达成临床研究合作,共同探索联合治疗创新方案
双方将共同启动一项多中心、开放性、I Ib期研究,旨在评估两款药物联合治疗在实体肿瘤患者中的安全性、有效性和药代动力学。
2025-01-14 18:36
 资讯
资讯 NVIDIA与多家行业顶尖机构达成深度合作,共促医疗健康产业蓬勃发展
在日前举办的摩根大通医疗健康大会上,NVIDIA 宣布与多家行业领先机构达成合作,这类新的合作旨在通过加速药物发现、提升基因组研究,以及利用代理式和生成式 AI 开创先进医...
2025-01-14 13:26
 资讯
资讯 老牌上市药企终止PD-1项目,计提资产减值准备1.75亿元
近日,丽珠医药集团发布公告称,对公司及下属子公司截至2024年12月31日合并报表范围内存在减值迹象的资产进行了减值测试,并对其中存在减值迹象的资产相应计提了减值准备。
2025-01-14 10:13
 资讯
资讯 尊享e生2025升级:首次全场景放开外购药械,医院药品覆盖数量再增
1月13日,众安保险举办“与10光,共生长”尊享e生十周年产品升级发布会,正式发布尊享e生2025版,并推出众安健康险未来将主打的两大产品系列——面向健康人群的“尊享系列”,以...
2025-01-13 20:17
 资讯
资讯 PLA材料的医美应用:安全与效果的双重考验
聚乳酸PLA,作为医美行业面部填充剂历经了3个时代大约20多年的发展,大体可分为1 0、2 0、3 0三个不同的时代;即1 0-结晶片状;2 0-普遍表面粗糙的多孔微球或实心微球;3 ...
2025-01-13 19:53
 资讯
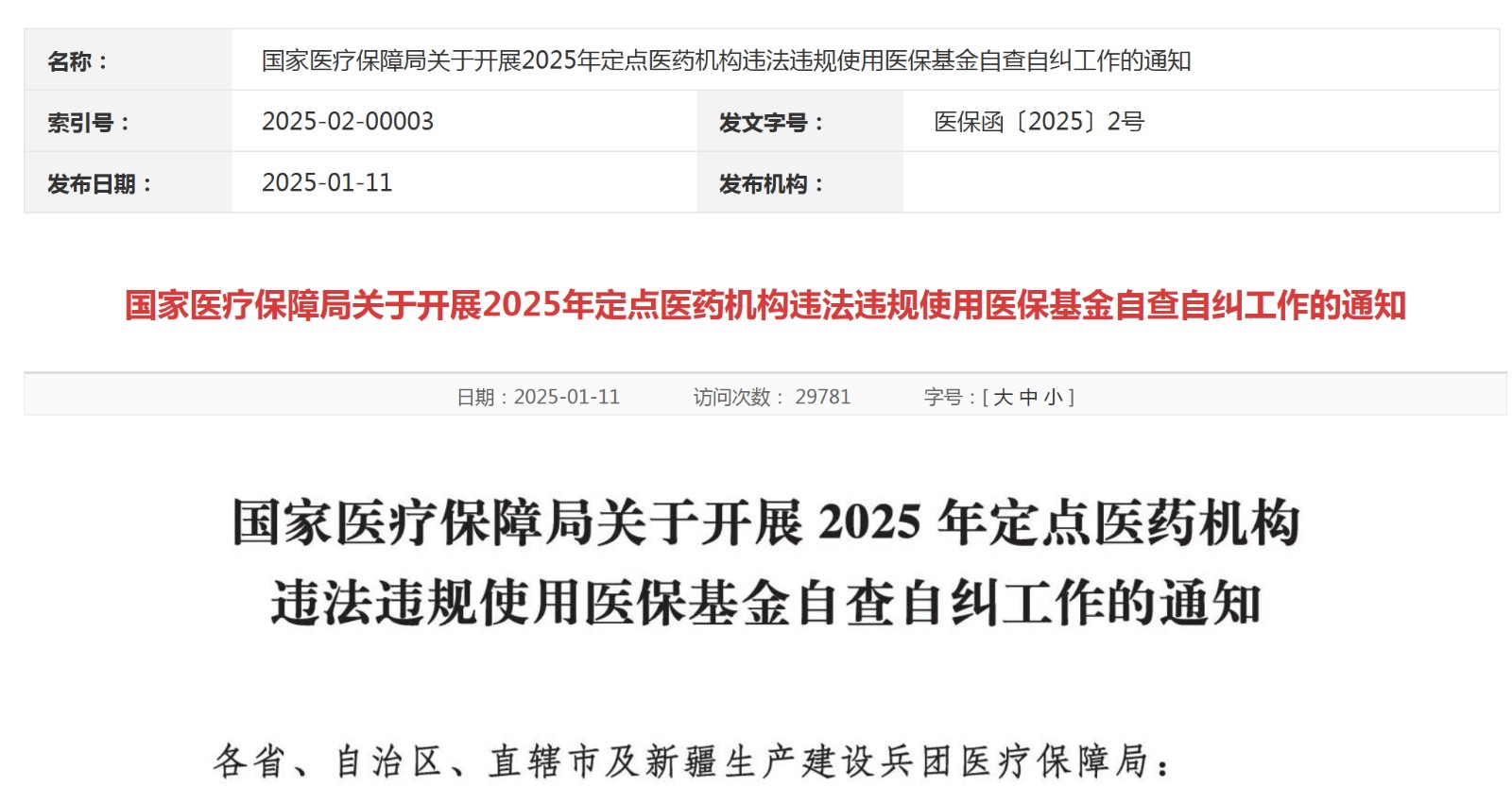
资讯 国家医保局:开展2025年定点医药机构违法违规使用医保基金自查自纠工作,肿瘤类、重症医学类、麻醉类、零售药店典型问题清单
2025年3月底前,各级医保部门根据本地化问题清单,对辖区内所有定点医疗机构和定点零售药店2023-2024年医保基金使用情况开展自查自纠。2025年4月起,国家医保局将对全国定点医药...
2025-01-13 17:32
 资讯
资讯 好大夫正式牵手蚂蚁集团,共同推进“AI+医疗”创新
蚂蚁集团收购好大夫在线尘埃落定。1月11日,在2025年好大夫峰会上,双方在收购完成后首度携手亮相。好大夫在线创始人王航现场表示,共同的使命和愿景让双方走到了一起,后续好大...
2025-01-11 18:05
 资讯
资讯 创新给药机制,全球首个口服GLP-1RA诺和忻(司美格鲁肽片)在中国全面上市
今日(1月11日),全球领先的生物制药公司诺和诺德宣布,全球首个口服胰高糖素样肽-1受体激动剂(GLP-1RA)——诺和忻®(司美格鲁肽片)在中国全面上市。诺和忻®以便利的口服...
2025-01-11 17:56