近日,美国FDA宣布批准MT Pharma America的新药Radicava(edaravone)上市,治疗肌萎缩性侧索硬化(Amyotrophic Lateral Sclerosis ,ALS),这是FDA22年来批准的首款ALS疗法。
ALS又称为卢伽雷氏症(Lou Cehrigs disease),1869年由让-马丁·沙可(Jean—Martin Charcot)首次确诊,它是一种不可逆的致死性运动神经元疾病。病变主要侵犯上运动神经元(大脑、脑干、脊髓),又影响到下运动神经元(颅神经核、脊髓前角细胞)及其支配的躯干、四肢和头面部肌肉的一种慢性进行性罕见疾病,世界著名的物理学家史蒂芬霍金就身患该种病。
据美国疾病控制和预防中心估计,在美国大约有12000-15000名ALS患者,他们由于神经细胞受损或死亡,导致无法控制特定的肌肉—随意肌(该肌肉可以随意志而产生运动,比如咀嚼、走路、呼吸和谈话),导致该肌肉变得软弱,最终使得患者瘫痪。由于这种疾病的渐进性特性,患者的症状会不断恶化,大部分患者会在症状首次出现的3-5年内由于呼吸衰竭而死亡。
2014年7月29日,一项名为“冰桶挑战”的活动风靡全球,该活动旨在能有更多的人关注ALS,为患该病的患者带去更多的疗法和希望,在短短不到一个月的时间内,“冰桶挑战”为美国肌萎缩性脊髓侧索硬化症协会筹得捐款1330万美元。
据了解,氧化应激是ALS发作和进展的很可能的因素,而Radicava是一种自由基清除剂,可以减轻氧化应激效应,Radicava于2015年在日本和韩国获批上市治疗ALS,FDA药物评价与研究中心神经学产品部副主任Eric Bastings表示:在听说Radicava在日本上市后,FDA快速与药物开发商接洽,讨论递交美国上市申请事宜,这是多年来美国FDA首个批准治疗ALS的新疗法,我们很高兴能让ALS患者多一种选择。此前,Radicava曾获得美国FDA颁发的孤儿药资格。
FDA此次批准Radicava上市是基于在日本进行的为期6个月的临床试验,在此次试验中,137例患者随机分别接受Radicava和安慰剂治疗,在研究的第24周,与对照组相比,接受Radicava治疗的患者日常功能的临床评估指标下降程度低于安慰剂组受试者。
据悉,Radicava需要由医疗保健专业人士进行静脉注射。首个治疗周期为注射14天,观察14天(无治疗)。第二个周期为患者在之后的14天中接受10天的注射,然后再观察14天(不用药)。
另悉,荨麻疹、水肿和呼吸短促是Radicava可能引起的相关的严重不良反应,需要立即就医。另一个严重的不良事件为亚硫酸氢钠过敏反应,对亚硫酸盐敏感的人来说可导致危及生命的过敏性症状。亚硫酸氢钠是Radicava中的一种药物成分。
来源:医谷网
为你推荐
 资讯
资讯 悦唯医疗完成近亿元A++轮投资,加速重症冠心病诊疗全流程创新器械研发与国产替代
此次融资将主要用于深化冠心病诊疗全流程创新器械和脉动式左心室辅助系统等新产品的研发,以及加速已获准上市的心脏稳定器等产品的市场推广。
2025-04-03 09:28
 资讯
资讯 海尔盈康一生启动孤独症儿童关爱行动,创新罕见病可持续公益新生态
本次活动聚焦孤独症儿童的诊疗,探讨交流AI赋能全流程防治康体系创新、前沿性生物科技诊疗技术等话题,旨在通过生态联盟的力量推动医学研究、科技创新与人文关怀的融合,让“星...
2025-04-03 09:11
 资讯
资讯 《NPJ digital medicine》刊发李冬梅教授团队成果:AI赋能高效识别眼睑肿物
亚太眼整形外科学会主席、中华医学会眼科分会眼整形眼眶病学组副组长李冬梅教授团队携手爱尔数字眼科研究所,在《NPJ digital medicine》(影响因子:12 4)学术期刊发表团队...
文/李林 2025-04-02 10:27
 资讯
资讯 默克全球执行副总裁周虹:合作与创新是默克未来五年战略的两大关键词
近日,德国默克医药健康全球执行副总裁、中国及国际市场负责人周虹带领医药健康中国及国际市场管理团队开启了2025年度首次“中国行”。
2025-04-01 17:11
 资讯
资讯 首个且唯一,阿斯利康PD-L1单抗获FDA批准治疗肌层浸润性膀胱癌
度伐利尤单抗联合吉西他滨和顺铂作为新辅助治疗,随后度伐利尤单抗作为根治性膀胱切除术后的辅助单药治疗,用于治疗肌层浸润性膀胱癌成年患者。
2025-04-01 14:37
 资讯
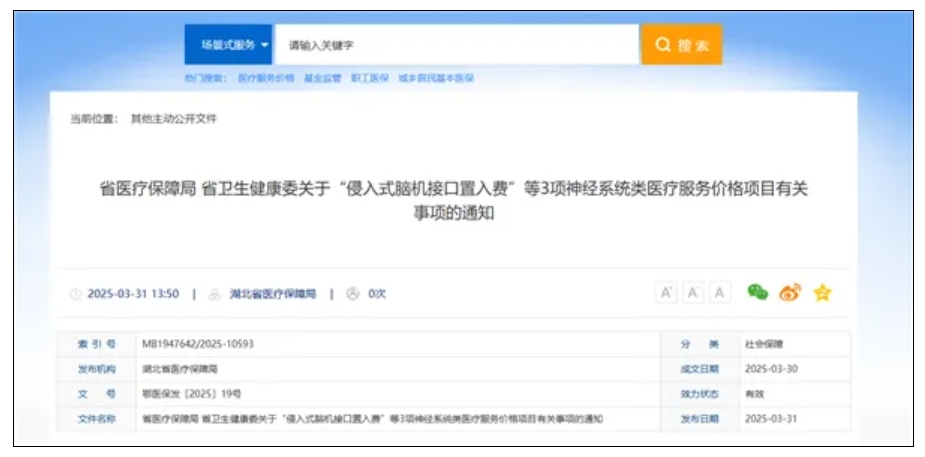
资讯 全国首个,湖北为脑机接口医疗服务定价
昨日(3月31日),据“湖北发布”消息,湖北省医保局发布全国首个脑机接口医疗服务价格,其中,侵入式脑机接口置入费6552元 次,侵入式脑机接口取出费3139元 次,非侵入式脑机...
2025-04-01 11:03
 资讯
资讯 一款国产创新流感药,获批
近日,据国家药监局官网信息显示,青峰医药下属子公司江西科睿药自主研发的1类创新药玛舒拉沙韦片(商品名:伊速达)正式获批上市,用于既往健康的12岁及以上青少年和成人单纯性...
2025-04-01 10:22
 资讯
资讯 26省联盟药品集采启动,聚焦妇科用药和造影剂
近日,山西省药械集中招标采购中心发布《关于做好二十六省联盟药品集中带量采购品种数据填报工作的通知》,开展相关采购数据填报工作。
2025-03-31 21:48
 资讯
资讯 优时比罗泽利昔珠单抗注射液(优迪革)中国获批,全球首个且唯一双亚型创新药治疗全身型重症肌无力
作为唯一人源化、高亲和力且具备创新修饰结构的IgG4单抗,关键Ⅲ期MycarinG试验证实罗泽利昔珠单抗注射液(优迪革®)较安慰剂显著改善全身型重症肌无力患者的多个临床终点与结局。
2025-03-31 15:58
 资讯
资讯 从手术麻醉到生命全周期护航,麻醉学科发展拓宽生命边界
3月26日,由中华医学会麻醉学分会、中国医师协会麻醉学医师分会等23家学协会共同举办的2025年中国麻醉周学术活动的启动仪式举办,该活动以“生命之重,大医精诚——守生命保驾护...
2025-03-31 15:30
 资讯
资讯 欧狄沃联合逸沃成为中国目前唯一获批的肝细胞癌一线双免疫联合疗法
欧狄沃联合逸沃对比仑伐替尼或索拉非尼,可显著改善不可切除肝细胞癌一线患者的总生存期(OS),客观缓解率(ORR)可改善近3倍,中位缓解持续时间(mDOR)达30个月
2025-03-31 13:45
 资讯
资讯 罗氏制药榜首 “现金牛” 产品罗可适(奥瑞利珠单抗)在华获批:开启多发性硬化症一年两次治疗新时代
罗氏制药今日(3月31日)宣布,其旗下创新药罗可适®(Ocrevus®,通用名:奥瑞利珠单抗注射液 ocrelizumab injection)正式获得中国国家药品监督管理局批准,每六个月静脉输...
2025-03-31 13:39
 资讯
资讯 三生有幸,医者仁心:三生制药向全体医药工作者致敬!
3月30日是国际医师节,由三生制药公益支持的以“三生有幸,医者仁心”为主题的公益活动,携手20位医生代表,以寄语海报的形式,共同向全体医护人员表达诚挚的祝福与关爱。
2025-03-30 17:38