前不久,癌症免疫治疗巨头百时美施贵宝(BMS)宣布,将与CytomX在2014年的12亿美元合作协议,扩大到38亿美元。根据协议,BMS将采用CytomX专有的Probody平台开发8种新靶向药物,包括6种肿瘤药物和2种非肿瘤药物。
除了BMS之外,CytomX的合作名单里还有AbbVie、Pfizer、MD Anderson癌症研究中心、ImmunoGen等机构。无一例外,它们都看上了CytomX的Probody平台。
它们的目的也很简单,就是想要找一种方法,让它们研发的抗癌药物只杀伤癌细胞,不伤害人体健康的组织,尽可能地降低药物对患者的伤害。其实早在100多年前,伟大的德国科学家、化疗的奠基人、1908年诺贝尔奖得主Paul Ehrlich教授就提出了「魔法子弹」假说,他认为应该可以找到只治病而不伤害健康组织的药物。正是Ehrlich教授的这一假说,激励着几代科学家孜孜以求地寻找「魔法子弹」(1)。
实际上,化疗药物也是遵循了Ehrlich教授的这个假说,但是由于它们的区分性并不是非常出色,所以对人体的副作用较大。时至今日,随着分子生物学和遗传学的发展,越来越多的肿瘤标志物被发现,这极大地推动了新型抗癌药物的研发。名字里透露着专一的「靶向治疗」和名字里透露着和谐友好的「免疫治疗」陆续出现,虽然它们的副作用已经远远低于化疗,但还是在一定程度上伤害着患者。
毕竟很多在肿瘤组织中存在或者高表达的抗原,会在至少一种其他组织或者器官中存在。这就给药物给药剂量带来了很大的限制(2)。如果针对单一或者几个肿瘤标志物研发的药物靶向性还不够的话,那么是否存在某种方法可以进一步提高这种靶向性呢?
“魔法子弹”示意图:红色代表肿瘤细胞(by王爽)
成立于2008年的CytomX将目光盯在了肿瘤微环境上。肿瘤微环境,指的就是肿瘤内部的小生态。由已经完全进入疯狂状态的癌细胞组成的肿瘤组织,与健康组织内部的环境肯定存在巨大的差异。这一点已经被科学家证实。例如,在肿瘤组织内有大量的蛋白水解酶存在,像尿激酶型纤溶酶原激活因子(urokinase-type plasminogen activator,uPA)(3)、膜型丝氨酸蛋白酶(membrane-type serine protease,MT-SP1)(4, 5)和半胱氨酸蛋白酶(legumain)(6)等等;而在健康的组织里,蛋白水解酶含量很低甚至没有(7)。
CytomX的创始人之一,加州大学圣巴巴拉分校的Patrick Daugherty教授在2012年巧妙地利用这一特点,给靶向特定蛋白的抗体药物加了个叫遮蔽肽的「口罩」(8)。这个「口罩」的巧妙机关在于,只有在肿瘤组织内那几种酶存在的情况下,抗体药物才可以脱掉这个「口罩」,然后攻击异常的组织。而在健康组织中,由于那几种酶不存在或者含量很少,这个「口罩」就拿不下来,药物就没办法起作用。有了这个「魔法口罩」的抗体药物,就具备了双保险,从理论上讲,使用起来必定是安全多了。
没过多久,CytomX的首席科学官Henry Lowman带领团队将Daugherty教授这一理念在抗癌药物里面变成现实。2013年,Lowman博士团队首先在已经获得FDA批准的、靶向表皮生长因子受体(EGFR)的抗癌药物Cetuximab上做了临床前研究,他们惊喜地发现,戴上「口罩」之后的Cetuximab与EGFR结合效率低,用合适浓度的蛋白水解酶摘掉Cetuximab的「口罩」之后,与EGFR的结合效率和正常Cetuximab无异。他们的这一研究成果刊登在着名期刊《科学转化医学》上(2)。
Probody示意图,Masking Peptide就是文中所指的“口罩”(图片来源:CytomX官网)
也正是从2013年开始,CytomX才走上了发迹之路。Pfizer率先开启了与CytomX的合作之路。之后各大药企纷纷寻求合作。
到2015年,CytomX宣称Probody平台能够与四种不同的肿瘤免疫治疗方法结合:免疫检查点抑制剂、抗体-药物偶联物(ADC)、T细胞结合的双特异性抗体(TCB)、CAR-NK细胞。Probody平台应用范围之广,令人惊叹不已。
Probody研发管线(图片来源:CytomX官网)
目前,CytomX自主开发的「戴口罩」的PD-L1抗体项目CX-072,已进入临床I期、II期研究,「戴口罩」的PD-1抗体正在申请开展临床研究。CytomX与BMS合作研发的「戴口罩」的CTLA-4抗体也已进入到新药临床试验申请阶段。这意味着,目前市面上已经被广泛证明有效的三个免疫检查点抑制剂药物,在CytomX都有了低毒版。如果一切顺利,患者对该类药物的依从性更好。
此外,在T细胞结合的双特异性抗体(TCB)前体药物方面,CytomX的临床前研究成果也值得称赞:在1mg/kg的剂量下,经过Probody技术改造的EFGR/CD3 TCB(Pb-TCB)表现出与传统的TCB(Ab-TCB)相当的抗肿瘤活性。并且Pb-TCB不会像Ab-TCB那样引发细胞因子风暴(免疫治疗的不良反应,严重情况下可危及生命)。
我们期待经过Probody改造的前体药物能够尽快完成临床试验,给肿瘤患者带来福音,给关注肿瘤免疫治疗的人们带来更多惊喜!
参考资料:
1.Strebhardt K, Ullrich A. 2008. Paul Ehrlich's magic bullet concept: 100 years of progress. Nat Rev Cancer 8: 473-80
2.Desnoyers LR, Vasiljeva O, Richardson JH, Yang A, Menendez EEM, Liang TW, Wong C, Bessette PH, Kamath K, Moore SJ, Sagert JG, Hostetter DR, Han F, Gee J, Flandez J, Markham K, Nguyen M, Krimm M, Wong KR, Liu S, Daugherty PS, West JW, Lowman HB. 2013. Tumor-Specific Activation of an EGFR-Targeting Probody Enhances Therapeutic Index. Science Translational Medicine 5: 207ra144-207ra144
3.Ulisse S, Baldini E, Sorrenti S, D'Armiento M. 2009. The urokinase plasminogen activator system: a target for anti-cancer therapy. Current cancer drug targets 9: 32-71
4.Uhland K. 2006. Matriptase and its putative role in cancer. Cellular and molecular life sciences 63: 2968-78
5.LeBeau AM, Lee M, Murphy ST, Hann BC, Warren RS, Santos RD, Kurhanewicz J, Hanash SM, VanBrocklin HF, Craik CS. 2013. Imaging a functional tumorigenic biomarker in the transformed epithelium. Proceedings of the National Academy of Sciences 110: 93-8
6.Liu C, Sun C, Huang H, Janda K, Edgington T. 2003. Overexpression of legumain in tumors is significant for invasion/metastasis and a candidate enzymatic target for prodrug therapy. Cancer research 63: 2957-64
7.Weissleder R, Tung C-H, Mahmood U, Bogdanov A. 1999. In vivo imaging of tumors with protease-activated near-infrared fluorescent probes. Nat Biotech 17: 375-8
8.Erster O, Thomas JM, Hamzah J, Jabaiah AM, Getz JA, Schoep TD, Hall SS, Ruoslahti E, Daugherty PS. 2012. Site-specific targeting of antibody activity in vivo mediated by disease-associated proteases. Journal of Controlled Release 161: 804-12
来源:奇点网 作者:王鑫英
为你推荐
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
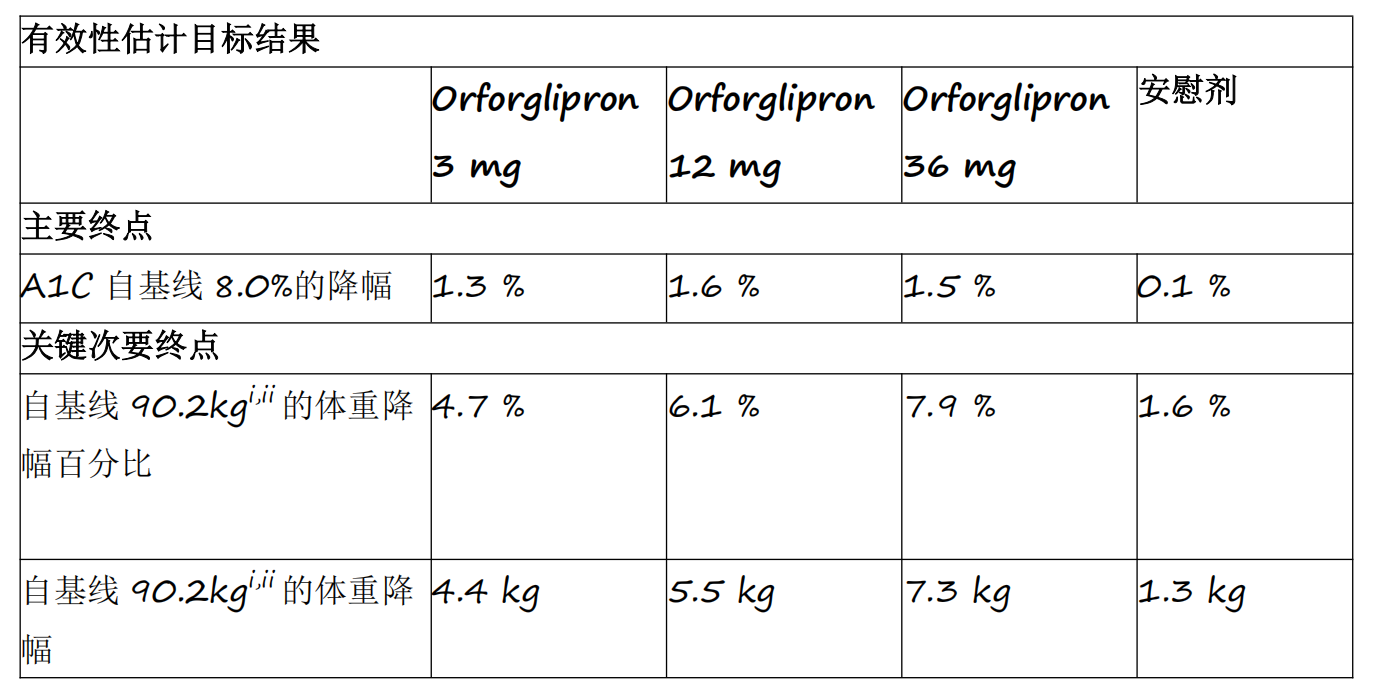
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27













