新药研发是一向以高风险着称。根据BIO一项对来自1103个公司的7455项临床试验的分析研究,仅有9.6%的候选药物能够进入I期临床。而一旦进入临床试验,药物失败的成本将极大的提升,尤其是III期临床的失败,将会对公司产生灾难性的打击。
10年前,辉瑞胆固醇酯转移蛋白(CTEP)抑制剂 torcetrapib在关键性ILLUMINATE试验中被发现会增加患者死亡和心血管事件的风险,公司随即终止了该药物的研发,而那时辉瑞在该产品上的投入已高达8亿美元。GEN网站近日统计了2017第一季度宣布失败的25个临床试验,其中9个是III期临床失败。
1、AC-1204
公司:Accera
适应症:阿尔茨海默氏病
作用机制:酮诱导剂
失败原因:Accera由雀巢投资,该公司将阿兹海默病当作一种新陈代谢失调的疾病来看待。AC-1204的作用机制为在患者体内产生酮体供神经细胞使用,以缓解因AD患者脑部葡萄糖供应不足造成的神经细胞能量短缺的问题,通过改善神经细胞的新陈代谢以增进患者的认知功能。
2月28日,Accera宣布AC-1204在一项用于轻中度AD患者的III期临床中未达到主要终点,在26周的治疗后,阿尔茨海默病评定量表认知量表(ADAS-cog)测试结果显示,AC-1204与安慰剂组相比未显示出统计学上的显着差异。
2、Idalopirdine(Lu AE58054)
公司:灵北制药、大冢制药
适应症:阿尔茨海默氏病
作用机制:选择性5-HT6受体拮抗剂
失败原因:2月8日,在两项名为 STARBEAM 和STARBRIGHT 的 III期临床中,Idalopirdine用于轻中度阿尔茨海默氏症没有达到临床主要终点, 未能使阿尔茨海默病评估量表认知部分(ADAS-cog)总分实现显着降低。其中STARBEAM 试验考察了idalopirdine辅助多奈哌齐对于轻中度阿尔茨海默患者认知功能的改善。STARBRIGHT主要考察idalopirdine辅助乙酰胆碱酯酶抑制剂疗法的疗效。
而四个月前,灵北制药刚刚宣布了idalopirdine在第一个III期临床的彻底失败。在这个叫做STARSHINE的试验中,idalopirdine(30mg或60mg),同时配合10mg剂量多奈哌齐没能实现ADAS-cog总分显着降低,未达到试验的主要终点。
3、美他多辛缓释制剂(MDX)
公司:Alcobra
适应症:注意力缺陷多动障碍
作用机制:γ-氨基丁酸转氨酶抑制剂,可增加中枢神经系统GABA的释放
失败原因:1月17日,Alcobra宣布美他多辛缓释制剂用于成人ADHD(注意力缺陷多动障碍)的第二项III期临床MEASURE未达到主要终点,基于康纳斯成人ADHD评定量表得分,美他多辛缓释制剂相较基线没有表现出显着差异。
4、Rocapuldencel-T(AGS-003)
公司:Argos
适应症:转移性肾细胞癌(mRCC)
作用机制:通过捕获特定肿瘤患者的突变和变异抗原并诱导针对患者肿瘤抗原的免疫应答而设计的个体化肿瘤疫苗。
失败原因:2月22日,独立评审委员会对Argos的癌症疫苗rocapuldencel-T的III期临床中期结果评估后,认为rocapuldencel-T与辉瑞 Sutent (苹果酸舒尼替尼)和标准疗法联用面临失败风险,建议停止该疫苗第三阶段的试验工作。
5、Sapacitabine(CYC682)
公司:Cyclacel
适应症:急性髓性白血病
作用机制:环素依赖性激酶抑制剂, 是细胞周期调节性核苷酸类似物,作用原理为干扰 DNA 合成。
失败原因:2月23日,Cyclacel公司宣布,对于新诊断的不适用于强化诱导化疗的急性髓性白血病患者,口服sapacitabine与皮下注射地西他滨组与单独使用地西他滨相比未能提高受试患者的总体生存率,其III期SEAMLESS 试验未达到试验的主要终点。早在两年前,独立数据监管委员会就警告Cyclacel该药前景不妙,但Cyclacel方面仍坚持推进研发工作。
6、Serelaxin(RLX030)
公司:诺华
适应症:急性心衰
作用机制:Serelaxin是一种重组的人松弛素-2,是一种松弛素受体激动剂。
失败原因:3月22日宣布,诺华宣布其在研心衰药物serelaxin(RLX030)一项III期研究未能到达主要终点。在标准治疗的基础上添加serelaxin不能降低急性心衰(AHF)患者的180天心血管死亡率和5天心衰恶化。这项代号为RELAX-AHF-2的III期研究于2013年10月启动,招募了6600例因为急性心衰住院的患者,主要评估在标准疗法基础上添加serelaxin的疗效、安全性和耐受性。
7、Tivantinib
公司: ArQule、第一三共
适应症:肝细胞癌
作用机制:口服MET受体酪氨酸激酶抑制剂
失败原因:2月27日,第一三共/ArQule公布其临床试验表明其MET抑制剂tivantinib在原发性肝癌III期临床试验中未能达到主要终点,患者整体生存率未见明显提升。该项名为METIV-HCC的临床试验是一项具有生物标志物特异性、双盲、安慰剂对照的随机III临床试验,共纳入340名不能手术的、对既往系统性治疗不耐受、且高表达MET的原发性肝癌患者。主要终点为总体生存期,次要终点为无进展生存期和安全性。
3月27日,Tivantinib在日本开展的一项III期临床中相比安慰剂在无进展生存期上未显示显着改善,未达到临床上的主要终点。该实验共纳入190名曾接受索拉非尼治疗的, c-Met高表达、不能接受手术治疗的患者。
8、Trabodenoson
公司:Inotek
适应症:青光眼
作用机制:选择性腺苷A1受体激动剂,可以扩张眼部小梁网,促进房水流出,从而降低眼压。
失败原因:1月3日,Inotek公司宣布其重磅青光眼新药trabodenoson第一项关键III期MATrX-1研究的一线结果。结果显示,在所有的12个观察时点,trabodenoson与安慰剂相比未能明显降低眼压。受此消息影响,Inotek股价下跌64%。
MATrX-1研究是一项随机、双盲、安慰剂对照研究,在303例原发性开角型青光眼(POAG)或高眼压症(OHT)患者(眼内压为24~34mmHg)中评估trabodenoson治疗3个月的有效性、安全性及耐受性,主要终点是第28,42,84天4个时间点(8:00,10:00,12:00,14:00)trabodenoson治疗组眼内压相比安慰剂组的降低水平。Trabodenoson的剂量设置为每日1次3%/1000g、4.5%/1500g、6%/2000g三个水平。
9、Verubecestat
公司:默沙东
适应症:阿尔茨海默病
作用机制:Verubecestat(MK-8931)属于β位点淀粉样蛋白前体蛋白切割酶1(BACE1)抑制剂,通过抑制BACE1酶活性,降低β-淀粉样蛋白含量。
失败原因:针对Verubecestat的临床Ⅲ期试验,默沙东启动了两个项目:EPOCH(protocol 017)和APECS(protocol 019)。EPOCH主要为验证Verubecestat治疗轻中度阿尔兹海默症的有效性和安全性,通过测量患者的认知能力进行药效评估。而APECS项目主要验证Verubecestat对前驱症状性老年痴呆症的治疗效果,通过评估受试对象的记忆能力衡量疗效。
2月14日,根据外部数据监测委员会的建议,默沙东官宣布终止Verubecestat的临床Ⅲ期EPOCH试验,数据监测委员会认为该实验 “几乎不可能得到一个积极的临床结果”。不过Verubecestat的另一项III期临床仍将继续。
来源:新浪医药
为你推荐
 资讯
资讯 带状疱疹疫苗“遇冷”,百克生物2024年净利润腰斩
近日,国内疫苗龙头企业百克生物发布2024年年报,数据显示,其报告期内实现营收12 29亿元,同比下降32 64%;归属于上市公司股东的净利润2 32亿元,同比下降53 67%。对于营收...
2025-04-23 12:59
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
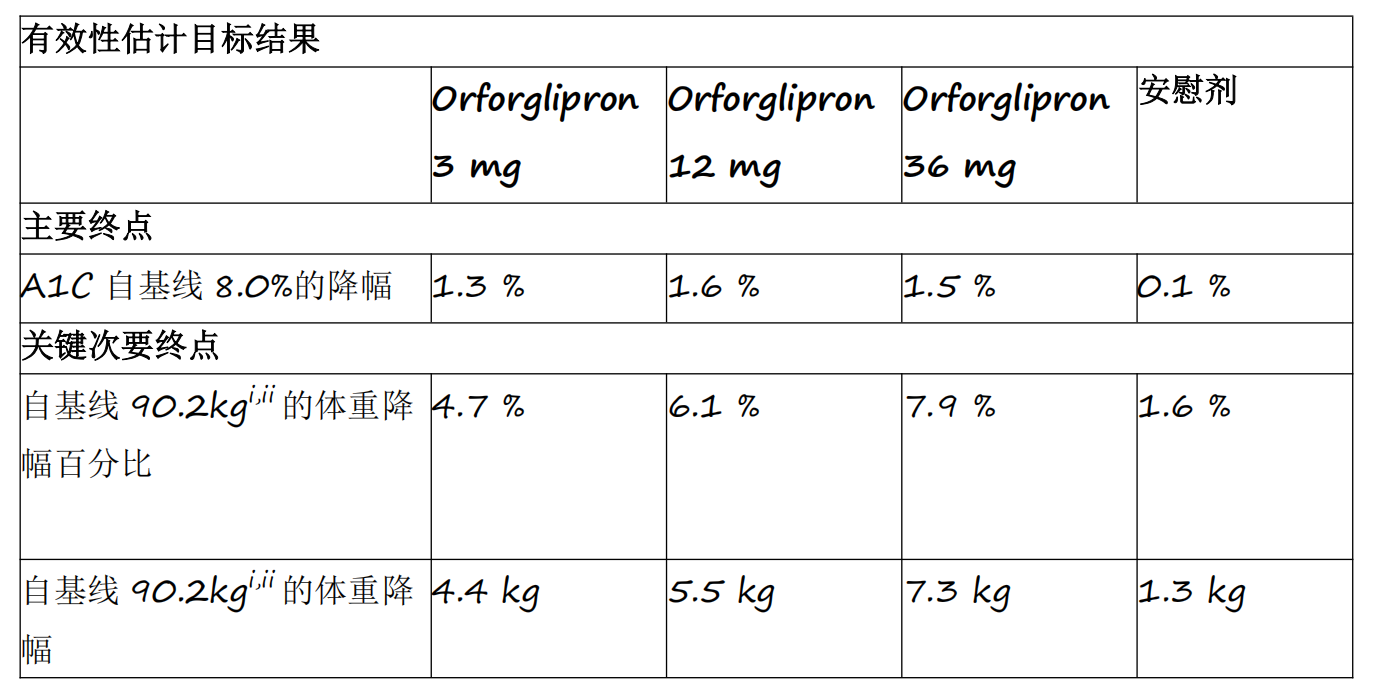 资讯
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12









