EMA优先药物制度(PRIME)
2016年3月,欧洲药品管理局出台了一个新的制度,旨在加快罕见病的药物研发速度。这项制度被命名为优先药物制度(Priority Medicine,PRIME)——EMA筛选出创新性的研发项目,在药物开发的初期阶段,审批人员就和入选的企业及时、频繁地沟通。EMA称,通过在研发的各个阶段提供反馈,帮助制药企业拟定恰当的临床试验方案,招募合适的受试人群,最终提高临床实验的成功率。
EMA表示,加入PRIME项目必须满足以下条件:制药企业必须递交早期临床数据,而且这些数据必须能够证明,该产品有希望在目前尚且不能有效治疗的疾病中取得突破。一个药物一旦被授予PRIME资格,EMA将会采取以下措施:
委派一名来自人用药品委员会(CHMP)的专员为研发企业提供持续的技术支持,与企业沟通提交上市申请前的一切技术问题。如果药物同时被认定为先进治疗药物,EMA则会委派来自先进治疗药物委员会(Committeeon Advanced Therapies,CAT)的成员。
组织CHMP/CAT专员、EMA多学科专家小组及相关方召开启动会议,为药物的总体研发方案和注册策略提供指导。
可以为企业安排与EMA沟通的专属时点。
在关键的研发里程碑为企业提供科学建议,与更多的利益相关方(如健康技术评估组织)接洽以帮助患者更早获得新药。
在提交上市申请时与企业确认获得加速审评的可能性。
FDA突破性疗法认定(BTD)
“突破性疗法”认定(Breakthrough Therapy Designation,BTD)是由专利保护组织“癌症研究之友”(Friends of Cancer Research,FCR)倡议并提出的。2012年7月9日,《美国食品药品管理局安全和创新法案》签署成为法律,其中第902条提出一项新指定:新药物的“突破性疗法认定”。由此,“突破性疗法”以“合法”的身份进入新药审批当中,并在近些年得到长足发展。
所谓“突破性疗法”是指那些“被开发单用或与一种或多种其他药物联用于治疗严重或危及生命的疾病,且初步临床试验表明,在一个或多个有临床意义的终点指标上,该药较现有疗法有显着改善,如临床开发早期观察到的明显疗效。研发中的新药一旦被确认具“突破性疗法认定”资格便能享受一系列优惠待遇,包括快速通道认定的特权、FDA官员的悉心指导(早在Ⅰ期临床开发阶段便可开始,以推进一项高效药物开发计划的实施)以及有高级管理者和资深评审人员参与对开发计划进行积极协作性的跨学科评审。对于临床开发早期便呈现显着活性的治疗药物予以加速评审,并鼓励开发商在不晚于Ⅱ期临床开发阶段就去申请突破性疗法认定。但若药物在开发后期未能达到早期期望值,FDA则可撤销其候选药资格。“突破性疗法认定”可授予针对同一适应证的多个在研药品,但当用于此适应证的首个药物获批后,用于同一适应证的任何其他药物都将失去突破性疗法资格,除非药物开发公司或资助者能证明其产品优于首个获批药品。
2016-2017年度EMA优先药物盘点
欧洲药品管理局的PRIME及已经运行5年之久的FDA BTD选定了很多相同的比较有前景的候选药物。截至2017年3月,EMA的优先药物制度运行一周年之际,已将19种候选药物纳入,其中至少12种公开批露获得FDA突破性疗法认定,占比达63%(表1)。剩余7种候选药物未出现在BTD名单中,药物申请时间、研发策略及市场优先性等因素都可能造成此差异。
表1. First-year PRIME candidates
从统计数据来看,PRIME与BTD之间也存在很多相似性。两者份额最大的治疗领域均为肿瘤,占比分别为32%及28%;考虑到医药工业界对抗肿瘤药物管线投资的巨大热情,该分布也在预料之中(如下图)。另外,两个项目均包含适用于罕见病的产品。其中58%(19种候选药物中的11种)的PRIME产品针对孤儿病;在BTD项目开展的第一年中,这一比率为62% (26种中的16种)。考虑到医药工业界对于罕见病的兴趣,以及对于目前尚无很好治疗方案领域的监管侧重,该趋势也是有据可循的。FDA的高级医学顾问Jonathan Jarow表示,“从整体上来看,两项目间的相似性是要多于差异性的”。
尽管如此,两者间在准入标准和基本特征等方面还是存在细微差异。相比于BTD, PRIME候选药物的平均临床试验经历要少一些。另外,PRIME项目中所谓的“先进治疗方案”占比也要高于BTD项目。基因治疗、CAR-T疗法及溶瘤病毒方案在所有PRIME后选药物中占比高达58%,而在公开批露的BTD项目中占比则只有15%。
PRIME and BTD candidates by therapeutic area
(updatedto 2 March 2017 and 30 November 2016)
从项目设计初衷角度来看,PRIME目标定位于最早期阶段的研发工作。FDA可将BTD授予已批准产品的新型适应症的研发,但EMA只能将未批准药物纳入优先药物计划。另外,FDA可以授予已完成Ⅲ期临床试验的药物突破性疗法认定,特别是在项目开展的早期阶段;而EMA通常将PRIME限定于早期阶段尚未进入实质性临床试验阶段的潜力候选药物。目前PRIME的第一批候选中只有32%处于Ⅲ期临床试验阶段;而在BTD项目开展的第一年中,处于Ⅲ期临床试验或更后期阶段的药物占比高达58%。
整体而言,PRIME的目标在于已经取得令人信服的临床Ⅰ期及Ⅱ期探索性工作的候选药物。但EMA同时还对科研机构及中小规模企业提供额外的帮助,相比于大的制药公司,前者往往缺乏药物研发经验。对于已获得部分积极性临床前数据的科研机构及中小企业,EMA会设定更早进入PRIME的时间节点。迄今为止,EMA只批准了Albireo公司的回肠胆汁酸转运体抑制剂A4250进入PRIME,用于治疗进行性家族性肝内胆汁淤积症。目前为止仅有一家科研机构申请了PRIME,但他们的申请被拒绝。
EMA之所以将关注重点集中于先进治疗方案,是因为后者的研发之路往往危机重重。这些药物通常应用于罕见病,在临床试验中会面临独特的挑战。繁重的生产及质控问题往往会拖延甚至毁掉某些潜力候选药物的申请进程。另外更复杂的是,先进治疗方案不得不面临不同监管机构的审查,每一家都有自己独特的监管要求。通过早期介入和提供支持,监管机构将会深入了解这类公司所面临的问题,从而有可能帮助他们克服困难,推进研发进程。这也是PRIME项目的吸引力之一。迄今为止EMA仅仅批准了两项基因疗法,而FDA尚未批准任何基因疗法。Llinares表示,“EMA已经意识到,在如何保障这些疗法的可重复性,如何控制产品质量以及如何批量给药方面,医药研发界仍处于初步阶段。”
Overview of recommendations on PRIME eligibility requests adopted by 23 February 2017
缩略词表:
ALL:acute lymphoblastic leukaemia
BTD:breakthrough therapy designation
CAR:chimeric antigen receptor
DLBCL:diffuse large B cell lymphoma
EBV:Epstein–Barr virus
GABA:γ-aminobutyric acid
IBAT:ileal bile acid transporter
mAb:monoclonal antibody
PPAR:peroxisome proliferator-activated receptor
PRIME:priority medicines
RNAi:RNAinterference
参考文献
1. PRIME time at the EMA. Nature Reviews Drug Discovery 16, 226–228 (2017)doi:10.1038/nrd.2017.57
2. European regulators launch 'breakthrough' equivalent programme. Nature Reviews Drug Discovery 15, 223 (2016)i:10.1038/nrd.2016.65
3. https://www.focr.org/breakthrough-therapies
4. www.ema.europa.eu> Human regulatory >Support for early access > PRIME
来源:药渡(微信号 Pharmacodia) 作者: 碧水清心
为你推荐
 资讯
资讯 圣因生物完成超 1.1 亿美元 B 轮融资,加速 RNAi 疗法全球布局
本轮融资由知名产业机构领投,国际主权基金、中国生物制药、君联资本等十余家机构跟投,全球制药巨头礼来公司战略入局,高瓴创投、启明创投等现有股东持续加码支持,融资规模创...
2025-12-12 16:59
 资讯
资讯 投后估值达21.37亿元,实体瘤细胞治疗领军企业君赛生物递表港交所
君赛生物共有5款在研产品,其中核心产品也是进展最快的是GC101,正开展上市前的关键II期临床试验,有望成为国内首个获批上市的TIL细胞创新药
2025-12-12 09:24
 资讯
资讯 ESMO-IO | ORR达41.7%!君赛生物GC101 TIL治疗晚期后线非小细胞肺癌I期数据首次公布
这不仅是全球首个无需高强度清淋化疗、无需IL-2给药的TIL疗法治疗肺癌的临床研究,也是国内首个公开披露该领域数据的注册性临床研究。
2025-12-12 09:17
 资讯
资讯 君合盟生物启动重组 A 型肉毒毒素治疗成人上肢痉挛状态临床 III 期试验,并完成首例患者入组
该临床试验由复旦大学附属华山医院李放教授和上海市养志康复医院(即上海市阳光康复中心)靳令经教授联合牵头
2025-12-11 21:06
 资讯
资讯 Medidata发布全新调研报告:临床试验AI应用价值凸显,超七成用户反馈“达到或超预期”
基于对来自全球制药公司、生物科技公司及合同研究组织(CRO)中超200位核心决策者的深度调研,报告显示,目前AI在改善患者招募、优化数据管理、控制运营成本和提升试验效率等方...
2025-12-11 20:57
 资讯
资讯 近20年首个全新类别抗菌药物醋酸来法莫林纳入医保,开启中国成人社区获得性肺炎治疗普惠新篇章
该产品继2025年6月30日获得国家药品监督管理局批准用于治疗成人社区获得性肺炎(CAP)后又纳入国家医保目录
2025-12-11 20:50
 资讯
资讯 专注 “生物学 + AI” ,普瑞基准完成超亿元 D 轮融资,加速 AI 驱动新药研发
本轮融资由信立泰、广投资本、申宏中恒基金联合领投,老股东金谷汇枫、聚翊投资持续跟投
2025-12-10 15:55
 资讯
资讯 别把“嗜睡”当懒癌!新型促觉醒药翼朗清®获批,专注维持日间清醒
促觉醒药物翼朗清®(盐酸索安非托片)正式获得中国国家药品监督管理局(NMPA)批准,用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度嗜睡(EDS)的成人患者的觉醒程度。
2025-12-10 11:04
 资讯
资讯 复星医药将其GLP-1产品全球化权益授权辉瑞,总里程碑付款近150亿人民币
12月9日晚间,复星医药发布公告称,公司控股子公司药友制药、复星医药产业与辉瑞共同签订《许可协议》,(其中主要包括)由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)...
2025-12-10 09:12
 资讯
资讯 Capricor Therapeutics公司宣布外泌体疗法Deramiocel在DMD三期中取得积极成果
近日,专注与外泌体疗法的Capricor Therapeutics(纳斯达克代码:CAPR)公司宣布其核心管线Deramiocel在杜氏肌营养不良症关键三期 HOPE-3 研究中取得积极成果。
2025-12-09 16:38
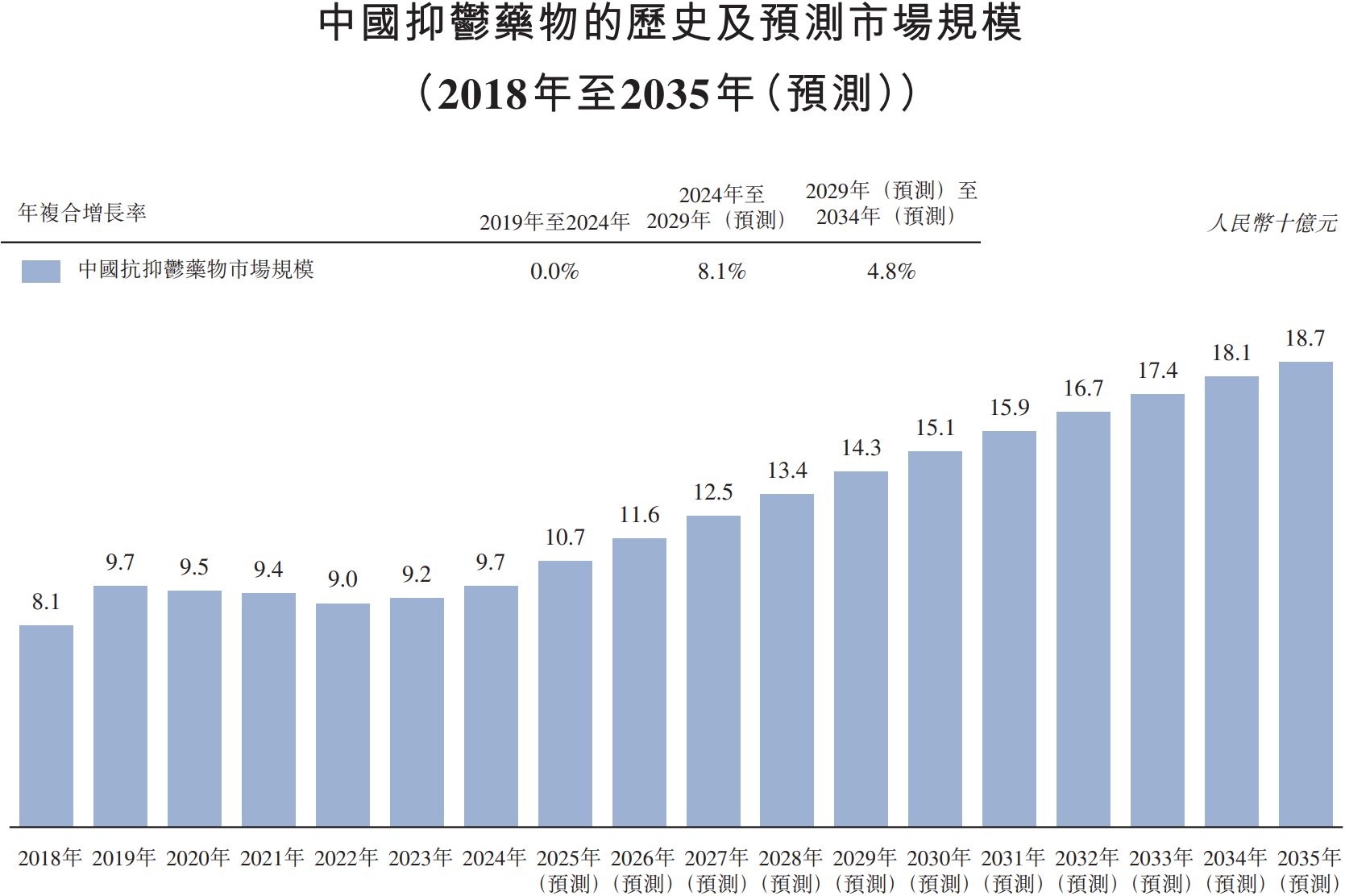 资讯
资讯 中药1类创新药剑指抑郁症治疗蓝海,远大医药GPN01360成功达到国内II期临床终点
国产抗抑郁症药物研发取得重大进展。近日,远大医药(0512 HK)的1 1类中药创新药GPN01360国内II期临床研究成功达到临床终点,产品表现出显
2025-12-08 18:27