对于制药公司来说,2016年是不寻常的一年,因为美国FDA仅批准了22种新药。2017年制药行业是否会做得更好尚待观察。
根据EP Vantage对2017年有望或已经上市药品的前瞻,罗氏(Roche)治疗多发性硬化症(MS)的新药Ocrevus是新药名单中最引人注目的,该药有望从多个方面打破市场格局。
在原发性进行性MS患者的临床试验中,Ocrevus的疗效比目前的标准治疗用药,即德国默克(Merck KGaA)的干扰素更好,且显示出其它药物不具备的效果。这将对其它药品造成压力,并促使保险公司对药企施加降价的压力。
此外,分析师认为如果保险公司不施加压力的话,赛诺菲(Sanofi)和再生元(Regeneron)治疗过敏性皮炎的的热门新药Dupixent,也可能引起不小的市场震动。
值得注意的是,2017年将上市的新药对几家公司特别关键,因为有些新药是这些公司首个上市的产品。
还有一些新药不一定是该领域或药企的先锋产品,但它们可以让竞争对手紧张不安。诺华(Novartis)的ribociclib(Kisqali,以前称为LEE011)将在治疗乳腺癌的CDK 4/6抑制剂领域挑战辉瑞(Pfizer)的Ibrance;诺和诺德(Novo Nordisk)每周给药一次的GLP-1类似物semaglutide,将接班该公司的重磅产品Victoza,与礼来(Eli Lilly)同样每周给药一次的Trulicity竞争市场。据悉,semaglutide初步的研究数据显示其在保护心血管功能方面有优势。
3月14日,美国FDA批准了诺华的Kisqali与芳香酶抑制剂联合用于绝经后激素受体阳性、人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者。
今年有望或已上市药品5年后销售十强榜
Ocrevus:
掀MS药降价潮
Ocrevus有望成为2017年新药的领头羊是有原因的,因为MS领域正面临大洗牌。
该药是第一种显示出可以延缓原发性进展型MS患者致残率的治疗药物,这些患者在MS患者中占比为15%,这也是Ocrevus在去年2月获得FDA突破性疗法认定的原因。
同时,Ocrevus在治疗复发缓解型MS上也表现非凡。两项Ⅲ期临床研究的数据不仅能支持该药的上市申请,也表明其将超越德国默克的Rebif。
事实上,Ocrevus原本有可能在2017年前得到批准,但去年12月下旬,罗氏宣布由于Ocrevus的生产过程被查出有问题,FDA将最终审核截止日期从2016年12月28日推迟至2017年3月28日。
不过,该来的总会来。分析师预测,Ocrevus的上市将会有利于保险公司对整个MS市场的产品价格施加压力,而此前MS药品在处方管理政策下已经经历一次降价潮。
Dupixent:
定价成关注重点
分析师认为,赛诺菲与再生元的dupilumab(商品名:Dupixent)有望创造佳绩。在临床试验中dupilumab已经取得了大量积极数据,且由于过敏性皮肤炎一直缺乏可靠的治疗选择,因此一些分析师认为,dupilumab或许可改变很多患者的命运。
但人们对于Dupixent上市的关注点将是该药的标价,以及保险公司如何看待其定价。事实上,赛诺菲与再生元也很清楚,近年来保险公司对药价的施压,已经妨碍了某些慢性疾病新药的推广。以两者的PCSK9抑制剂Praluent为例,由于其价格昂贵令保险公司“压力山大”,致使一些保险公司甚至对这类药物的使用作出了严格限制。
赛诺菲与再生元指出,根据FDA目前正在审评的适应症,估计仅有160万名过敏性皮肤炎患者可用Dupixent治疗,而这些患者量只占了庞大的湿疹药物市场的一小部分,因此保险公司可能会接受他们的定价。
同时,两家公司也正在开发Dupixent的其他适应症,如哮喘等其它过敏性疾病。
Semaglutide:
降低心血管风险
诺和诺德希望其糖尿病新药semaglutide能够接棒其每日给药一次的Victoza成为新的重磅产品。不过,其将面临其它 GLP-1类药物的竞争,例如礼来的Trulicity。
由于保险公司一直向糖尿病制药商施压,要求给予打折,因此诺和诺德必需提供一组强有力的证据来说明 semaglutide的疗效,才能使其在竞争激烈的GLP-1类似物市场中占据一席之地。为此,该公司计划开展更多的临床试验,包括头对头研究。
事实上,在临床试验中,semaglutide已显示出其比一些常用药物有优势,例如阿斯利康每周给药一次的GLP-1类药物 Bydureon,默沙东的小分子DPP-4抑制剂Januvia,以及赛诺菲的基础胰岛素Lantus。
此外,semaglutide具有降低整体心血管风险的作用。在去年9月公布的Sustain 6研究结果显示,每周一次皮下注射,semaglutide可使心梗、中风和心血管疾病死亡的风险降低26%。目前,仅有其余两种糖尿病药物的临床数据显示对心血管系统具有益处,即Victoza与礼来/勃林格殷格翰的SGLT-2抑制剂Jardiance。
诺和诺德计划,一旦semaglutide获批上市,就对已经完成的试验继续随访,为证明semaglutide可降低心血管风险补充实例证据。该公司正招募受试者进行头对头研究,以比较semaglutide和Jardiance的疗效。
与此同时,诺和诺德还在开发口服型semaglutide,一旦成功,其将会是第一个口服GLP-1类药物。
Durvalumab:
联合用药直指一线疗法
阿斯利康的durvalumab将是检查点抑制剂市场中的第四个产品,但这并不意味着其没有竞争优势。
与竞争对手百时美施贵宝、默沙东以及罗氏一样,阿斯利康瞄准了非小细胞肺癌(NSCLC)药物市场的丰厚利润。不过,其一直在开发联合治疗方案,将durvalumab与另一个潜在药物tremelimumab(阿斯利康的一种CTLA-4药物)联合用药来提高其在NSCLC中的疗效。该公司最近正加快研究,力求使这个联合疗法成为NSCLC的一线疗法,这样一来或许可填补百时美施贵宝的Opdivo留下的空白。Opdivo作为单药一线治疗的试验在去年失败了。
但此举推迟了阿斯利康NSCLC的Ⅲ期临床试验的完成时间,这意味着durvalumab可能还需要一段时间才能登陆肺癌药物市场。
同时,与竞争对手一样,阿斯利康也正努力为durvalumab进入其他市场清除障碍。去年2月,FDA授予durvalumab治疗转移性尿路上皮膀胱癌的突破性疗法认定,它将与Tecentriq和Opdivo竞争这一市场。目前FDA已经开始对Opdivo治疗膀胱癌的申请进行审评,其或许将先于durvalumab获批该适应症。阿斯利康还在为durvalumab申请头颈癌适应症而努力,去年11月,由于在两项临床试验中突然出现了出血不良事件,阿斯利康只得放弃早早提交durvalumab 治疗头颈癌申请的计划。
Niraparib:
适应症成竞争优势
Niraparib将成为继Lynparza与Rubraca后,抗癌药物市场上第3个PARP抑制剂。Tesaro公司希望niraparib能够被批准用于更多的适应症,因为临床试验数据表明,niraparib不仅对有 BRCA基因突变的女性癌症患者有奇效,对无基因突变的患者亦有效果。
根据临床试验数据,相比安慰剂组,niraparib使带有BRCA基因突变的卵巢癌患者的无进展生存期延长了15.5个月,而使无基因突变女性患者的无进展生存期延长5.4个月。在非BRCA突变但有其他突变的患者中,niraparib也有积极的疗效,患者的无进展生存期为12.9个月,而对照组为3.8个月,延长了9个月多。
Niraparib的首个适应症将是卵巢癌二线疗法,同时Tesaro公司正在研究niraparib对未经治疗的患者的疗效,以期该药被批准作为卵巢癌的一线疗法。Tesaro公司还开展了niraparib治疗乳腺癌的临床研究。
如果niraparib上市,那么阿斯利康的 Lynparza和Clovis肿瘤公司的Rubraca 将成为其最重要的竞争对手。但若niraparib获批的适应症多,那么其使用范围将更广。目前,Rubraca 和 Lynparza一样,只被批准用于治疗带BRCA基因突变的癌症。
Baricitinib:
RA领域竞争激烈
为了应对“专利悬崖”的打击,礼来计划在2014~2023 年期间,完成“推出20 种新药”的目标。
不过,口服类风湿性关节炎(RA)药baricitinib可能扛不了大梁。该药将紧随辉瑞的Xeljanz进入类风湿性关节炎领域,而Xeljanz的销售业绩目前还没有达到分析师的预测。2016年前9个月,Xeljanz的累计销售额仅有6.49亿美元,这与分析师预测的该药2016年的年销售额为13亿美元的目标相差甚远。
Baricitinib的临床试验已取得很多积极数据,一项Ⅲ期临床研究后续数据显示,该药在预防进行性放射学结构性关节损伤方面的疗效至少可以维持48周。
与此同时,RA领域众多的参与者将使礼来未来的销售任务更加艰巨。葛兰素史克与强生、赛诺菲与再生元,以及吉利德与Galapagos公司的RA药物都已进入Ⅲ期临床试验阶段。艾伯维的“重磅炸弹”Humira的生物类似药也会使得baricitinib的市场前景变得更加复杂,尽管在baricitinib和Humira的头对头研究中发现,前者疗效比后者更好。
Kisqali:
挑战Ibrance安全性成隐患
诺华的Kisqali蓄势待发,将在CDK 4/6抑制剂领域向辉瑞的热销药品Ibrance发起挑战。尽管Kisqali的一些安全性问题让投资者担心,但EP分析师却很看好其前景。
Kisqali在Ⅲ期临床试验中取得了强劲的数据,但与Ibrance相比,该药的安全性问题受到关注。例如,引起肝损害和心律失常,且有一件与其有关的猝死案例。
瑞士瑞信银行(Credit Suisse)分析师Vamil Divan认为,Kisqali的安全性问题可能会使得其市场前景还不如礼来的abemaciclib。但诺华全球研发部门负责人Vas Narasimhan曾表示,会安排肿瘤医师对使用Kisqali治疗的患者进行监测,“这个相对常规的监测不会是一个过度负担。”
诺华的下一步计划是将Kisqali用于绝经前女性患者,以期能够获得真实、关键的临床数据。
KTE-C19:
争做首个CAR-T上市产品
Kite制药正与诺华赛跑,希望其淋巴瘤新药KTE-C19成为美国市场上首个CAR-T疗法。
虽然Kite制药在去年12月初就向FDA递交了KTE-C19的滚动新药申请,将其用于治疗复发性或难治性弥漫性B细胞非霍奇金淋巴瘤(NHL),但同一时间,诺华也积极展开了与FDA的沟通工作。
去年12月,诺华公布了其CAR-T疗法CTL019新的Ⅱ期临床数据,这为该药在2017年较早时候申请用于治疗儿童或年轻成年患者的复发或难治性急性淋巴细胞白血病(r/r ALL)作了准备。Kite公司预计将在2017年第一季度末完成向FDA提交生物制品新药申请(BLA),并打算在2017年将KTE-C19推向市场。
诺华还计划在今年向欧洲药品管理局(EMA)提交申请,因为EMA已经准予将CTL019纳入重点药物(PRIME)审批计划,这将大大节省审查时间。与此同时,Kite公司的KTE-C19也获得了PRIME资格,并计划在2017年向EMA提交申请。两家公司也希望其新药能够在未来几年获批其他血液系统肿瘤适应症。
KTE-C19 在2026年的预期销售额可达19亿美元,但总体销售额很可能取决于其和同类竞争产品能否将适应症扩展到实体瘤。KTE-C19的销售额也将与其标价有关,一些分析师预计,这一CAR-T疗法的价格大约为30万美元一疗程。
Ingrezza:
FDA首个批准TD药物
如果Ingrezza获得FDA的“绿灯”,其将成为第一个获FDA批准用于治疗迟发性运动障碍(TD)的药物,但Neurocrine公司不会止步于此。
在Ⅱ期临床试验中,Ingrezza用于治疗有言语障碍和多发性抽动等症状的抽动秽语综合征,但这方面的研究最近遇到了瓶颈。Neurocrine公司在1月中旬宣布,在一项成年患者参与的临床研究中没有达到主要治疗终点。
接下来,Neurocrine 预计会在3月底或4月初公布Ingrezza治疗小儿抽动秽语症的临床数据,这些数据将会对Ingrezza治疗抽动秽语症的开发产生重要影响。
Spinraza:
高药价引争议
今年1月,百健和Ionis公司合作开发的Spinraza获得了FDA的上市批准。该药成为市场上第一个治疗脊髓性肌萎缩(SMA)的药物,患者治疗第一年所需的药费高达75万美元,随后每年为37.5万美元。
作为治疗罕见病的药物,Spinraza一年的治疗费没有超出该类药物的标准费用范围,但在当前公众对药价高度关注的背景下,Spinraza的高标价立刻引起了广泛争议。分析师猜想,公众对Spinraza标价的反应能否促使保险公司对百健施压,从而争取一些折扣。
尽管争论不断,但分析师认为Spinraza将会是百健和Ionis公司的成功产品。Leerink Partners的分析师Geoffrey Porges将该药2020年的预期销售额提高至20亿美元,他预计今年将有1700名患者接受治疗。
来源:医药经济报(微信号 nfsyyjjb)
为你推荐
 资讯
资讯 带状疱疹疫苗“遇冷”,百克生物2024年净利润腰斩
近日,国内疫苗龙头企业百克生物发布2024年年报,数据显示,其报告期内实现营收12 29亿元,同比下降32 64%;归属于上市公司股东的净利润2 32亿元,同比下降53 67%。对于营收...
2025-04-23 12:59
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
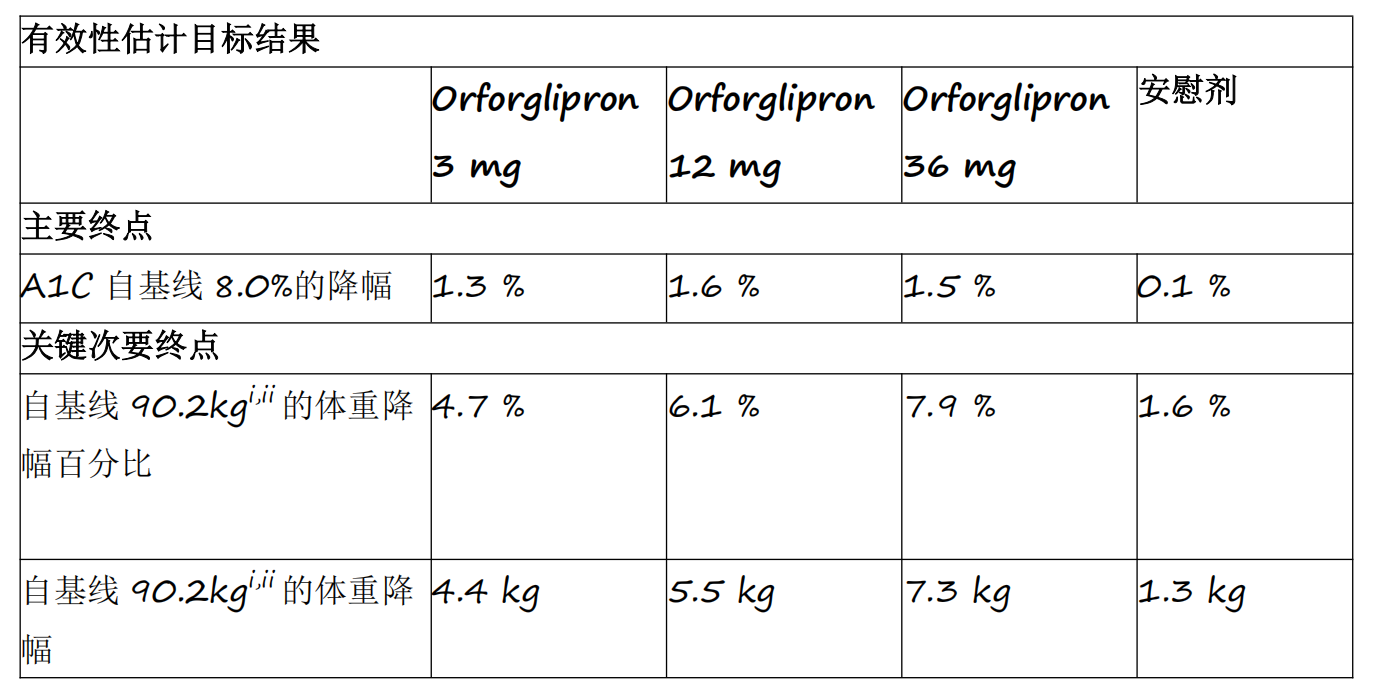
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12










