26日,海思科发布公告称,公司于近日收到国家食品药品监督管理总局(CFDA)核准签发的生物药物“HSK-III-001注射液”的《药物临床试验批件》(批件号:2016L10582),公司将尽快启动相应的临床试验。HSK-III-001注射液作用靶点为B细胞表面CD20分子的一个抗原表位,包含了CD20分子的胞外大环和小环结构,该领域的同类靶点单抗药物为罗氏公司的利妥昔单抗注射液(中文商品名:美罗华)。
利妥昔单抗(Rituximab)由罗氏公司于1997年在美国申请获准上市,用于非霍奇金氏淋巴瘤、滤泡细胞淋巴瘤等恶性肿瘤的治疗。2000年作为第一个成功用于临床治疗的单克隆抗体在国内上市。其在美国商品名为Rituxan,欧洲商品名:MabThera,中国的商品名:美罗华。美罗华(利妥昔单抗注射液)适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C 和D 亚型的B 细胞非霍奇金淋巴瘤)的治疗;先前未经治疗的CD20 阳性III-IV 期滤泡性非霍奇金淋巴瘤,患者应与标准CVP 化疗(环磷酰胺、长春新碱和强的松)8 个周期联合治疗;CD20 阳性弥漫大B 细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP 化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
淋巴瘤作为近年来全球增长最迅速的恶性肿瘤之一,据统计,全世界每9分钟就有1个淋巴瘤新发病例,我国每年死亡病例超过2万人。利妥昔单抗凭借显着疗效,业绩斐然。下图是利妥昔单抗的全球销售额。根据中国医药工业信息中心的药物综合数据库PDB数据测算,2016年国内利妥昔单抗的销售规模在25亿人民币左右。
数据来源:药物综合数据库PDB
由于单抗药物优秀的市场表现,众多的药企参与这一品种的市场角逐。中国医药工业信息中心的中国新药研发监测数据库CPM统计显示,这是国内第12个获批临床的靶向CD20的单克隆抗体。
中信国健的重组抗CD20人鼠嵌合单克隆抗体注射液(注册号CXSS1100021)在临床自查风暴中公告撤回,目前仍处于审评阶段的有浙江特瑞思、成都金凯和瑞迪博士。
这也是2016年国内第61个获批的单抗类药物,而2015年仅有23个单抗类药物获批临床。单抗药物研发是否有泡沫可能仁者见仁智者见智,单从靶向CD20的单抗申报情况来看,十余家企业扎堆进入这个领域,可以预见未来的竞争将是非常惨烈。生物制药研发投入大,技术壁垒高,需要有长远眼光。要以未来3-5年的视野来看市场,而不是只看目前大家在做什么。
来源:医药地理(微信号 pharmadl)
为你推荐
 资讯
资讯 圣因生物完成超 1.1 亿美元 B 轮融资,加速 RNAi 疗法全球布局
本轮融资由知名产业机构领投,国际主权基金、中国生物制药、君联资本等十余家机构跟投,全球制药巨头礼来公司战略入局,高瓴创投、启明创投等现有股东持续加码支持,融资规模创...
2025-12-12 16:59
 资讯
资讯 投后估值达21.37亿元,实体瘤细胞治疗领军企业君赛生物递表港交所
君赛生物共有5款在研产品,其中核心产品也是进展最快的是GC101,正开展上市前的关键II期临床试验,有望成为国内首个获批上市的TIL细胞创新药
2025-12-12 09:24
 资讯
资讯 ESMO-IO | ORR达41.7%!君赛生物GC101 TIL治疗晚期后线非小细胞肺癌I期数据首次公布
这不仅是全球首个无需高强度清淋化疗、无需IL-2给药的TIL疗法治疗肺癌的临床研究,也是国内首个公开披露该领域数据的注册性临床研究。
2025-12-12 09:17
 资讯
资讯 君合盟生物启动重组 A 型肉毒毒素治疗成人上肢痉挛状态临床 III 期试验,并完成首例患者入组
该临床试验由复旦大学附属华山医院李放教授和上海市养志康复医院(即上海市阳光康复中心)靳令经教授联合牵头
2025-12-11 21:06
 资讯
资讯 Medidata发布全新调研报告:临床试验AI应用价值凸显,超七成用户反馈“达到或超预期”
基于对来自全球制药公司、生物科技公司及合同研究组织(CRO)中超200位核心决策者的深度调研,报告显示,目前AI在改善患者招募、优化数据管理、控制运营成本和提升试验效率等方...
2025-12-11 20:57
 资讯
资讯 近20年首个全新类别抗菌药物醋酸来法莫林纳入医保,开启中国成人社区获得性肺炎治疗普惠新篇章
该产品继2025年6月30日获得国家药品监督管理局批准用于治疗成人社区获得性肺炎(CAP)后又纳入国家医保目录
2025-12-11 20:50
 资讯
资讯 专注 “生物学 + AI” ,普瑞基准完成超亿元 D 轮融资,加速 AI 驱动新药研发
本轮融资由信立泰、广投资本、申宏中恒基金联合领投,老股东金谷汇枫、聚翊投资持续跟投
2025-12-10 15:55
 资讯
资讯 别把“嗜睡”当懒癌!新型促觉醒药翼朗清®获批,专注维持日间清醒
促觉醒药物翼朗清®(盐酸索安非托片)正式获得中国国家药品监督管理局(NMPA)批准,用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度嗜睡(EDS)的成人患者的觉醒程度。
2025-12-10 11:04
 资讯
资讯 复星医药将其GLP-1产品全球化权益授权辉瑞,总里程碑付款近150亿人民币
12月9日晚间,复星医药发布公告称,公司控股子公司药友制药、复星医药产业与辉瑞共同签订《许可协议》,(其中主要包括)由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)...
2025-12-10 09:12
 资讯
资讯 Capricor Therapeutics公司宣布外泌体疗法Deramiocel在DMD三期中取得积极成果
近日,专注与外泌体疗法的Capricor Therapeutics(纳斯达克代码:CAPR)公司宣布其核心管线Deramiocel在杜氏肌营养不良症关键三期 HOPE-3 研究中取得积极成果。
2025-12-09 16:38
 资讯
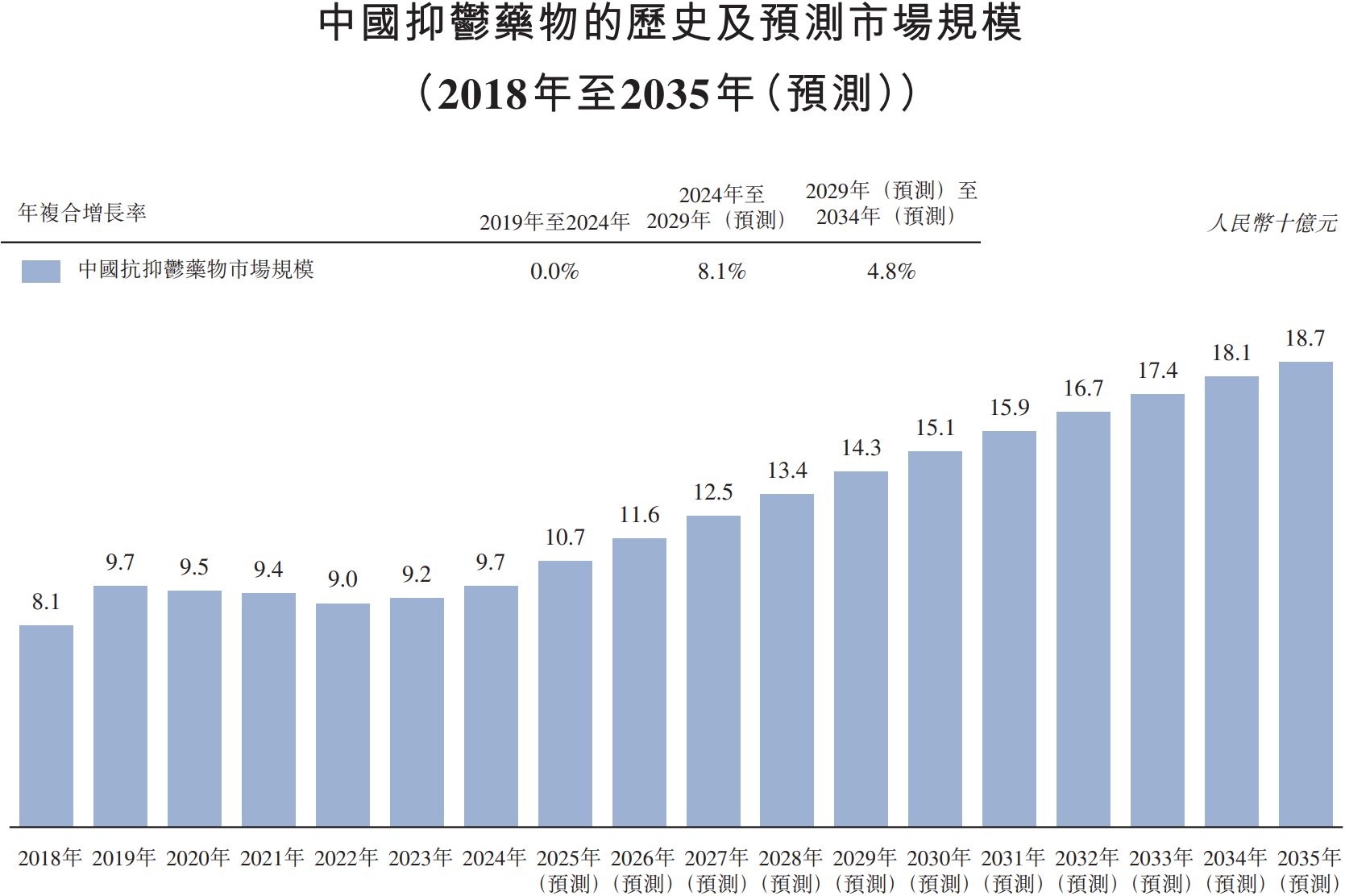
资讯 中药1类创新药剑指抑郁症治疗蓝海,远大医药GPN01360成功达到国内II期临床终点
国产抗抑郁症药物研发取得重大进展。近日,远大医药(0512 HK)的1 1类中药创新药GPN01360国内II期临床研究成功达到临床终点,产品表现出显
2025-12-08 18:27