为进一步鼓励研制儿科用药,保障儿童患者用药,减少不必要的儿科人体临床试验研究,科学的利用已有成人用药的数据,通过成人用药数据系统性整合、定性数据评估、定量证据综合、PK/PD模型、终点等外推方法,完善和丰富药品说明书中儿科人群用药信息,指导儿科临床用药。日前,药品审评中心组织起草了《成人用药数据外推在儿科人群药物临床试验及相关信息使用的技术指导原则》,现向社会公开征求意见。
附成人用药数据外推在儿科人群药物临床试验及相关信息使用的技术指导原则(征求意见稿)
1.概述
目前,全球的儿科人群药物超说明书使用现象十分普遍,在我国也不例外。其主要原因包括儿科患者(以下简称患儿)数量少于成人、在患儿开展临床试验存在特有的伦理挑战、研究中需要为患儿提供特殊保护等等,这些原因使得开展儿科人群药物临床试验的难度远远大于成人。基于上述原因,难以通过大规模确证性临床试验获得患儿的研究数据,支持其用于每个特定年龄阶段的安全性和有效性。另一方面,从伦理学考虑,采用新技术和建立新方法,减少不必要的儿科人群药物临床试验,有利于使儿科人群的痛苦最小化。因此,尽可能减少儿科人群药物临床试验中的受试者数量,最大程度利用已有数据,通过数据外推来完善和丰富儿科人群用药信息,指导临床用药,成为了保证患儿用药安全的重要和必要的途径。
本指导原则重点介绍数据外推的概念和框架,阐述儿科人群药物临床试验数据外推的基本原则和要求,供研发企业参考。考虑到目标人群、治疗领域和药物性质的差异,数据外推方法具有其多样性和灵活性,本指导原则仅提出数据外推的一般考虑。鼓励申请人在儿科人群药物开发的早期阶段与监管部门就数据外推进行沟通。
应用本指导原则时,应同时参考药物临床试验质量管理规范(GCP)、人用药品注册技术规范国际协调会(ICH)和国内外其他相关指南要求。
本指导原则不具有强制性的法律约束力,仅代表药品监管部门当前的观点和认识,随着科学研究的进展本指导原则中的相关内容会不断完善。
2.概念
外推的方法已广泛应用于药物开发领域,如动物试验数据外推至人体试验以确定首剂量、健康志愿者药代动力学数据外推至患者人群、相同机制药物或类似机制药物之间药效学数据外推等。
本指导原则中的数据外推通常是指:通过科学的研究方法,将已知人群的研究信息和结论,扩展到未知人群(目标人群)从而减少在未知人群开展不必要的研究。
儿科人群药物临床试验所使用的数据外推的主要原理是出于伦理学和效率方面的考虑,避免在目标人群开展不必要的研究,从而减少伦理学担忧,并将资源分配到最需要开展研究的领域。
3.框架
数据外推包括外推假设、外推计划、外推分析,以及减低不确定性及风险等几个主要要素,外推假设、外推计划和外推分析是一个序贯且循环往复的过程。这个过程贯穿儿科人群药物开发的整个生命周期,包括上市前和上市后阶段。
3.1建立外推假设
整合已知数据,评价已知人群与目标人群的相似性和差异点,借助建模模拟的方法,明确提出外推假设,获得预测指标。
“已知数据”的来源包括体外试验、动物实验、临床试验、流行病学研究、临床观察性研究、类似药物研究、文献等。
评估“相似性”的考虑点包括疾病相似性(病因、病理生理、临床表现、病程特征等)、人体内药物代谢及作用的相似性(药代动力学、药效学、药理作用机制等)、临床有效性和安全性评价指标的相似性及标准一致性等。
通常,预测人群间的相似度越高和预测准确度越高时,外推的可能性越大,所需额外研究数据的必要性越低。相反,如果预测人群间的相似度越低或难以预测,或者,预测准确度的影响因素越多或影响因素较难明确时,外推的可能性越小,所需额外研究数据的必要性越高。
3.2设计外推计划
基于外推假设,制订目标人群研究,包括哪些数据可以直接通过外推获得,哪些需要设计简化的临床试验或完整系统的临床试验。
外推计划分为以下三种:完全外推、部分外推和不进行外推。
“完全外推”的外推假设通常需要满足:目标人群与已知人群间具有高度相似性,并且,假设(预测)具有高度准确性。
“部分外推”的外推假设通常需要满足:目标人群与已知人群间具有一定相似性,和/或,假设(预测)具有一定不确定性。
“不进行外推”的外推假设通常需要满足:目标人群与已知人群间不具有相似性,和/或,假设(预测)具有高度不准确性。
3.3实施外推分析
解释在目标人群中获得的有限数据,验证外推假设,确证/验证已知人群和目标人群相似性。如假设未被验证,修改完善建模模拟,调整更新外推假设和外推计划,再进行外推分析。
3.4减低不确定性及风险
应充分评价数据外推的可靠性,明确不确定性和风险,提出减低不确定性和风险的策略。若基于目标人群的验证性数据有限,可能难以在上市前解释这些不确定性和风险,则需要制订上市后研究计划。
4.建模模拟
建模模拟(Modeling and Simulation,M&S)是基于数据(体外、动物、临床、文献)、假设(基于数学/统计模型描述数据)、学习(保留与假设相关的信息)、预测(基于假设的数据模拟预测和优化未来的试验结果)和确证(与外部数据比较)的数据模型方法。
建模模拟并不能完全替代儿科人群药物临床试验,应被看作是一种优化方法,用于汇总数据,描述已知人群的特征并量化评估人群间差异,为后续研究决策提供预测证据。通过建模模拟选择最利于信息获取的试验人群,确定最合理的样本量,预测给药剂量等。建模模拟的条件很复杂,需要考虑到与目标适应症、目标人群、试验药物相关的各个因素。
需要注意的是,鉴于现有知识理论的不足,对于人体生长发育不同阶段的差异无法做到精确的判断,会给建模模拟带来困难。在外推假设时需要充分考虑到知识局限性和不确定性对建模模拟数据结果的影响并予以分析。
5.基本原则和要求
5.1. 中国成人数据的外推
成人临床试验数据的合理使用可以避免不必要的儿科人群临床试验的开展,将有限的儿科人群试验资源合理安排在研究的关键环节。基于现有认识,成人临床试验数据向儿科人群的外推仅限于疗效数据;而儿科人群安全性数据的获得则需要在儿科人群中开展试验。
决策(或推断)成人临床试验疗效数据能否外推以及如何外推是有科学基础的。首先,需要对所有可获得的信息和数据进行综合分析,包括不同年龄段人群器官功能的差异及对药理学特征的影响、疾病知识、流行病学情况、非临床实验数据、相同或类似机制药物在成人及儿科人群间的药动学、药效学、临床有效性和安全性差异等。然后,从以下2个方面进行决策(或推断):
(1)目标适应症的疾病进程和治疗反应在成人和儿科人群间是否相似;
(2)药物的体内暴露效应关系(Exposure-Response relationship)在成人和儿科人群间是否相似。
如果通过综合分析所有可获得的信息和数据后,结论支持(1)和(2)均相似,那么,可选择合适的儿科人群开展多剂量的单次给药PK试验,通过药物体内暴露(PK数据)的桥接,从成人剂量外推拟用于儿科人群的剂量。随后,采用拟定的剂量在特定的儿科人群开展随机对照试验,重点是获得该人群的安全性数据,同时,可以验证拟定剂量的合理性。
存在一种特殊情况,如果(1)和(2)均相似,但药物仅通过局部暴露发挥药效作用且有充分的证据支持拟用于儿科人群的剂量与成人剂量相同时(如局部外用药物),可以不再开展儿科人群的PK试验来探索剂量,仅采用拟定的剂量在特定的儿科人群开展随机对照试验,重点是获得该人群的安全性数据,同时,可以验证拟定剂量的合理性。
如果通过综合分析所有可获得的信息和数据后,结论支持(1)相似,(2)不相似或难以确定,那么,可以选择合适的儿科人群开展PK/PD试验,用以揭示该药物在儿科人群的体内暴露效应关系,并与成人的体内暴露效应关系进行比较。如果证明可以外推,则采用拟定的剂量在特定的儿科人群开展随机对照试验,重点是获得该人群的安全性数据,同时,可以验证拟定剂量的合理性。如果比较结果提示不具备外推成人疗效数据的条件,那么,需开展全面系统的儿科人群药物临床试验。
如果通过综合分析所有可获得的信息和数据后,结论支持(1)和(2)均不相似或难以确定,不具备外推成人疗效数据的条件,那么,需开展全面系统的儿科人群药物临床试验。
以上方法也适用于决策(或推断)大年龄段儿科人群的药物临床试验数据向低龄儿科人群的外推。
5.2. 国外儿科人群数据的外推
在国外已有儿科人群药物临床试验数据的情况下,首先应评价不同国家或地区的疾病流行病学、病因、发病机理和疾病进展预后等是否存在差异;在此基础上,评价国内外成年患者试验数据中,重点针对种族差异进行评价,包括是否存在临床药理学和治疗学(医疗实践、安全有效性数据)等方面的差异,如在上述各方面差异性比较中有充分证据表明不存在显着差异,可以沿用国外儿科人群药物临床试验数据。
5.3. 已有文献或其他支持性数据的外推
原则上,前瞻性研究是作为制定和完善说明书的重要依据。但就儿童用药而言,有一些药物已在儿科人群的临床实践中广泛超说明书使用。这些广泛超说明书使用的儿童用药通常都可以查询到大量国内外临床应用的文献,包括研究者发起的各类研究,有的儿童用药信息已被纳入临床用药指南,有的已被制定成为专家共识。此类已有大量相关文献信息的药物,在采用已有信息作为修订、完善说明书中儿科人群用药信息的主要依据时,应按照回顾性数据汇总分析的方法和标准进行研究和评价。
对于多个独立开展的各类研究结果进行文献汇总和分析时,应采用Meta分析的方法。目前,Meta分析方法已建立针对多个不同来源数据(包括文献数据的汇总分析以及将该分析作为关键性证据)的体系。虽然,与前瞻性研究的提出假设、再验证假设的过程相比,回顾性研究在客观性和稳健性方面存在不足,但在一些特定情况下,例如对于难以实施大规模确证性研究的儿科用药,通过Meta分析的方法,采用系统的回顾性研究,仍可以形成较为确定和可靠的结果,用于支持说明书的完善和修订。
在采用Meta分析时,应严格按照Meta分析方法学的要求,预先制定分析计划,全面和系统地收集所有相关研究的信息,并逐个进行严格的评价和分析,根据每个研究的质量不同分别进行处理,再用定量合成的方法对资料进行统计学分析,最终得出综合的结论。同时,在针对每个临床试验进行评价时,除关注研究设计的质量,还应考虑数据质量,保证纳入分析的数据具备真实可靠性和完整性。
英文缩写
GCP:Good Clinical Practice,药物临床试验质量管理规范
ICH:International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,人用药品注册技术规范国际协调会
M&S:Modeling and Simulation,建模模拟
PK: Pharmacokinetics,药代动力学
PD: Pharmacodynamics,药效学
参考文献
[1] Reflection paper on extrapolation of efficacy and safety in paediatric medicine development(Draft),EMA,2016年4月1日发布。
[2] Concept paper on extrapolation of efficacy and safety in medicine development,EMA,2013年3月19日发布。
[3] Julia Dunne, William J. Rodriguez, M. Dianne Murphy, et al. Extrapolation of Adult Data and Other Data in Pediatric Drug-Development Programs, Pediatrics, 2011, e1242-e1249.
[4] Efthymios Manolis, Cerard Pons, Proposals for Model-based Paediatric Medicinal Development within the Current European Union Regulatory Framework, British Journal of Clinical Pharmacology, 2009,68(4): 493-501.
[5] 儿科人群药代动力学研究技术指导原则, CFDA-CDE, 2014年7月11日发布。
[6] 儿科人群药物临床试验技术指导原则, CFDA-CDE,2016年3月7日发布。
来源:国家食药监总局药审中心
为你推荐
 资讯
资讯 11.8亿美元!德琪医药自免TCE双抗ATG-201授权优时比
德琪医药将其自主研发的CD19 CD3双特异性T细胞连接抗体(TCE)ATG-201的全球开发、生产及商业化独家权益授予优时比,用于治疗B细胞相关自身免疫性疾病。
2026-03-04 20:05
 资讯
资讯 君实生物被调出科创50
近日,上海证券交易所,中证指数有限公司联合发布《关于科创50等指数一季度定期调整结果的公告》,本次调整,调入3家,调出3家,其中君实生物被调出科创50指数,此次调整将于202...
2026-03-04 15:30
 资讯
资讯 吉利德比克替拉韦与来那帕韦单片治疗方案在更换抗反转录病毒治疗药物的 HIV 感染者中维持病毒学抑制
新型在研药物组合将全球指南推荐、具有高耐药屏障的整合酶链转移抑制剂比克替拉韦,与同类首创衣壳抑制剂来那帕韦相结合
2026-03-04 13:41
 资讯
资讯 全球首创便携式宫颈无创光动力治疗药物希维她在华获批
CIN2的治疗决策一直是妇科宫颈上皮内病变治疗临床实践中的核心挑战,宫颈环形电切术(LEEP)等切除性手术虽为临床常用的治疗方案,但其可能导致宫颈结构改变、宫颈机能不全,进...
2026-03-04 13:32
 资讯
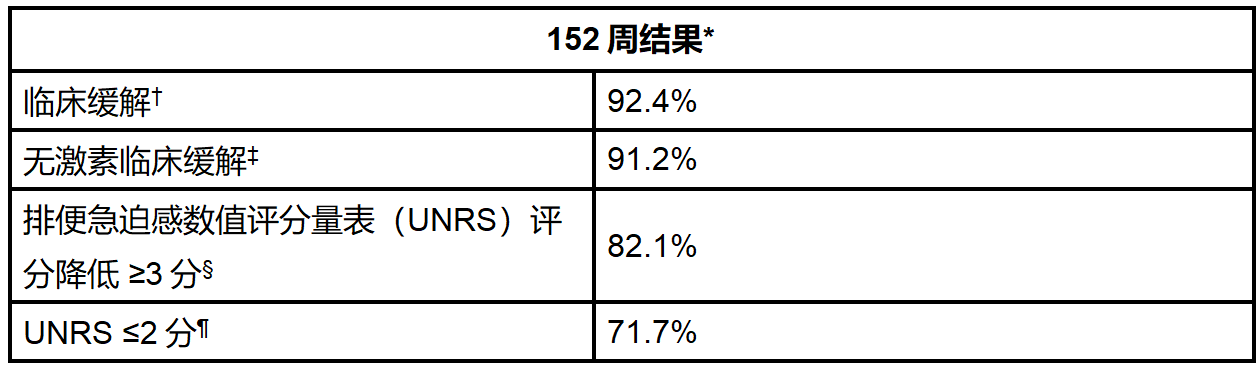
资讯 礼来安妥来利和安妥来(米吉珠单抗)可使克罗恩病患者维持长达三年的无激素缓解
具有里程碑意义的VIVID-2研究数据显示,在治疗后一年实现无激素缓解的患者中,超过90%在三年内仍维持无激素缓解
2026-03-04 13:22
 资讯
资讯 甘李药业一款PROTAC在研药品获批临床试验
3月2日晚间,甘李药业发布公告,在研药品 GLR2037 片的取得国家药监局《药物临床试验批准通知书》。受理号为 CXHL2600098、CXHL2600099,通知书编号为 2026LP00526、2026LP0...
2026-03-03 13:51
 资讯
资讯 非共价(可逆)BTK抑制剂匹妥布替尼获批新适应症
3月2日晚间,信达生物发布公告,公司与礼来中国共同宣布非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)正式获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗既往经过...
2026-03-03 13:19
 资讯
资讯 ICON发布2025年中国生物技术行业调研报告:中国创新领跑全球,95%受访者对未来充满信心
调研显示,中国正成为全球药物创新关键引擎,在细胞疗法、心血管及肿瘤领域持续领跑,AI应用与全球化布局正驱动行业发展
2026-03-03 10:58
 资讯
资讯 国家卫健委:做好《生物医学新技术临床研究和临床转化应用管理条例》贯彻落实
近日,国家卫健委科教司发布《做好 贯彻落实,高质量满足人民群众健康需求,支撑生物医药产业更高水平发展》,表示,距离《条例》正式施行已不足三个月,相关配套文件正在加紧...
2026-03-02 14:23
 资讯
资讯 百济神州的业绩
2月27日,百济神州发布2025年业绩快报,报告期内,公司产品收入为377 70亿元,较上年同比上升39 9%,上年同期产品收入为269 94亿元,公司营业总收入为382 05亿元,较上年同...
2026-03-01 23:03
 资讯
资讯 国家卫健委启动为期3年的卫生健康领域科研诚信专项治理
近日,国家卫生健康委印发《加强医学科研诚信专项治理的工作方案》,启动实施为期3年的卫生健康领域科研诚信专项治理。
2026-03-01 17:57
 资讯
资讯 新版《人体生物监测质量保证规范》国家标准明日实施(附全文)
市场监管总局(国家标准委)批准发布了《人体生物监测质量保证规范》国家标准,该标准由国家疾病预防控制局组织起草,自3月1日起正式实施。
2026-02-28 14:04
 资讯
资讯 全球首个罕见病AI诊断系统启动全国多中心验证研究
2月28日,上海交通大学医学院附属新华医院在国际罕见病日系列活动现场,启动DeepRare真实世界临床验证全国多中心研究。
2026-02-28 10:54
 资讯
资讯 因美纳推出TruPath Genome,树立基因组洞察新标准
2026年2月24日,因美纳(纳斯达克股票代码:ILMN)宣布推出TruPath™ Genome,为遗传病研究领域的高质量、全面的全基因组洞察树立新标准。
2026-02-27 12:04
 资讯
资讯 济川药业引入国产非激素类创新药为湿疹治疗添新解
济川药业(股票代码:600566)宣布与泽德曼医药正式签署合作协议,济川药业将获得泽德曼医药泽立美®本维莫德乳膏在中华人民共和国(不含香港、澳门特别行政区和台湾地区)的独...
2026-02-27 11:54
 资讯
资讯 因美纳发布NovaSeq X创新升级路线图: 数据质量、读数产出、速度与灵活性全面提升
读数产出提升40%至350亿、最高可达Q70质量分值、更快周转时间与“交错启动”等升级将陆续面向所有NovaSeq X测序仪推出,推动精准医疗发展,并为客户带来持续叠加价值
2026-02-27 11:42





