昨日(3月4日),CFDA官网正式发布了《化药注册分类改革工作方案》,相比2015年11月发布的《征求意见稿》,正式方案中做出了如下变化:
1、先来一点口味轻的,循序渐进,别一下子掉了下巴。光学异构体归类为2类改良型新药,比较科学,不足为奇。
2、征求意见稿将改晶型定义为改良型新药,意味着仿制药必须保持晶型一致。而我们都知道,晶型专利一般晚于化合物专利5年左右,如果仿制药强制要求晶型一致,无疑等于延长了原研药品的五年保护期,对仿制极为不利。故而,本条被很多业内人员痛骂丧权辱国。
正式版中,晶型描述已被去掉,算是对仿制药企业有了一个满意的交待。但别高兴太早,请看下一条!
3、虽然改良型新药中去掉了改晶型,但纳入了“新处方工艺”。这意味着,仿制药必须保持与原研药品的处方、工艺完全一致。我的个天呐,哪天我去原研药厂偷处方、偷工艺,别惊讶,别拦着我!和晶型类似,如果原研药企保护了处方、工艺,同样会延长产品的保护周期。
4、重申一下:仿制药必须与原研药品保持活性成份、剂型、规格、适应症、给药途径、用法用量、处方工艺的一致。这里面包含了两条重要信息:
(1)征求意见稿是“与参比制剂相比”,正式稿中为“原研药品”。自然,会有一大批找不到原研药品的品种,永远无法被仿制了,只能走进口注册。在欧美,原研退市,而仿制药在销售的情况比较普遍哦!另外,这里面很受伤的品种,必然包括一批儿童药!
但反过来看,对原研退市、国内已上市的仿制药品种,若能通过一致性评,则有幸“后无来者”,被政策保护起来!
(2)改规格、改用法用量不属于仿制药、不属于改良型新药,去了哪里?呵呵呵,显然被纳入了补充申请。就是说,不允许你直接乱改,要改必须先有仿制药才行。
5、原征求意见稿中,对“含有已知活性成份的新用法用量和新规格的制剂”,给了3年监测期。正式版中,这一条被爽快地干掉了。
6、含有未知活性成份的新复方制剂,没有出现在任何分类中,成为黑户。单方必须先上市,才能开发复方喽。
7、老3类品种有两种选择:
(1)若按原注册分类审评审批,则可能获得新药证书。
(2)若申请按新注册分类审评审批,则成为仿制药,但可以加速审评,早死早升天。
8、5.2类药品要大热了!某些企业有望墙外开花墙内红了!
正式稿化学药分类标准
征求意见稿化学药分类标准
正式稿中化学药品新药监测期限表
征求意见稿中化学药品新药监测期限表
总之新的化药分类,是上市许可持有人制度及新药审批改革中重要的一环,只有将类别界定清楚,才能在后续的各项改革中有统一的口径推进。
然而,化药分类的变化,也势必会给新一轮药品采购的推行带来一定影响。由于各省在进行质量分层和经济技术标评分中对新药、首仿、原研药做出名词解释,新分类办法的出台,会不会导致各省方案也跟着调整?如果调整,难免会给原有的招标采购层次划分竞价分组带来一定的冲击。
总局关于发布化学药品注册分类改革工作方案的公告(2016年第51号)
根据2015年11月4日第十二届全国人民代表大会常务委员会第十七次会议审议通过的《关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》,国家食品药品监督管理总局制定了化学药品注册分类工作改革方案,已经国务院同意,现予以公告,并自公告发布之日起实施。
附件:化学药品注册分类改革工作方案
食品药品监管总局
2016年3月4日
附件 化学药品注册分类改革工作方案
为鼓励新药创制,严格审评审批,提高药品质量,促进产业升级,对当前化学药品注册分类进行改革,特制定本工作方案。
一、调整化学药品注册分类类别
对化学药品注册分类类别进行调整,化学药品新注册分类共分为5个类别,具体如下:
1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
原研药品指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。
4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与原研药品的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
表1 化学药品新注册分类、说明及包含的情形
注:
1.“已知活性成份”指“已上市药品的活性成份”。
2.注册分类2.3中不包括“含有未知活性成份的新复方制剂”。
二、相关注册管理要求
(一)对新药的审评审批,在物质基础原创性和新颖性基础上,强调临床价值的要求,其中改良型新药要求比改良前具有明显的临床优势。对仿制药的审评审批,强调与原研药品质量和疗效的一致。
(二)新注册分类1、2类别药品,按照《药品注册管理办法》中新药的程序申报;新注册分类3、4类别药品,按照《药品注册管理办法》中仿制药的程序申报;新注册分类5类别药品,按照《药品注册管理办法》中进口药品的程序申报。
新注册分类2类别的药品,同时符合多个情形要求的,须在申请表中一并予以列明。
(三)根据《中华人民共和国药品管理法实施条例》的有关要求,对新药设立3—5年监测期,具体如下:
表2 化学药品新药监测期期限表
(四)本方案发布实施前已受理的化学药品注册申请,可以继续按照原规定进行审评审批,也可以申请按照新注册分类进行审评审批。如申请按照新注册分类进行审评审批,补交相关费用后,不再补交技术资料,国家食品药品监督管理总局药品审评中心要设立绿色通道,加快审评审批。符合要求的,批准上市;不符合要求的,不再要求补充资料,直接不予批准。
(五)新注册分类的注册申请所核发的药品批准文号(进口药品注册证/医药产品注册证)效力与原注册分类的注册申请核发的药品批准文号(进口药品注册证/医药产品注册证)效力等同。
(六)国家食品药品监督管理总局组织相关部门细化工作要求,做好受理、核查检查、技术审评及制定、修订相关国家药品标准等工作。
(七)《药品注册管理办法》与本方案不一致的,按照本方案要求执行。
来源:医谷综合
为你推荐
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
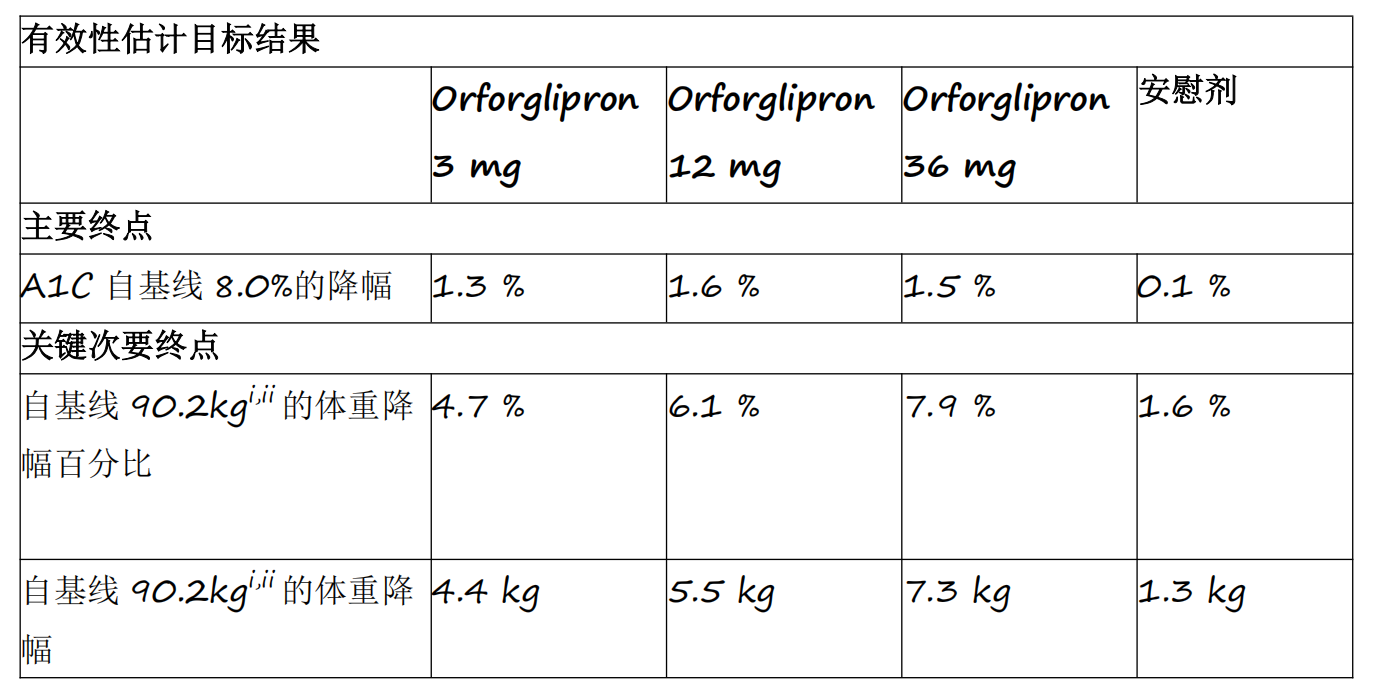
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12
 资讯
资讯 扬帆出海正当时:Cytiva 为中国生物药企绘制全球合规航海图
峰会聚焦法规解读、国际监管环境、中国生物药企业出海案例等关键议题,通过专家分享和深入解读,为中国生物药企提供全球化战略指导和合规支持;
2025-04-15 17:00
 资讯
资讯 全国肿瘤防治宣传周:礼来携手信达生物、和黄医药加速赋能本土医药创新
礼来携手本土合作伙伴信达生物、和黄医药齐聚上海,共话本土医药创新发展,探索加速惠及中国肿瘤患者的新模式
2025-04-15 16:27
 资讯
资讯 ADC明星企业映恩生物港交所上市,开盘高开91.33%
上市首日,其股价开盘高开91 33%,随后涨幅迅速扩大至127 06%,午间收报214 80港元,市值突破178 66亿港元,成为近年来港股18A生物科技公司中最亮眼的IPO案例之一。
2025-04-15 13:19