美国制药巨头辉瑞(Pfizer)近日宣布,欧盟委员会(EC)已批准口服靶向抗癌药Xalkori(crizotinib)扩大使用的产品标签更新,用于一线治疗间变性淋巴瘤激酶(ALK)阳性晚期非小细胞肺癌(NSCLC)成人患者。Xalkori的产品特性概要(SPC)也已更新,纳入了PROFILE 1014研究的疗效数据,该研究表明,在先前未接受治疗的ALK阳性晚期非鳞状NSCLC患者中,与标准的含铂化疗方案相比,Xalkori显着延长了无进展生存期(PFS)。
辉瑞表示,欧盟批准Xalkori一线治疗,将加强Xalkori作为一种标准护理方案在ALK阳性晚期NSCLC群体中的地位。这一里程碑进一步强调了早期和常规生物标志物检测在晚期NSCLC患者中的重要性,以便这些患者可被识别并接受恰当的治疗。
Xalkori一线治疗的获批,是基于III期PROFILE 1014研究的数据。该研究是一项全球性、随机、开放标签、双组研究,评估了Xalkori在先前未接受治疗的ALK阳性晚期非鳞状非小细胞肺癌(NSCLC)的疗效和安全性。
Xalkori(crizotinib,克唑替尼)是一种靶向间变淋巴瘤激酶(ALK)、ROS1和MET的小分子酪氨酸激酶抑制剂(TKI),于2011年获FDA批准用于ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。
Xalkori是全球上市的首个ALK抑制剂,目前已获80多个国家批准。在临床上,Xalkori被公认为ALK阳性晚期NSCLC的标准护理疗法。该药的上市,极大地改变了ALK阳性晚期NSCLC患者的临床护理。迄今为止,在全球范围内,已有超过2万例患者接受了Xalkori治疗。
参考文献
来源:生物谷
为你推荐
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
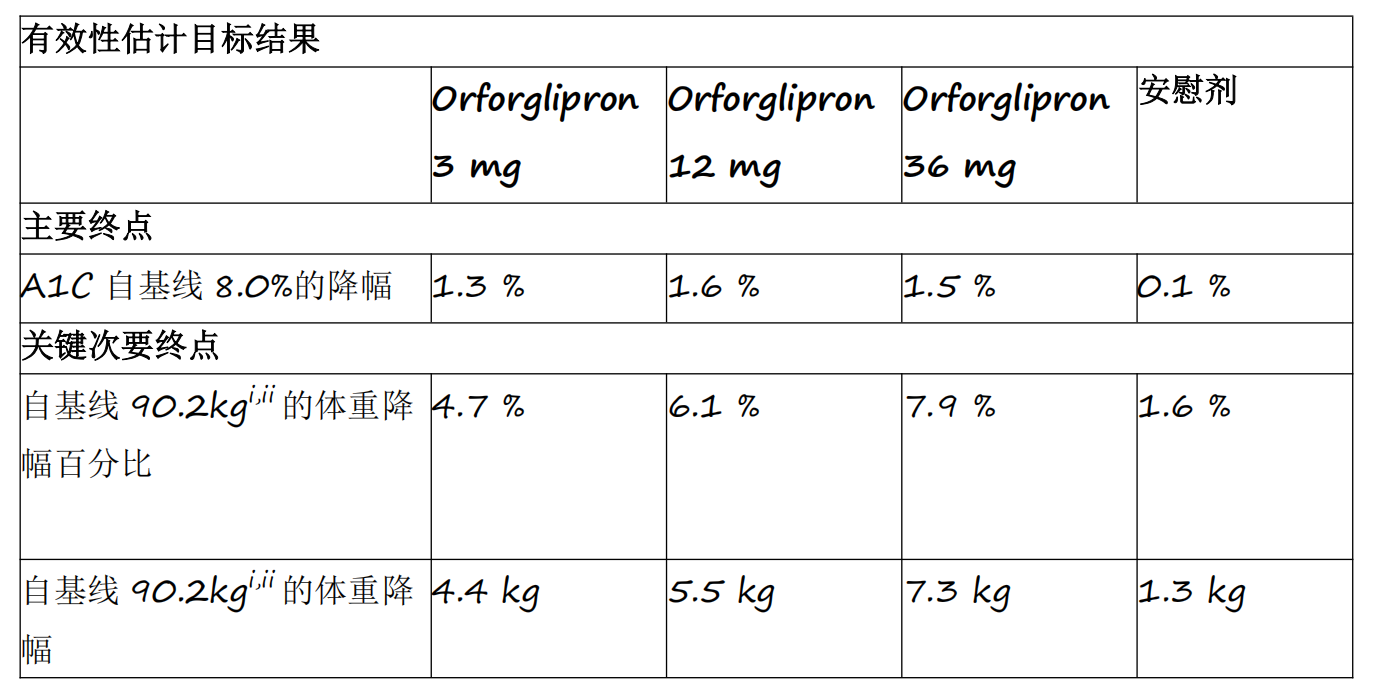
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12