CRISPR基因编辑和iPS重编程是近年来的两大热点技术。CRISPR/Cas9已经在多个领域中展现了自己强大的特异性基因靶标能力。而iPS重编程在构建疾病模型和新药开发中有着很高的应用价值。将CRISPR应用到iPS细胞中去,可以实现个性化的干细胞治疗,造福多种遗传学疾病的患者。
Morgridge研究所和Murdoch儿童研究所(MCRI)的研究人员,将重编程与CRISPR基因组编辑结合到一个步骤中,显着缩短了生成基因校正干细胞的时间,是实现个性化细胞疗法的重要一步。
干细胞能够分化成为机体内任何类型的细胞,既是研究人体早期发育的理想工具,也是细胞治疗的宝贵资源。胚胎干细胞很适合临床使用,但获得这些细胞会破坏胚胎,有很大的伦理争议。2006年日本科学家山中伸弥开发了一个变通方案,将四个基因引入特化的成体细胞(比如患者的皮肤细胞),将其重编程为诱导多能干细胞(iPS细胞)。这些细胞在实验室中表现出与胚胎干细胞相似的能力,又避开了胚胎干细胞的伦理问题,在疾病模拟、药物筛选和细胞治疗中有着巨大的应用前景,被人们视为细胞疗法的新希望。
细菌一直在与病毒或入侵核酸进行斗争,为此它们演化出了多种防御机制,CRISPR/Cas适应性免疫系统就是其中之一。规律成簇的间隔短回文重复CRISPR与内切酶Cas9的组合,可以在引导RNA的指引下,靶标并切割入侵者的遗传物质。 2012年研究者们利用这一特点,将CRISPR系统发展成了强大的基因组编辑工具。
几乎所有实验室都可以很方便的进行CRISPR基因组编辑,你只需要在自己感兴趣的细胞或生物中表达Cas9内切酶和引导RNA(gRNA)。内切酶Cas9会在gRNA的指导下引入位点特异性的双链断裂,然后细胞通过同源重组进行修复,最终改写基因组的特定位点。(延伸阅读:遗传学大牛最新文章:CRISPR编辑iPS细胞的脱靶情况)获得基因修饰的诱导多能干细胞(iPSC)通常包括许多步骤,比如长时间的细胞培养、药物筛选和数次克隆,差不多要花三个多月。现在,Sara Howden博士及其同事在短短两周内就从患者皮肤细胞获得了基因修复的干细胞。这一成果发表在十一月十二日的Stem Cell Reports杂志上。
治疗性细胞的制备主要包括两个基本步骤:第一,将成体细胞重编程为多能干细胞,以便分化为治疗所需的细胞类型;第二,通过基因编辑技术校正细胞内的致病突变。研究人员成功把这两个步骤结合在一起,通过电穿孔向患者特异性成纤维细胞同时引入加型重编程载体和CRISPR/Cas9系统。他们将这一技术用于两个独立的成纤维细胞系(分别来自患有视网膜色素变性的成人和患有严重联合免疫缺陷病的婴儿),靶标效率达到了全部iPS 细胞的8%。
“我们这个方法可以为患者及时提供经过基因校正的细胞,有助于推动细胞治疗的实际应用,”Howden说。“用患者特异性的iPS细胞进行治疗,在时间上往往很难实现,”文章的资深作者,干细胞先驱James Thomson说。“再加上校正基因缺陷,简直就是不可能完成的任务。我们需要培养细胞、分析细胞、校正细胞并诱导其分化,这一过程很漫长。”
“Dr. Howden将重编程与CRISPR基因校正结合为一步,大大减少了所需的时间,”Thomson补充道。研究人员指出,这种方法显着缩短了细胞培养阶段,可以降低与体外培养有关的风险,比如基因组不稳定或者表观遗传学改变。
激酶JAK3发生突变会导致严重联合免疫缺陷病(SCID)。对于患有SCID的孩子来说,一次轻微的病毒感染都可能致命,因为他们的免疫系统并不完整。SCID患者的血液循环中缺乏T细胞和自然杀伤细胞(NK细胞),B细胞数量正常但机能低下(T–B+NK–)。这些患者往往需要紧急的医疗干预,这项研究提供的快速方法在这种情况下非常有优势。
这项研究向人们展示了同时进行重编程和基因校正的快速策略。这一过程只需要一次克隆,不用进行药物筛选,实现“无缝”的单碱基对改变。下一步,研究人员打算将自己的方法用于血液样本,以便进一步加快整个进程。因为皮肤细胞在开始重编程以前还需要扩增几个星期。
来源:Ebiotrade
为你推荐
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
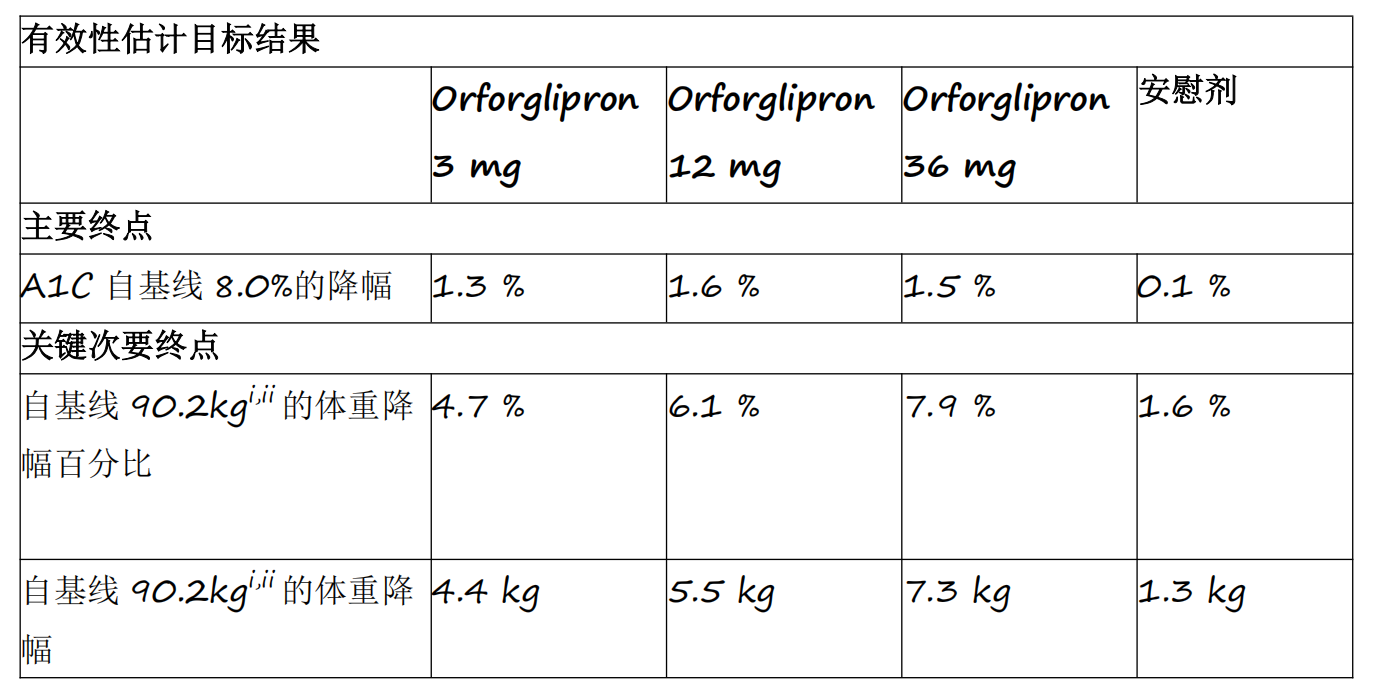
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27









