此前,《GSK天津工厂因质量控制原因被EUDRA宣布撤销GMP资质而不得不停业》,在近日,据美国食品药品监督管理局称,辉瑞集团在中国大连的一家子工厂生产的药品在出口到美国接受检测时,被查出药品质量不合格,生产记录不符合官方规范。
今年4月,美国食品药品监督管理局对辉瑞集团旗下一家位于中国大连的工厂进行检验。药监局检察员在这次检验报告中说这家工厂的员工故意掩盖产品质量问题,使用过期或者长期未检验的原材料进行生产,并强行反复检测不合格产品,直到这些产品通过检测。
据彭博社消息,这份报告代号Form483,披露了许多检查细节。辉瑞集团发言人MackayJimeson承认这家工厂确实为辉瑞集团所拥有。
“对于这次药监局对我们在大连的工厂进行批准前现场检查过程中揭露出的问题,辉瑞集团会予以回复并加以解决。”Jimeson在一份电子邮件声明中说,“药监局Form483检查报告没有涉及任何产品质量或安全问题,不会对目前市面上我们这所大连工厂生产的产品产生任何影响。顾客安全是辉瑞集团至高无上的优先重点,辉瑞集团将始终致力于保障我们生产的药品质量和安全。”
至于药监局报告中具体指控哪种药品不符合生产规范,Jimeson没有透露。药监局也拒绝对这份报告作任何评论。在某药品拿到出口美国许可之前对其生产厂家进行检查,是美国食品药品监督管理局的一贯做法。
不翼而飞的文件
药监局的这份报告称,这家大连工厂在接受检查过程中故意隐藏生产记录。药监局检察员说他们在一间房间里发现了一摞20厘米高的文件,结果他们离开了10分钟后,这摞文件就不翼而飞了。当工厂负责人被问及这摞文件到哪去了时,负责人只拿出了1/3的文件出来。
“当时我们就要求工厂将拿走那摞文件的人找出来,结果发现那个人将剩下2/3的文件藏到了楼上的木箱里。”药监局检察院在报告中写道。
生产记录
报告称,那摞不翼而飞的文件正是该工厂一组生产记录。这些文件中记录的药品生产批号、生产过程中的温度和湿度条件以及产量均与工厂正式生产记录不符。检察院在其中缺失的两页文件上发现了一些便笺,上面记录说一些药品原材料在接受再次检测时就已经过期或接近过期日限了。
此前彭博社也对类似的一起事件报道过,涉及为西方制药公司供应药品原材料的中国供应商。
其他工厂
今年早些时候,美国食品药品监督管理局,对浙江海正药业股份有限公司和浙江海翔药业股份有限公司拥有的多家制药工厂进行了检查,发现这些工厂均存在生产数据不完整的问题。这两家药业公司都为许多美国药品的生产提供原材料。据2012年纽约胜券交易所备案显示,浙江海翔药业股份有限公司与辉瑞集团下属亚太生产有限公司签署了为期长达20年的抗生素产品供应协议。
辉瑞集团称已经注意到了海翔药业公司在生产过程中存在的问题,并已经采取措施保障其药品质量不会出现问题。
浙江海正药业股份有限公司也表示正在解决其下属工厂存在的问题,称已对有问题产品进行了反复检验,并达到了合格标准。对于药监局这次检查的其他细节,海翔药业公司拒绝做任何评论。
据药监局检察员介绍,辉瑞大连工厂在药品未通过测试标准时,会将另一份合格药品代替测试未通过药品进行测试,产生出测试合格结果。这样,未通过测试的不合格药品既不会被上报,也不会再被检查。
药监局检察员还注意到,这家工厂一个生产单位中只有一间厕所,与无菌生产间只相距45米。并且其中没有洗手设施,厕所地上有一个凹坑,看起来像是便池。
来源:中国青年报
为你推荐
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
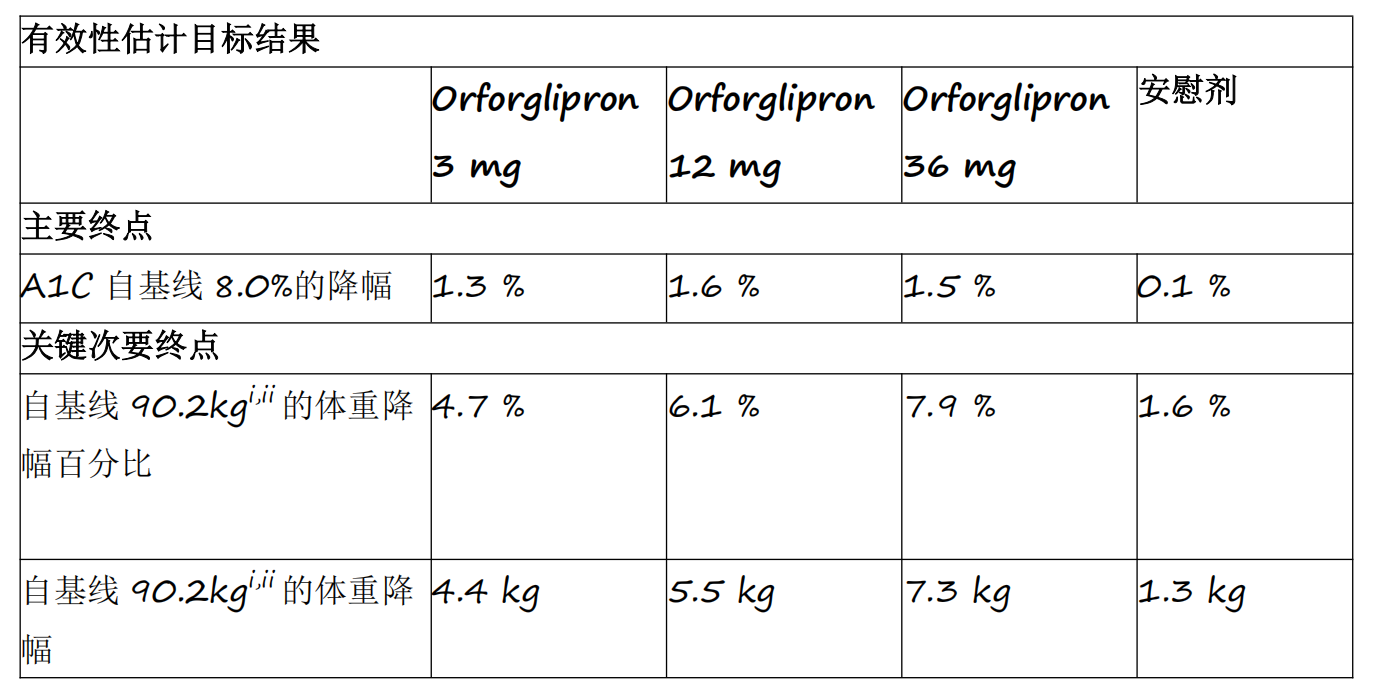
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12