经皮冠状动脉介入治疗(PCI)也称血管成形术(angioplasty),是一种经皮穿刺周围动脉,将球囊导管及(或)支架等治疗器械送至冠状动脉,扩张、疏通冠状动脉狭窄病变的一种心脏导管治疗技术。根据美国疾病和控制中心的数据,在美国每年有大约5万人进行PCI疗法。在中国自1977年第一例经皮冠状动脉介入治疗开始,PCI已经成为挽救冠心病患者最有效的疗法之一。
今天美国FDA批准了Medicine's Company的抗血小板注射剂cangrelor上市(商品名:Kengreal),用于避免成人患者在经皮冠状动脉介入治疗(percutaneous coronaryintervention,PCI)过程中因凝血造成的冠状动脉堵塞。和其它抗血小板药物一样,Kengreal最严重的风险是大出血,有时甚至危及生命。在一个有1万余人参与的头对头比较Kengreal和Plavix(氯吡格雷)的临床实验中,Kengreal和氯吡格雷相比更能显着降低心肌梗死的发生率,尽管两个组的严重出血事件发生率都比较低,但Kengreal组(1/170)高于氯吡格雷对照组(1/275)。
Cangrelor是P2Y12的可逆抑制剂。最早由英国的一个小公司开发,后被阿斯利康收购。也是口服可逆抑制剂Brilinta开发过程中的一个早期tool compound。结构上Cangrelor含有一个三磷酸所以Cangrelor不仅不能口服而且半衰期也很短,只有几分钟。2003年Medicine's Company从阿斯利康手里收购了Cangrelor的开发权,并且调整了开发方向,利用了Cangrelor半衰期很短的特点开发手术用药。Cangrelor的超短半衰期因此成为一个优势,手术后一停药药效很快消失,理论上降低了出血风险。
尽管如此Cangrelor的开发饱受磨难。在2个大型3期临床实验中Cangrelor作为心脏搭桥手术用药和氯吡格雷相比没有显示任何优势。但是Medicine'sCompany百折不挠,又做了第三个3期临床,结果显示对稳定心绞痛患者有更好疗效。但FDA专家组在2014年2月还是以7票反对,2票赞成的投票结果拒绝了Cangrelor用于心脏搭桥手术。而且所有专家反对Cangrelor作为急性心脏病患者手术前的抗凝药。两个月后FDA也正式拒绝了Cangrelor的上市申请。
Medicine's Company随后又更明确了实验终点、缩小了适用人群并再一次申报上市。今年4月15日FDA专家小组终于以9:2的投票结果支持Cangrelor作为二线药物上市。2015年1月,Cangrelor获得EMA批准在欧盟上市。至此Cangrelor虽然历经磨难但终于熬成正果,但因为氯吡格雷专利过期且临床优势微弱,Cangrelor的销售峰值已经远远低于之前的4亿美元。RBC Capital Market分析师Adnan Butt预计Cangrelor在美国的销售峰值大约8千万至1亿美元。
来源:汤国平看医疗
为你推荐
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
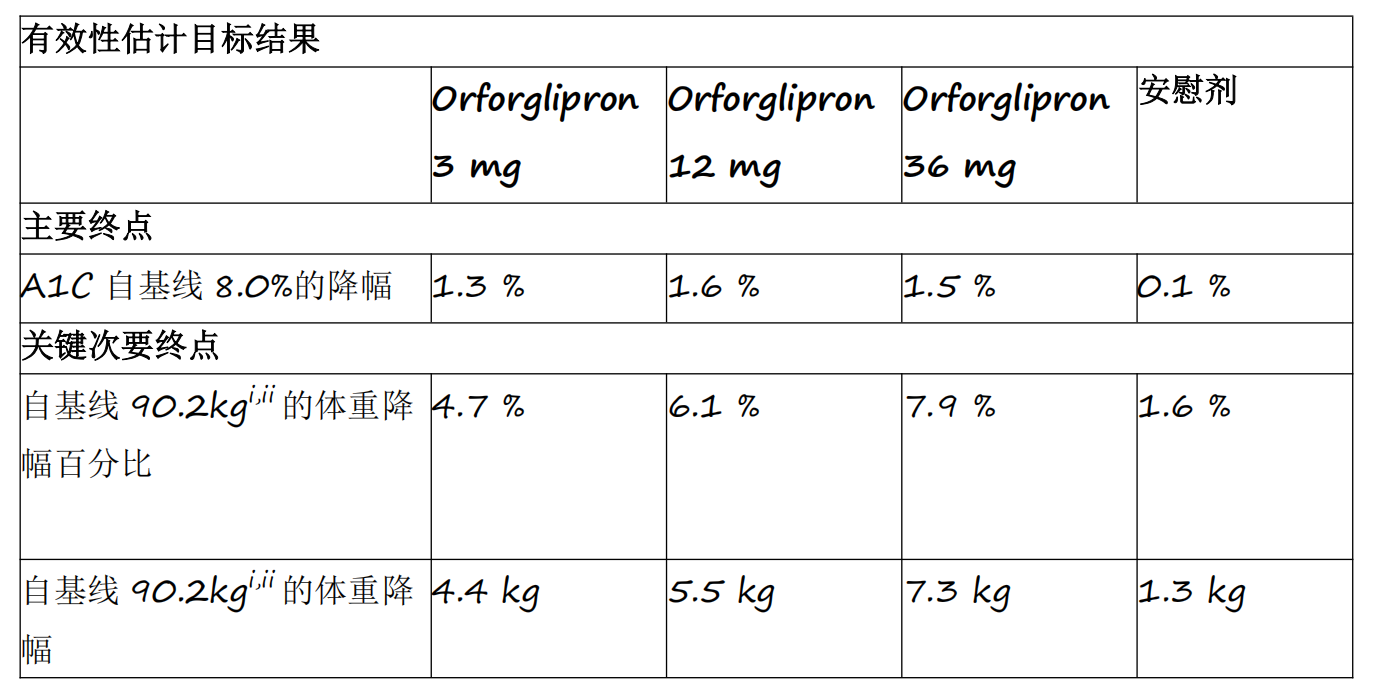
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27









