引言
2020年11月9日国家药监局基于大规模前瞻性临床试验数据批准了体外诊断试剂创新产品“KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)”上市应用,预期用于对肠镜依从性差的结直肠癌高风险人群的筛查。产品技术审评报告在器审中心网站同步公开。该产品的获批上市受到医疗器械行业的广泛关注,一方面是由于“筛查”产品广泛的受众将带来高额的市场价值,另一方面,更多的原因在于临床对于癌症“早筛早诊”的强烈需求。
本文将对国内外结直肠癌筛查方法及批准现状进行简要介绍,并特别针对FIT-DNA检测技术在结直肠癌筛查中的应用及风险受益进行分析,最后结合临床需求对结直肠癌筛查产品的临床评价要求进行总结。
一、结直肠癌筛查方法及国内外现状
结直肠癌是最常见的恶性肿瘤之一,2018年中国癌症统计报告显示:我国结直肠癌发病率、死亡率在全部恶性肿瘤中分别位居第3位和第5位,其中新发病例37.6万,死亡病例19.1万。多数患者在确诊时已属于中晚期。
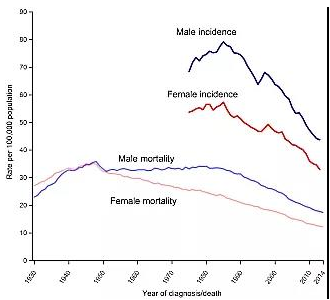
大肠癌早期多无特异性症状,疾病转归及预后与病变的分期紧密相关,晚期患者5年生存率明显降低。多项大规模研究表明,结直肠癌早诊早筛将显着降低疾病发病率和死亡率,减少疾病经济负担。世界主要发达国家均已实施针对全国人口的结直肠肿瘤早诊筛查,将其作为基本公共卫生服务,并已取得明显的成绩(图1)。而在我国,早期结直肠癌的诊断率低于10%,明显落后于发达国家。
图1:大规模筛查使美国肠癌发病率下降40%,死亡率下降51%
Rebecca L. Siegel, Kimberly D. Miller, Ahmedin Jemal. Cancer Statistics, 2017[J].CA: a cancer journal for clinicians,2017,67(1):7-30.
针对结直肠癌的早期筛查,多个国家都出台了相应的筛查指南或专家共识,其中在筛查人群、筛查程序的建议上各有侧重,但主要的筛查方法基本类似。下面结合我国2018年中国抗癌协会大肠癌专业委员会发布的《中国结直肠肿瘤早诊筛查策略专家共识》(以下简称“2018专家共识”)对几种主要的筛查方法进行简要介绍:
1.粪便隐血试验(FIT):是最为常见的筛查方法,具有价格低廉、检查便捷等优点,是我国人群筛查参与率相对较高的方法。主要不足是检测灵敏度有待提高,特别是进展期腺瘤检出率偏低,一般仅20%~30%。
2.结肠镜检查:是目前公认的灵敏度最高的大肠癌筛查方法。结肠镜下活检或切除标本的病理检查是结直肠癌确诊的金标准。以美国为代表的少数发达国家采用结肠镜检查进行一步法筛查,其他采取两步法筛查的国家,一般根据患者年龄、便隐血检查结果、结直肠癌家族史等危险因素筛选出结直肠癌高风险人群,继而进行有目的的结肠镜检查。
结肠镜检查对技术和设备要求高,检查前需要彻底清洁肠道,且作为一种侵入性检查会带来一定的痛苦和并发症风险,患者参与度不高。因而该项检查在人群筛查中受到一定限制。
3.粪便DNA检测:主要针对结直肠脱落细胞的基因突变和(或)甲基化等进行检测,有单靶点和多靶点方案,也可与FIT联合检测,是近年来的研究热点之一。具有无需特殊设备、无需限制饮食、无创等优点,主要缺点在于价格相对较高,研究数据尚在积累中,特别是缺乏长期随访研究数据,筛查间期尚不确定。
2014年美国FDA于基于一项约一万例受试者的前瞻性临床试验数据,批准了全球第一个通过粪便隐血和基因多靶点联合检测(FIT-DNA)用于结直肠癌筛查的产品。该方法已被美国疾病预防工作组等多个权威组织推荐将其应用于适龄的无症状人群结直肠肿瘤早期筛查。我国本次批准的KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)与之类似,差别在于甲基化位点选择略有不同以及适用人群不同,产品用于高风险人群筛查。
4.其他筛查方法:包括乙状结肠镜检查、结肠CT成像技术、问卷风险评估等。各种方法各有优缺点。
总的来说,各种结直肠癌筛查方法各有优势和局限,具体筛查方法的选择需要结合检查手段的利弊,执行的难易程度以及患者的身体状况、疾病背景和患者的倾向性等因素进行综合考虑。依据肠癌发生的流行病学特点,探索适合我国国情的个体化大肠癌筛查策略十分必要。
二、FIT-DNA检测的临床应用和风险受益分析
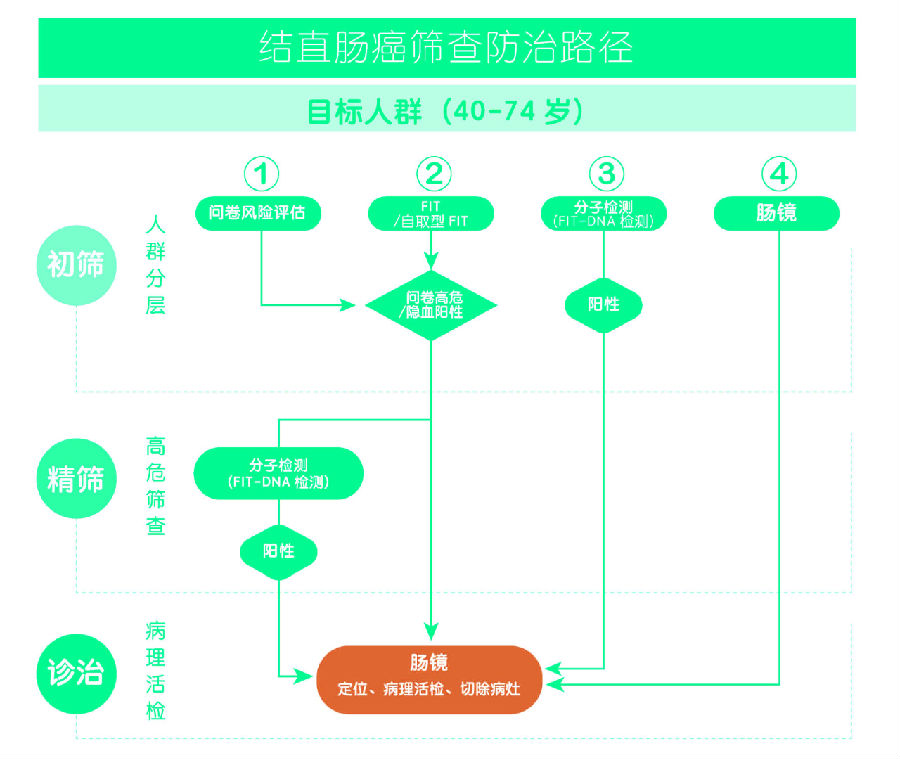
“2018专家共识”中对粪便DNA分子检测产品,特别是FIT-DNA联合检测产品在结直肠癌筛查防治路径中的应用进行了描述(图2)。第一种路径是将FIT-DNA联合检测用于平均风险人群(40~74岁,无相关症状,无结直肠癌家族史等高风险因素)的结直肠癌筛查,筛查阳性者应进行结肠镜检查。美国产品获批的预期用途与此路径一致,差别仅在于美国结直肠癌平均风险人群年龄范围与中国的推荐年龄不同,这主要是基于疾病流行病学背景的差异。第二种路径是采用FIT-DNA联合检测对经判定为结直肠癌高风险的人群(40~74岁,便潜血阳性、问卷风险评估阳性或结直肠癌家族史等)进行“精筛”,阳性受试者应进行结肠镜检查。本次批准的KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)临床预期用途即符合此路径。
图2:结直肠癌筛查防治路径(FIT 为免疫化学法粪便隐血检测技术)
中国结直肠肿瘤早诊筛查策略专家共识,中华胃肠外科杂志2018,21(10):1081- 1086
这里值得注意的是,高风险人群本身可以不经“精筛”而直接进行结肠镜检查。这也是各种结直肠癌筛查指南、共识中通常采用的筛查策略。但这一路径在实际临床实践中的实现比例并不高,主要原因在于结肠镜的依从性不佳。结肠镜检查前需要进行饮食限制和严格的肠道清洁准备,检查过程中未接受镇静/麻醉结肠镜检查的部分受检者需承受较大痛苦;而且结肠镜检查属于侵入性检查,有一定的并发症发生率,目标人群常由于畏惧而拒绝结肠镜检查。研究数据显示,即使是粪便隐血试验阳性的高风险人群,随后进行结肠镜检查的比例也仅有30%~40%;在美国等发达国家也远未实现适龄人群的结肠镜普查。此外,相对于我国庞大的人口基数,我国结肠镜资源匮乏且分布不均,尚不能满足大规模人群筛查的需要。第六次人口普查显示我国40-75岁约5.25亿人口,如果按照浙江嘉善地区(高发地区)的调查结果估算,其中高风险人群约占16.58%,即将有超过8,000万人口需要进行结肠镜检查;如果按照天津地区(低发地区)调查结果估算,其中高风险人群约占5.96%,即约有3,000万人口需要进行结肠镜检查。中国的多个结直肠癌筛查共识中均提到在中国结肠镜检查用于大规模筛查存在困难,更适宜作为个体化筛查的重要手段予以宣传推广。
KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)将产品目标人群定位为高风险人群中肠镜依从性差的人群,进一步评估受试者风险,对有必要进行结肠镜检查的人群进行“浓缩”。经临床试验数据证实,经过该方法“精筛”后,阳性受试者中结直肠癌和进展期腺瘤的检出比例为46.2%(阳性预测值),与不进行精筛过程相比,高风险人群浓缩了4.8倍,提高了结肠镜检查效率,并有助于改善高风险人群的肠镜依从性。同时,该产品检测结直肠癌阴性预测值为99.6%,即得到阴性结果的人群中约有4‰受试者可能因本检测阴性而不接受肠镜检查,导致结直肠癌疾病进展,贻误治疗。这是该产品最主要的风险点。为降低产品风险,在产品说明书中进一步提示:阴性结果并不能完全排除疾病风险,鉴于受试者为高风险人群,因此在必要时仍应建议进行肠镜检查。
综上,KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)的临床意义在于将高风险人群进一步分层,从而改善高风险人群的结肠镜依从性,促进其获得及时的诊断和治疗,避免因肠镜依从性差而导致疾病进展。同时也使有限的结肠镜资源得到更好的分配。
三、结直肠癌筛查产品的临床评价要求
此前,粪便/血浆 DNA 检测用于结直肠癌相关预期用途的体外诊断试剂在我国已有产品批准上市,包括Septin9甲基化检测试剂、SDC2甲基化检测试剂、miR-92a检测试剂等,均为单靶点检测试剂。这些产品预期用途均为:针对需要但因主观或客观原因不愿或不能进行结肠镜检查患者的结直肠癌辅助诊断,不得用于人群筛查。这样的批准方式主要基于产品的临床试验证据和临床性能水平。
按照临床试验设计基本原理,疾病筛查类产品的临床试验应针对预期的筛查人群进行前瞻性入组,入组方式可以采用序贯入组或其他保证受试者随机性的入组方式,入组人群应在一定程度上反应适用人群的流行病学规律(如发病率等)和其他特征;试验设计应采用相关疾病诊断的临床参考标准作为参比方法,评价考核试剂的临床灵敏度、特异度、阳性/阴性预测值等评价指标。其中特别是临床灵敏度和阴性预测值是疾病早筛产品非常关注的性能指标,必须达到较高的水平方能作为筛查产品上市。筛查试验入组的受试者数量应满足统计学要求。
此前批准的相关产品均未按照上述要求进行前瞻性的临床试验,仅针对结直肠癌不同分期患者和非结直肠癌患者进行富集入组,评价产品临床灵敏度和特异度,无法对产品阳性预测值和阴性预测值进行系统性评价。同时产品的灵敏度不能达到较好的水平,不足以支持其用作疾病早期筛查方法。
KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)产品在设计上对基因突变和甲基化多靶点进行联合检测,同时结合粪便潜血试验,形成一项多重指标联合检测技术,提高了结直肠癌以及进展期腺瘤的检测灵敏度。临床试验采用前瞻性筛查试验的设计,针对结直肠癌高风险人群随机入组受试者4245例,以结肠镜和/或病理检查结果为金标准,评价本产品筛查的灵敏度、特异度和阴性/阳性预测值等。入组人群在一定程度上能够反应我国结直肠癌高风险人群中结直肠癌和进展期腺瘤的发病率。结果显示该产品针对结直肠癌患者筛查的灵敏度达到90%以上,对进展期腺瘤患者筛查灵敏度超过60%;结直肠癌筛查阴性预测值达到99.6%。较以往粪便/血浆DNA分子检测产品灵敏度有显着提高,特别是针对进展期腺瘤的检出率显着提高。
基于上述临床试验数据,认为KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)针对结直肠癌高风险人群的筛查性能满足临床需求。
四、结语
KRAS基因突变及BMP3/NDRG4基因甲基化和便隐血联合检测试剂盒(PCR荧光探针法-胶体金法)采用FIT-DNA方法,通过前瞻性筛查的临床试验确认了其用于高风险人群精筛的临床用途。
同时,应该认识到该检测尚缺乏长期随访研究结果,因而筛查间期尚不确定。且作为同类产品首个批准上市的创新产品,有必要扩大数据规模,对产品的安全有效性进行进一步确认。因此批准该产品上市时,提出了上市后继续收集临床使用数据的要求,同时收集结肠镜和病理检查结果,或结直肠癌相关疾病随访结果,以进一步评价该检测在结直肠癌筛查中的确切价值,监测不良事件的发生。同时验证最适合中国人群的筛查间期。
参考文献:
[1] 中华人民共和国国家卫生健康委员会医政医管局,中华医学会肿瘤学分会。中国结直肠癌诊疗规范(2020年版)[J].中国实用外科杂志,2020,40(6):601-625.
[2] 中国抗癌协会大肠癌专业委员会中国结直肠肿瘤早诊筛查策略制订专家组。中国结直肠肿瘤早诊筛查策略专家共识[J].中华胃肠外科杂志,2018,21(10): 1081-1086.
[3] 中华医学会消化内镜学分会,中国抗癌协会肿瘤内镜学专业委员会。中国早期结直肠癌筛查及内镜诊治指南(2014,北京)[J].中华医学杂志,2015,95(28): 2235-2252.
[4] 国家消化系统疾病临床医学研究中心(上海)等。中国早期结直肠癌筛查流程专家共识意见(2019,上海)[J].中华消化内镜杂志,2019, 36(10):709-719.
[5] 詹天成,李明。2012美国医师协会结直肠癌筛查指南解读[J].中国医学前沿杂志(电子版),2012,(9):58-63.
[6] Lin JS, Piper MA, Perdue LA, et al. Screening for Colorectal
Cancer:Updated Evidence Report and Systematic Review for the US Preventive Services Task Force [J]. JAMA, 2016,315(23):2576-2594. DOI:10.1001 / jama.2016.3332.
[7] AMD W,ETH F,Church TR,et al. Colorectal cancer Screening for average-risk adults:2018 guideline update from the American Cancer Society[J]. CA Cancer J Clin, 2018,68(4):250-281. DOI:10.3322 / caac.21457.
[8] Provenzale D, Gupta S, Ahnen DJ, et al. NCCN Guidelines
Insights:Colorectal Cancer Screening, Version 1.2018 [J]. J Natl Compr Canc Netw, 2018,16(8):939-949. DOI:10.6004 /jnccn.2018.0067.
[9] Rebecca L. Siegel, Kimberly D. Miller, Ahmedin Jemal. Cancer Statistics, 2017[J].CA: a cancer journal for clinicians,2017,67(1):7-30.
[10] 郑荣寿,孙可欣,张思维,等。 2015 年中国恶性肿瘤流行情况分析[J]。 中华肿瘤杂志,2019,41 (1 ):19-28. DOI:10. 3760 / cma. j. issn. 0253-3766. 2019. 01. 005
[11] 赵丽中,张伟华,马东旺,李文,曹雅静,王宏磊,许晨,石松荔,黑君晖,王西墨。天津市大肠癌筛查初步结果分析[J].中国肿瘤临床,2015,(15):760-764.
[12] 黄秋驰,叶丁,蒋曦依,李其龙,姚开颜,王建炳,金明娟,陈坤。人群结直肠癌筛检项目成本效果分析与评价[J].中华流行病学杂志,2017,38(1):65-68.
来源:中国器审CDME 作者:何静云 胡鹏 吕允凤
为你推荐
 资讯
资讯 2025年卫生健康系统为民服务八件实事项目,地市内医疗机构之间检查检验结果互认超过200项等
全国二、三级公立综合医院均提供儿科服务,地市内医疗机构之间检查检验结果互认超过200项,常住人口超过10万的县均能提供血液透析服务等。
2025-02-24 21:43
 资讯
资讯 索诺瓦正式发布首款峰力太极AI超算力助听器,开启听力健康新篇章
该平台通过突破性的双芯片技术——超响应ERA芯片和超算力Deepsonic芯片,搭载深度神经网络DNN的超强听觉认知声音处理算法,大幅提升在嘈杂环境下的声音处理速度和解析能力
2025-02-24 11:32
 资讯
资讯 专注基因疗法的蓝鸟生物,卖了
日前,专注于基因疗法的蓝鸟生物宣布,已与一支资深的生物技术高管团队达成最终协议,由全球投资公司凯雷(NASDAQ:CG)和SK Capital Partners, LP(“SK Capital”)管理的基金对其实施收购。
2025-02-24 10:53
 资讯
资讯 记一名医药管理领域的领先者与智能创新的践行者
在中国医疗健康领域,西安友德医药有限责任公司的股东尹雪芳女士无疑是一位杰出代表,更是一位具备深厚医药专业背景和丰富管理经验的专家。凭借其在医疗及健康管理领域的卓越贡献,...
2025-02-24 10:07
 资讯
资讯 中国研究型医院学会临床研究提升工程首个成果落地:加速研究型医院建设,带动区域医疗高质量发展
2月21日,宜昌市中心人民医院与北京大学肿瘤医院签署“肿瘤临床研究协作联盟”合作备忘录,将整合双方优势资源,进一步推动宜昌市及湖北省肿瘤科研与治疗发展,让当地癌症患者在...
2025-02-24 09:30
 资讯
资讯 牵头全国生物药品联盟集采,安徽省医保局2025年重点工作任务清单
安徽省医保局2025,年,明确开展省级省际药品、耗材集采不少于1个批次;持续推进大型医用设备集采,牵头全国生物药品联盟集采;继续推进慢性病按人头付费机制建设;建立全省统一...
2025-02-23 16:22
 资讯
资讯 药价查询,药价查询,全国已有29个省、市及新疆生产建设兵团上线定点药店比价小程序
据新闻联播报道,国家医疗保障局消息,截至目前,全国已有29个省(自治区、直辖市)及新疆生产建设兵团上线定点药店比价小程序,可实现药品价格在手机上一键查询、实时比对和位...
2025-02-22 21:28
 资讯
资讯 CDE:晚期胃癌新药临床试验设计指导原则
胃癌(Gastric cancer, GC) 是我国高发的消化系统恶性肿瘤, 其新发病例数和死亡病例数分别位列我国恶性肿瘤发病和死亡的第 5 位和第 3 位。
2025-02-21 21:19
 资讯
资讯 首款依视路星趣控眼镜于上海眼镜展全球首秀 专为近视管理设计 延缓中国儿童青少年近视进展
依视路星趣控眼镜提供符合人体工程学设计的镜架,满足不同年龄段的孩子在面部结构和尺寸上的显著差异,尺码范围广,覆盖38号至50号,为3-5岁儿童,6-9岁和10-12岁青少年年龄段提...
2025-02-21 17:33
 资讯
资讯 百林科完成A+轮战略融资数亿元,多家投资机构联合投资
百林科成立于2021年9月10日,是一家专注于疫苗、抗体药物、重组蛋白、细胞治疗、基因治疗、血液制品以及其他生物制品关键工艺设备与耗材研发和制造的高科技企业。
2025-02-21 13:30
 资讯
资讯 深研生物完成超3亿元B+轮融资,越秀产业基金领投
深研生物成立于2014年,是一家专注于细胞与基因治疗(CGT)领域的高新技术企业,致力于为核心技术与设备的自主研究和开发提供整体解决方案。
2025-02-21 13:23
 资讯
资讯 阿斯利康以1.6亿美元收购珐博进中国,获得罗沙司他在中国的独家权利
昨日(2月20日)晚间,阿斯利康在其官微宣布与珐博进有限公司达成协议,将以约1 6亿美元收购珐博进中国。
2025-02-21 10:20
 资讯
资讯 快速崛起的中国创新药公司,真实生物赴港IPO
2月18日据港交所披露,真实生物科技有限公司(以下简称“真实生物“)递交上市申请书,中金公司为其独家保荐人。这家成立于2012年的生物科技企业,以创新药物研发为核心,专注于...
2025-02-20 20:57
 资讯
资讯 华东医药经皮肾小球滤过率测量设备获批,有望提供GFR监测新方法
2025年2月19日晚,华东医药(000963 SZ)公告,其全资子公司杭州中美华东制药有限公司申报的创新产品三类医疗器械经皮肾小球滤过率测量设备注册申请获得上市批准。
2025-02-19 19:15
 资讯
资讯 国采中选企业满足一定条件,可变更药品上市许可持有人及生产企业、增加规格包装等,第一批名单发布
2月18日,国家组织药品联合采购办公室发布《关于国家组织药品集中采购部分中选药品信息变更的通知(第一批)》,涉及到5批国采的15个品种。
2025-02-19 18:26
 资讯
资讯 凯米生物完成超亿元Pre-A轮融资首关,加速肿瘤治疗性疫苗全球布局
此次融资将用于加速核心产品SN3001(前列腺癌治疗性疫苗)、SN2001(慢性乙肝免疫治疗疫苗)的全球临床,以及基于SynNeogen®核心技术平台的肿瘤治疗性疫苗产品持续布局。
2025-02-19 13:50
 资讯
资讯 潜在交易金额超12亿美元,石药集团ADC癌症新药达成国际授权合作
今日(2月19日),石药集团发布公告称,其控股子公司巨石生物与Radiance Biopharma达成协议,Radiance Biopharma将获得巨石生物自主研发的重组抗人类受体酪氨酸激酶样孤儿受体1...
2025-02-19 11:21
 资讯
资讯 又一玩家加入,来自恒瑞医药的“近视神药”上市申请获受理
近日,恒瑞医药发布公告宣布,公司已经收到国家药监局下发的《受理通知书》,旗下产品 HR19034滴眼液的药品上市许可申请获得国家药监局受理。
2025-02-19 10:47
 资讯
资讯 国家医保局:医保领域2025年度第一批重点事项清单
2025年底前,全国80%左右统区基本实现与定点医药机构即时结算。基本实现医保部门与医药企业对集采药品的直接结算,加快推动与医药企业对集采医用耗材、国谈药的直接结算。
2025-02-18 21:14