2018年9月8日至9日,由苏州生物医药产业园(BioBAY)携手中国医疗器械行业协会主办的第八届中国医疗器械高峰论坛(DeviceChina 2018)在苏州国际博览中心拉开帷幕,直击当前全球经济形势下,聚产业创新之力,论中国医疗器械企业高质量发展的未来,吸引了多名国内外知名医疗器械发明家、医学家、创业者、投资人及跨国企业高层管理者等参加。
今年的会议紧跟国内外局势,以“聚产业创新之力,论国械发展之道”为主题,聚焦医疗器械行业的创新与突破,通过政府官员就政策层面的解读来更好引导行业发展规划,并通过设立四个专题分会场:人工智能及物联网、心脑血管与神经外科、体外诊断及基因测序、孵化器模式创新与创新医疗器械发展更好的关注产业焦点话题及发展趋势。
9月8日上午,上海食品药品监督局、医疗器械监管处处长林森勇就医疗器械注册人制度新进展,以及给医疗器械产业发展带来的新机遇进行了分析与梳理。
以下为主题演讲概要:
林森勇:医疗器械极大地推进了医学诊疗技术的发展,是防治重大疾病的重要基础、优化健康管理的重要保障。我国医疗器械行业从2001年到2016年年均复合增长率20%,远超全球医疗器械行业7%-8%的增速。
现行医疗器械上市审批方式是将产品注册和生产许可进行了“捆绑”。这样的“捆绑”模式,影响了创新创业的热情,不利于社会资源优势互补,延长了新产品上市时间,增加了创业者成本,也与国际通行规则不符,更不利于行业健康发展。
现在通过国务院的授权,让上海先行,把医疗器械的注册和生产分离。推行医疗器械注册人制度,核心是将产品注册和生产许可进行“分离”,将选择权的便利“放”给企业和市场,形成有利于社会化大生产的制度环境;有利于整合社会资源推动医疗器械产业链上下游分工与合作,形成先进制造优势,减少重复投资和低水平重复建设;有利于科研人才、研发机构和创新企业集聚,优化创新资源的市场配置,激发创新活力;有利于对接国际医疗器械制造通行规则,促进高端医疗器械本土制度;有利于加快创新产品上市,满足市民日益迫切的高品质健康服务需求。
通过这样的分离,企业可以变的轻资产,因此我们很多医疗器械创新者在投入非常少的情况下,就可以利用别人的资源来进行整合。有整合的能力,有管理的能力,创新的产品,就可以见到它的春天和阳光。
2017年3月31日,国务院的31号文,非常清晰的说明可以让上海自贸区来探索推进医疗器械注册人制度,委托别的医疗器械生产企业的产品;到7月份,中央又通过了深化医疗器械审批改革,把主要精神写进了申改组,颁发了42号文;2017年11月份,国务院批复了这个方案,所以国务院非常的明确让上海大胆的改,大胆的试,但是我认为苏州改革的力度比上海还要大,国务院允许自贸区内医疗器械注册人,委托医疗器械生产企业生产医疗器械。通过半年的时间,我们把这个政策落地了,国家总局同意上海先行先试。
2018年的7月6日,上海把这一项制度从浦东扩大到了全市。很快我们就会扩大到长三角。医疗器械注册人制度的核心要意是从捆绑到分离,我们走了20年,很吃力。主要是从三个方面的制度改革:目标定位上形成了创新发展的制度环境;第二块我们希望在制度的设计上,促进创新和防范风险贯穿全生命周期;第三块对标国际的最高标准和国际最高规则。
这个制度出来了以后,我们的思路就是对一切产业发展不利的因素都要松开,从固有模式和路径中解放出来。但是轻资产并不是大量积累皮包公司,资产是轻资产,但是管理是加强的。要科学的让企业的主体责任落实,责任提高。风险控制住了,监管就是有效的。
注册人制度建立的主要责任是着力构建三个体系,突破七项改革内容,落实三项保障措施。
着力构建三个体系:第一个是要建立注册人主体承担全部责任的包括体系。主体责任就是我们的注册人。第二个建立医疗器械注册人承担全部法律责任体系。第三个建立跨区域的监督检查的体系。这三个体系的制度落实过程中,企业在理解主题责任和具体落实上,有困惑,监管人员在理解上也存在差异。针对这些具体的问题,有必要制订县相应的质量责任实施指南和相关的指导原则。
实施七项改革内容:第一是允许医疗器械研发机构和科研人员申请医疗器械上市许可“丰富”医疗器械注册申请人构成;第二允许医疗器械上市许可持有人委托(长三角)内具备相应生产条件的企业生产样品;第三允许医疗器械上市许可持有人委托(长三角)内具备相应生产条件的医疗器械生产企业生产产品;第四允许委托生产企业提交医疗器械上市许可人持有的医疗器械注册证申请生产许可;第五允许医疗器械上市许可持有人多点委托生产;第六长三角内各控股子公司的医疗器械注册证可由医疗器械集团公司持有;第七允许医疗器械上市许可持有人自行销售所持有的医疗器械无需办理医疗器械经营许可或者备案,但应当具备相应的经营条件。
落实三项保障措施:强化上市后监管,各级监管部门将通过注册人选择委托方综合质量能力评审报告、运行过程的管理评审报告和年度综合质量自查报告的审查和评估,落实企业质量的主题责任;重点检查、重点监测是另一种监管手段;加强对注册人售后服务、不良事件监测与在评价等措施强化监管。加强行业自律,由上海市医疗器械行业协会发布《医疗器械注册人质量管理体系实施指南》《医疗器械注册申请人委托生产质量协议撰写指南》及生产放行和产品上市放行规则等相关质量管理要求,组织开展对企业年度质量自查报告的监督抽查,督促落实不良事件报告及再评价工作,并试点由行业发布自查自律信息,充分发挥行业质量信用自律和基础管理作用。第三方协同管理,一、鼓励注册人和受托生产企业通过ISO13485等第三方认证和评估二、委托第三方机构对注册人和委托生产企业质量管理体系运行情况系统性、真实性、可操作性和合规性进行评估,督促企业落实质量主体责任。三、要求购买商业责任险。
我国医疗器械产业已经初步形成了以长江三角区域、京津环渤海湾区域、珠江三角区域为代表的产业集聚区。未来我国医疗器械产业将向高端领域突破,产业融合将成为大势所趋,信息化和大数据将成为医疗器械市场发展的有力推手。
长三角区域是我国经济最具活力、开放程度最高、创新能力最强、人才最集中的区域之一,是“一带一路”与长江经济带的重要交汇带,战略地位重要。长三角区域生物医药产业各有侧重、互补性强、良性竞争基础好。因此,联合三省一市尽快将上海试行的医疗器械注册人制度推向长三角地区,打造长三角医疗器械创新和高质量制造产业集群,实现资源共享、联动发展。
目前,已与三省一市药品监管部门达成了一致共识,加快推进落实。上海市政府已经写进了全面推进改革开放100条中,并牵头征求三省政府意见,向国务院报告。
备注:以上演讲摘要,根据现场实录整理,未经嘉宾审核。
来源:生物探索
为你推荐
 资讯
资讯 2024年底,60岁及以上人口3.1亿,占全国人口的22.0%
年末全国人口(包括31个省、自治区、直辖市和现役军人的人口,不包括居住在31个省、自治区、直辖市的港澳台居民和外籍人员)140828万人,比上年末减少139万人。全年出生人口954...
2025-01-17 14:56
 资讯
资讯 赛诺菲荣膺“杰出雇主2025”桂冠,连续五年傲立榜首
作为10多年来首个且唯一连续五年荣获此殊荣的企业,赛诺菲再次彰显了其在企业文化、人才战略、多元发展及员工培养等方面的卓越成就。
2025-01-17 11:02
 资讯
资讯 又一款国产三代EGFR-TKI抑制剂获批上市
昨日(1月16日),据国家药监局官网显示,奥赛康药业的1类创新药利厄替尼片(limertinib ASK120067,商品名:奥壹新)获批上市,用于治疗既往接受表皮生长因子受体酪氨酸激酶抑制...
2025-01-17 10:31
 资讯
资讯 增辉生命,默沙东中国再度荣膺“中国杰出雇主”
1月16日,由全球权威的杰出雇主调研机构(Top Employers Institute)颁布的“杰出雇主2025”榜单正式揭晓
2025-01-16 22:48
 资讯
资讯 国家市场监督管理总局发布《医药企业防范商业贿赂风险合规指引》
本指引所称的商业贿赂, 是指采用财物或者其他手段贿赂交易相对方的工作人员、 受交易相对方委托办理相关事务的单位或者个人、 利用职权或者影响力影响交易的单位或者个人,...
2025-01-14 23:38
 资讯
资讯 阿斯利康与宜联生物达成临床研究合作,共同探索联合治疗创新方案
双方将共同启动一项多中心、开放性、I Ib期研究,旨在评估两款药物联合治疗在实体肿瘤患者中的安全性、有效性和药代动力学。
2025-01-14 18:36
 资讯
资讯 NVIDIA与多家行业顶尖机构达成深度合作,共促医疗健康产业蓬勃发展
在日前举办的摩根大通医疗健康大会上,NVIDIA 宣布与多家行业领先机构达成合作,这类新的合作旨在通过加速药物发现、提升基因组研究,以及利用代理式和生成式 AI 开创先进医...
2025-01-14 13:26
 资讯
资讯 老牌上市药企终止PD-1项目,计提资产减值准备1.75亿元
近日,丽珠医药集团发布公告称,对公司及下属子公司截至2024年12月31日合并报表范围内存在减值迹象的资产进行了减值测试,并对其中存在减值迹象的资产相应计提了减值准备。
2025-01-14 10:13
 资讯
资讯 尊享e生2025升级:首次全场景放开外购药械,医院药品覆盖数量再增
1月13日,众安保险举办“与10光,共生长”尊享e生十周年产品升级发布会,正式发布尊享e生2025版,并推出众安健康险未来将主打的两大产品系列——面向健康人群的“尊享系列”,以...
2025-01-13 20:17
 资讯
资讯 PLA材料的医美应用:安全与效果的双重考验
聚乳酸PLA,作为医美行业面部填充剂历经了3个时代大约20多年的发展,大体可分为1 0、2 0、3 0三个不同的时代;即1 0-结晶片状;2 0-普遍表面粗糙的多孔微球或实心微球;3 ...
2025-01-13 19:53
 资讯
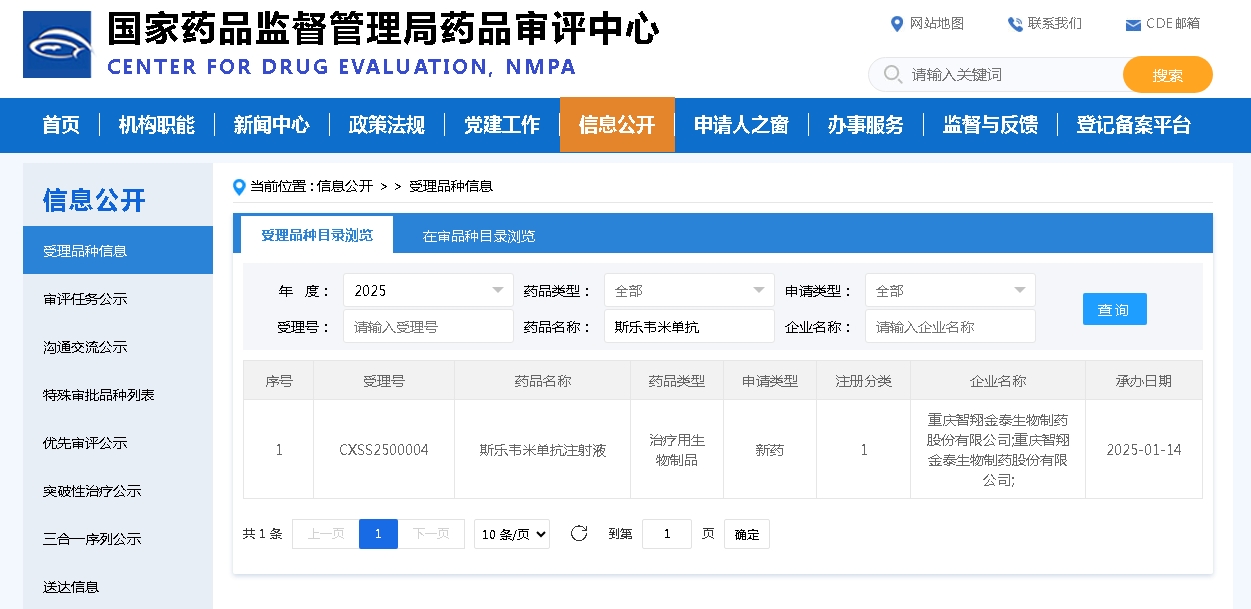
资讯 国家医保局:开展2025年定点医药机构违法违规使用医保基金自查自纠工作,肿瘤类、重症医学类、麻醉类、零售药店典型问题清单
2025年3月底前,各级医保部门根据本地化问题清单,对辖区内所有定点医疗机构和定点零售药店2023-2024年医保基金使用情况开展自查自纠。2025年4月起,国家医保局将对全国定点医药...
2025-01-13 17:32
 资讯
资讯 好大夫正式牵手蚂蚁集团,共同推进“AI+医疗”创新
蚂蚁集团收购好大夫在线尘埃落定。1月11日,在2025年好大夫峰会上,双方在收购完成后首度携手亮相。好大夫在线创始人王航现场表示,共同的使命和愿景让双方走到了一起,后续好大...
2025-01-11 18:05
 资讯
资讯 创新给药机制,全球首个口服GLP-1RA诺和忻(司美格鲁肽片)在中国全面上市
今日(1月11日),全球领先的生物制药公司诺和诺德宣布,全球首个口服胰高糖素样肽-1受体激动剂(GLP-1RA)——诺和忻®(司美格鲁肽片)在中国全面上市。诺和忻®以便利的口服...
2025-01-11 17:56
 资讯
资讯 拜耳诺倍戈(达罗他胺片)第三项适应症注册申请获NMPA受理,实现新适应症全球同步递交
日前,拜耳公司宣布,诺倍戈®(达罗他胺)联合雄激素剥夺疗法(ADT)治疗转移性激素敏感性前列腺癌(mHSPC)成年患者的新适应症申请已获国家药品监督管理局(NMPA)药品审评中...
2025-01-09 16:10