国家药品监督管理局关于发布国家医疗器械不良事件监测年度报告(2017年)的公告
(2018年第25号)
根据《医疗器械监督管理条例》《医疗器械不良事件监测和再评价管理办法(试行)》,为全面反映2017年我国医疗器械不良事件监测情况,原国家食品药品监督管理总局组织国家药品不良反应监测中心,对2017年度医疗器械不良事件监测信息进行全面分析汇总,形成《国家医疗器械不良事件监测年度报告(2017年)》,现予发布。
国家药品监督管理局
2018年5月21日
附件
国家医疗器械不良事件监测年度报告
(2017年)
为全面反映2017年我国医疗器械不良事件监测情况,及时、有效控制医疗器械上市后风险,更好地保障公众用械安全,原国家食品药品监督管理总局组织国家药品不良反应监测中心编撰《国家医疗器械不良事件监测年度报告(2017年)》。
一、医疗器械不良事件监测工作进展
2017年,医疗器械不良事件监测全体工作人员牢固树立“四个意识”、认真落实“四个最严”,全面贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,主动担当,履职尽责,监测水平及能力不断提升。各地对医疗器械不良事件监测工作的重视程度不断提高,工作推动力不断增强,不良事件监测在医疗器械全生命周期监管中发挥着日益重要的作用。
2017年,在各级食品药品监督管理部门以及医疗器械不良事件监测技术机构、使用单位、生产经营企业等的共同努力下,医疗器械不良事件监测工作平稳快速发展,风险形势整体平稳,在有效保障公众用械安全方面发挥了积极作用。同时,通过建立上市许可持有人直接报告医疗器械不良事件制度,为进一步落实上市许可持有人在上市后风险管理中的主体责任奠定了基础。
2017年是医疗器械不良事件监测工作取得丰硕成果的一年。从报告数量看,医疗器械不良事件报告突破37万份,百万人口报告数达282份,报告数量大幅增加;从报告质量看,通过狠抓医疗器械不良事件报告质量工作,报告质量不断提高;从重点监测工作成效来看,“十三五”期间100个医疗器械品种的重点监测工作稳步推进,对发现和控制医疗器械上市后风险起到了积极推动作用;通过举办第四届中国医疗器械风险管理论坛,促进了业界和监管部门医疗器械风险管理认识和水平的提高。
二、全国医疗器械不良事件报告总体情况
2017年,全国医疗器械不良事件监测工作继续稳步推进。在报告数量持续增长的同时,报告质量也不断提升,为医疗器械上市后风险的分析与评价提供了有效的数据支持。
(一)2017年全国不良事件报告总体情况
1.2013年至2017年全国不良事件报告数量
2017年,国家药品不良反应监测中心共收到《医疗器械不良事件报告表》376,157份,比2016年增长了6.49%(图2-1)。
2.死亡及严重伤害可疑不良事件报告数量
2017年,国家药品不良反应监测中心共收到死亡可疑不良事件报告211份,严重伤害可疑不良事件报告57,754份,共计57,965份,比2016年增长了10.38%(图2-2)。2017年死亡及严重伤害可疑不良事件报告数占报告总数的比例为15.41%,比2016年增长了0.54%。
3.每百万人口平均报告数量
2017年,我国每百万人口平均医疗器械不良事件报告数为282份,与2016年相比增长了18份(图2-3)。
4.县级覆盖率
2017年,我国医疗器械不良事件报告的县级覆盖率为95.97%,与2016年相比增长了2.57%(图2-4)。
(二)全国注册基层用户数量
截至2017年12月31日,在“全国医疗器械不良事件监测系统”中注册的基层用户(包括医疗器械生产企业、经营企业和使用单位)共253,250家。其中,医疗器械生产企业11,898家,占注册基层用户总数的4.70%;经营企业128,625家,占注册基层用户的50.79%;使用单位112,727家,占注册基层用户的44.51%(图2-5)。
2017年,注册基层用户总数比2016年增长了9.22%。其中,医疗器械生产企业、经营企业和使用单位的注册基层用户分别比2016年增长了12.95%、11.25%和6.63%(图2-6)。
三、2017年医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2017年,全国上报的医疗器械不良事件报告中,使用单位上报326622份,占总报告数的86.83%;生产企业上报8655份,占总报告数的2.30%;经营企业上报40754份,占总报告数的10.83%;还有120份报告来自个人,占总报告数的0.03%;此外还有6份报告来源不详(图3-1)。
总体来看,不良事件报告仍主要来源于使用单位,其次来源于经营企业。生产企业提交的报告所占比例不足3%,与其器械质量安全第一责任人的地位不符,其履行职责的自觉性有待提高。
(二)按事件伤害程度统计分析
2017年,全国上报的医疗器械不良事件报告中,事件伤害为死亡的报告共211份,占总报告数的0.06%;事件为严重伤害的报告共57754份,占总报告数的15.35%;事件伤害为其他的报告共318192份,占总报告数的84.59%(图3-2)。2017年,各类伤害程度的报告所占比例与2016年基本一致。
(三)按医疗器械管理类别统计分析
2017年,全国上报的医疗器械不良事件报告中,涉及Ⅲ类医疗器械的报告154,192份,占总报告数的40.99%;涉及Ⅱ类医疗器械的报告181,175份,占总报告数的48.16%;涉及Ⅰ类医疗器械的报告25,555份,占总报告数的6.79%;部分报告涉及的器械管理类别不详,共15,235份,占总报告数的4.05%。数据显示,涉及Ⅲ类和Ⅱ类医疗器械的报告占绝大多数,这与医疗器械风险程度高低相吻合(图3-3)。
(四)按医疗器械产品名称统计分析
2017年,全国上报的医疗器械不良事件报告中,报告数量排名前十位的无源医疗器械分别为一次性使用输液器、一次性使用无菌注射器、静脉留置针、宫内节育器、导尿包、角膜接触镜、玻璃体温计、导尿管、医用输液贴和一次性使用心电电极,占总报告数的35.89%,详见表3-4。
2017年,全国上报的医疗器械不良事件报告中,报告数量排名前十位的有源医疗器械分别为病人监护仪、输液泵和注射泵、心电图机、电子血压计、血液透析机、呼吸机、生化分析仪、特定电磁波治疗机、婴儿培养箱、血糖仪,占总报告数的9.78%,详见表3-5。
(五)按涉及实际使用场所统计分析
2017年,全国上报的医疗器械不良事件报告中,使用场所为“医疗机构”的报告311,860份,占82.91%;使用场所为“家庭”的报告33,460份,占8.90%;使用场所为“其他”的报告6,853份,占1.82%;使用场所未填写的报告23,984份,占6.38%(图3-6)。使用场所的复杂性是分析不良事件发生原因时需要考量的因素之一。
四、2017年重点监测工作开展情况
2017年,全国共设立重点监测哨点1431家,开展各种形式的调研990次,组织培训会议143次,采用多种方式开展培训工作,共计培训9577人次,确保监测点及时准确上报不良事件。召开专家咨询会97次,参与专家达到562人次,主动收集监测数据229万余条,查阅相关品种文献3016篇,了解产品的不良事件特征和可能的原因,广泛收集产品不良事件信息,分析处理数据5万余条。各项工作的稳步推进,为后期产品风险分析奠定了坚实的基础。
五、医疗器械警戒快讯发布情况
2017年,国家药品不良反应监测中心共发布6期《医疗器械警戒快讯》,包括生物可吸收性血管支架系统、除颤/监护系统、胰岛素笔式注射器、植入式心脏复律除颤器等32条产品安全性信息。
六、报告质量评估工作
2017年,报告质量评估工作在各省全面落实推进,各省中心根据本省工作及人员的实际情况采取了因地制宜的评估模式。评估报告范围重点关注死亡及严重伤害报告、重点监测品种报告、辖区内生产企业报告等,有效筛查监测数据中的重复报告及虚假报告,制定提高报告质量改进措施,为器械风险挖掘提供真实可靠的监测数据,提高各级监测人员对医疗器械不良事件报告的审核评价意识,加强了国家、省及地市中心的交流沟通。
医疗器械不良事件监测小贴士
1.医疗器械:是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
(1)疾病的诊断、预防、监护、治疗或者缓解;
(2)损伤的诊断、监护、治疗、缓解或者功能补偿;
(3)生理结构或者生理过程的检验、替代、调节或者支持;
(4)生命的支持或者维持;
(5)妊娠控制;
(6)通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
2.医疗器械不良事件:指获准注册或已备案、质量合格的医疗器械,在正常使用情况下发生的,导致或可能导致人体伤害的各种有害事件。
根据医疗器械不良事件的危害程度和发生的原因,医疗器械生产企业必要时应当采取警示、检查、修理、重新标签、修改说明书、软件升级、替换、收回、销毁等控制措施。
目前,我国医疗器械不良事件监测按照“可疑即报”原则收集报告,即为可疑医疗器械不良事件报告。
3.医疗器械不良事件监测:是指对医疗器械不良事件的发现、报告、调查、评价和控制的过程。
4.严重医疗器械不良事件:指有下列情况之一者:
(1)导致死亡;
(2)危及生命;
(3)导致机体功能的永久性伤害或者机体结构的永久性损伤;
(4)必须采取医疗措施才能避免上述永久性伤害或者损伤;
(5)由于医疗器械故障、可用性等问题可能导致上述所列情况的。
5.死亡可疑不良事件报告:指患者最终结果为死亡的可疑医疗器械不良事件报告。不表示患者的死亡与使用医疗器械有明确的关联性。
6.医疗器械不良事件与质量事故、医疗事故的区别。
(1)医疗器械不良事件主要是由于产品的设计缺陷、已经注册审核的使用说明书不准确或不充分等原因造成的,但其产品的质量是合格的。
(2)医疗器械质量事故主要是指其质量不符合产品技术要求等规定造成的事故。
(3)医疗事故是指医疗机构及其医务人员在医疗活动中,违反医疗卫生管理法律、行政法规、部门规章和诊疗护理规范、常规,过失造成患者人身损害的事故。(摘自原卫生部《医疗事故处理条例》)
来源:国家药监局
为你推荐
 资讯
资讯 38年研发突破,罗氏获批中国首个PIK3CA突变的靶向创新药伊赫莱,为乳腺癌患者带来新选择
2025年3月11日,中国国家药品监督管理局(NMPA)正式宣布批准了伊赫莱®(通用名:伊那利塞片)联合哌柏西利和氟维司群,适用于内分泌治疗耐药(包括在辅助内分泌治疗期间或之后...
2025-03-14 14:52
 资讯
资讯 BMS 2.86亿美元收购了一家CAR-T疗法公司
近日,百时美施贵宝(BMS)宣布将以每股5 00美元的全现金交易方式收购2seventy bio(TSVT US),总股本价值约为2 86亿美元,交易预计将在2025年第二季度完成。
2025-03-13 16:28
 资讯
资讯 启明医疗正式复牌:以长期主义开启高质量发展新阶段
此次复牌标志着启明医疗彻底解决了公司治理问题,并重新建立了内部控制体系,是公司回应市场关切、重塑行业信心的关键一步。
2025-03-13 09:13
 资讯
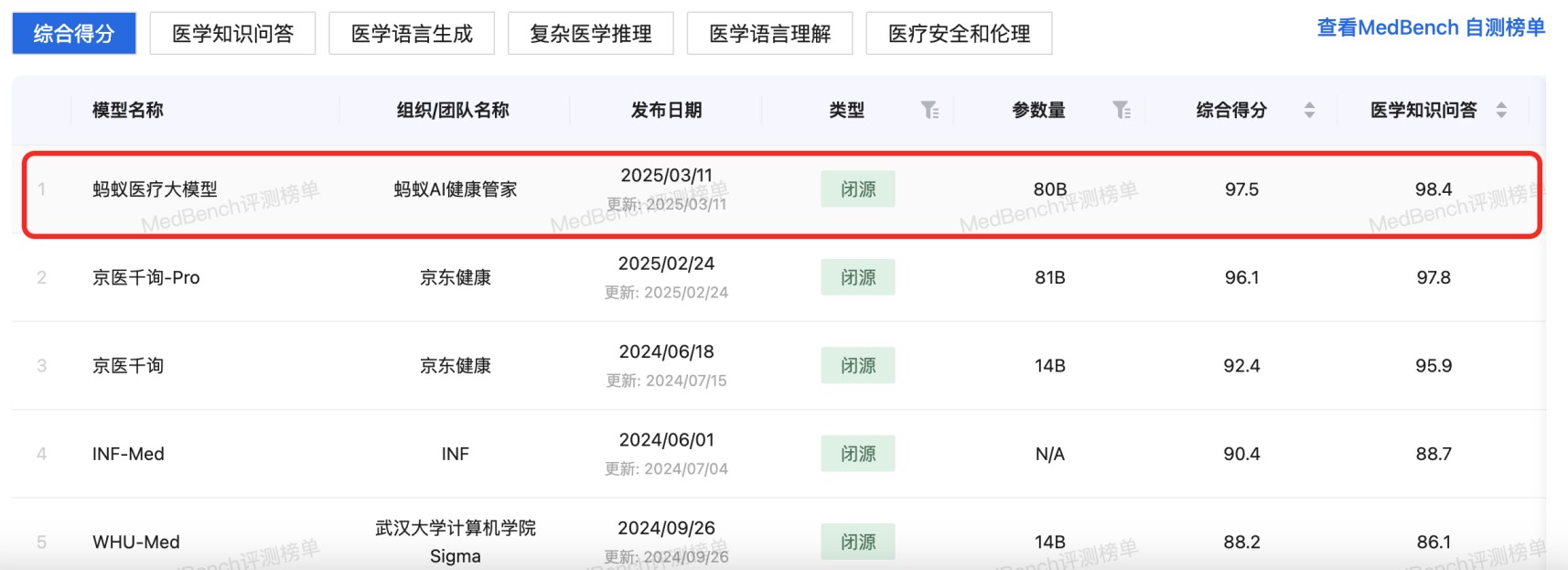
资讯 原生多模态+千亿级数据训练,蚂蚁医疗大模型拿下MedBench测评“双料”冠军
近日,记者发现,国内权威医疗大模型评测平台MedBench在官网更新了榜单。多个医疗AI产品及研究团队入榜,其中蚂蚁AI健康管家团队研发的蚂蚁医疗大模型以评测榜单97 5、自测榜单...
2025-03-12 15:47
 资讯
资讯 业绩增速持续承压,爱美客超13亿元收购了一家韩国医美公司
近日,爱美客发布公告称,基于公司战略规划和经营发展需要,其全资子公司 Imeik(HK)Limited(简称“爱美客香港”)与 Aisheng Shourui (HK) Limited(简称“首瑞香港”...
2025-03-12 10:47
 资讯
资讯 重见光明,聂爷爷的笑容回来了——重庆爱尔助孤寡白内障患者重燃生活希望
对于陈茂盛院长和重庆爱尔眼科医院(总院)的医护人员来说,聂爷爷的重见光明正是他们不断追求的动力。
2025-03-12 09:41
 资讯
资讯 无双医疗完成C轮近1.5亿元融资,加速心脏节律管理创新产品研发和商业化
本轮融资由天士力资本领投,现有股东启明创投、苏高新金控、康裕资本继续加持,为无双医疗在心脏节律管理(CRM)领域的创新产品研发和商业化进程注入了强劲动力。
2025-03-12 09:38
 资讯
资讯 卫美健康完成A轮亿级融资,加速县域基层医疗大模型应用落地
本轮融资资金将主要用于卫美健康“奇点医问”医疗大模型的研发投入与迭代进化,加强医疗细分领域的算法研究,构建升级全国服务网络体系,进一步扩大卫美健康在县域以及基层AI医...
2025-03-12 09:19
 资讯
资讯 突发,上市公司双成药业宣布终止跨界重组
昨日晚间(3月10日),双成药业发布公告称,公司原拟以发行股份及支付现金的方式向奥拉投资、Win Aiming等25名交易对方购买其持有的宁波奥拉半导体股份有限公司100%股份,并拟...
2025-03-11 13:44
 资讯
资讯 百时美施贵宝公布颂狄多®(氘可来昔替尼)POETYK PsA-2 III期试验最新数据 证实其在治疗成人银屑病关节炎中优于安慰剂
治疗第 16 周时,颂狄多治疗组患者的 ACR和 PASI应答率显著高于安慰剂组,且患者报告生活质量有更明显改善。与安慰剂和阿普米司特相比,颂狄多耐受性良好,安全性特征与既往...
2025-03-11 09:38
 资讯
资讯 华东医药全球首个卵巢癌ADC爱拉赫®补充申请获受理
申报适应症为用于既往接受过1-3线系统性治疗的叶酸受体α(FRα)阳性的铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。
2025-03-10 19:36
 资讯
资讯 用于治疗复发或难治性多发性骨髓瘤,辉瑞靶向免疫疗法易瑞欧(埃纳妥单抗)在华获批
今日(3月10日),辉瑞公司宣布,靶向免疫疗法易瑞欧®(埃纳妥单抗)获国家药品监督管理局附条件批准,适用于既往接受过至少三线治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂...
2025-03-10 12:07
 资讯
资讯 一款国产肺癌创新药头对头击败奥希替尼
日前,同源康医药发布公告称,其自主研发的第三代EGFR抑制剂TY-9591(商品名:卡达沙)在对比奥希替尼(商品名:泰瑞沙)作为一线治疗EGFR突变肺癌脑转移的关键II期临床试验中,...
2025-03-10 10:55
 资讯
资讯 “AI+创新药”第一股云顶新耀开拓mRNA肿瘤治疗性疫苗新蓝海,在国内推进至临床阶段
近年来,AI 赋能创新药研发已成为全球生物医药行业的重要趋势,尤其在 mRNA 疫苗领域,AI 更是成为提升研发效率与精准度的核心驱动力。港股创新药企云顶新耀(HKEX 01952 ...
2025-03-10 09:29