10月12日,上海药监局接连发布23起医疗器械产品召回报告。
上述23起召回均为“主动召回”,且召回产品几乎都在中国有生产或者销售。其中,包括1项I级召回,10项II级召回,12项III级召回。赛柏蓝器械认为,召回是一种负责任的态度。
分别如下:
1、迈柯唯:移动式手术台
迈柯唯(上海)医疗设备有限公司报告:公司发现因焊接不良可能导致手术床附件适配器的方形孔和第一关节之间损坏,可能导致患者严重伤害。公司决定召回相关产品,本次召回级别II级。
涉及地区和国家:全球。
在中国销售数量:62台。
2、迈柯唯:医用物理升温仪和人工心肺机-热交换水箱
迈柯唯(上海)医疗设备有限公司报告:公司发现人工心肺机-热交换水箱的水体中出现分枝杆菌污染(和其它细菌污染),公司决定召回产品,通知相关客户,应采取的纠正措施和生产企业发布新消毒流程的时间安排。本次召回级别III级。
涉及地区和国家:全球。
在中国销售数量:418台。
3、邦美:组件式全膝关节系统
邦美(上海)商贸有限公司报告:企业调查发现,用于螺栓头部内六角钻孔的钻头可能大于公差的可接受允许值,可能导致螺栓不能被完全拧紧。公司决定召回相关产品,本次召回级别II级。
涉及地区和国家:美国、欧洲、中东和亚太地区。
涉及产品生产(或进口中国)数量:159件。
在中国销售数量:0件。
4、GE:婴儿保暖台
通用电气医疗系统贸易发展(上海)有限公司报告:企业发现涉及产品加热体部分的螺丝存在松脱风险,如果辐射加热体部分没有做合理的维护,发热的螺丝可能会掉到床垫上,接触到病人,存在风险。公司决定召回相关产品,本次召回级别II级。
涉及地区和国家:美国、澳大利亚、加拿大、中国等国家及地区。
在中国销售数量:254。
5、GE:磁共振成像系统
通用电气医疗系统贸易发展(上海)有限公司报告:企业收到CADStream部件供应商的召回通知,产品SureLoc功能和PURE功能存在缺陷。公司决定召回相关产品,本次召回级别II级。
涉及地区和国家:澳大利亚、中国等国家和地区。
在中国销售数量:34。
6、美敦力:氩气增强电外科系统、电外科手术器械
美敦力(上海)管理有限公司报告:公司发现涉及产品内包装存在密封缺陷,存在无菌屏障被破坏的可能性,增加患者感染风险。公司决定召回相关产品,回收所有未使用产品。本次召回级别为II级。
涉及地区和国家:全球。
在中国销售数量:103盒。
7、美敦力:等离子手术系统
美敦力(上海)管理有限公司报告:公司内部测试发现个别产品无法通过电磁兼容性检测。公司决定召回相关产品,本次召回级别为III级。
涉及地区和国家:中国。
在中国销售数量:80台。
8、美敦力:移动式C形臂X射线机
美敦力(上海)管理有限公司报告:公司发现涉及产品的用户手册中有部分技术信息的提供不符合美国法规要求;其次,受影响产品的生产和维修文件不符合美国法规规定。另外,因包装不当,更换电池可能存在损坏风险。公司决定召回相关产品,本次召回级别为Ⅱ级。
涉及地区和国家:全球。
在中国销售数量:19台。
9、美敦力:微电极驱动器
美敦力(上海)管理有限公司报告:公司发现涉及产品的生产日期在产品注册证批准日期之前,不符合法规要求。公司决定召回相关产品。本次召回级别为III级。
涉及地区和国家:中国。
在中国销售数量:83件。
10、凯杰:高危型人乳头瘤病毒检测试剂盒
凯杰企业管理(上海)有限公司报告:企业发现,涉及产品标签标注产品有效期超过12个月与注册证规定产品有效期12个月不一致,不符合中国法规要求。公司决定召回相关产品,本次召回级别III级。
涉及地区和国家:中国。
在中国销售数量:1,964盒。
11、西门子:数字化医用X射线摄影系统
上海西门子医疗有限公司报告:企业发现,涉及产品的病床部件因为在生产过程中遗漏安装限位卡环,可能造成病床上的病人滑落。公司决定召回相关产品。本次召回级别III级。
涉及地区和国家:中国。
在中国销售数量:8台。
12、西门子:全自动生化分析仪
西门子医学诊断产品(上海)有限公司报告:企业发现,涉及产品软件存在问题。公司决定召回相关产品,本次召回级别III级。
涉及地区和国家:中国。
在中国销售数量:19台。
13、罗氏:万古霉素检测试剂盒
罗氏诊断产品(上海)有限公司报告:企业发现,涉及产品说明书关于该试剂在其适用机型上检测与在全自动生化分析系统COBASINTEGRA检测的方法对比描述不正确。公司决定召回相关产品,更新产品说明书中关于方法学比较的相关描述。本次召回级别III级。
涉及地区和国家:全球。
在中国销售数量:59盒。
14、罗氏:血气、电解质、生化项校准品
罗氏诊断产品(上海)有限公司报告:企业发现,使用涉及批号产品时可能造成氧分压参数校准错误。公司决定召回相关产品,本次召回级别II级。
涉及地区和国家:全球。
在中国销售数量:925盒。
15、泰尔茂:血管支架
泰尔茂医疗产品(上海)有限公司报告:公司生产检验发现,在组装支架和输送系统过程中,施加在支架上的压力有可能造成支架轻微变形,这可能导致支架自身不完全扩张从而造成支架两端直径缩小或支架变形。公司决定召回相关产品,本次召回级别为Ⅱ级。
涉及地区和国家:全球。
涉及产品生产(或进口中国)数量:125个。
在中国销售数量:0。
16、飞利浦:病人监护仪
飞利浦(中国)投资有限公司报告:如果监护仪已连续通电数月,期间既没关机也没重新启动,则监护仪可能出现显示的波形滞后,因而无法反映患者的即时状况。公司决定召回相关产品,本次召回级别为Ⅱ级。
涉及地区和国家:全球。
在中国销售数量:939台。
17、碧迪:样本保存液
碧迪医疗器械(上海)有限公司报告:企业调查发现,涉及产品少部分瓶盖可能出现裂缝,可能导致保存液渗漏。公司决定召回相关产品,本次召回级别III级。
涉及地区和国家:美国等。
在中国销售数量:2,751,000瓶。
18、碧迪:白细胞分化抗原CD3/CD4/CD45检测试剂盒
碧迪医疗器械(上海)有限公司报告:企业调查发现,涉及产品英文瓶标签上错误标注了“明胶”字样,实际应该标注“含有缓冲剂”。公司决定召回相关产品,本次召回级别III级。
涉及地区和国家:全球。
在中国销售数量:1,510盒。
19、强生:动力系统
强生(上海)医疗器材有限公司报告:公司发现受影响的连接电缆可能会产生过大的内部压力而发生爆炸,可能对用户和患者造成伤害。公司决定召回相关产品,本次召回级别I级。
涉及地区和国家:全球。
在中国销售数量:20件。
20、强生:全膝关节置换系统
强生(上海)医疗器材有限公司报告:公司发现特定型号特定批号的受影响产品被错误地添加了同一注册证下其他产品的中文说明书。公司决定召回相关产品,本次召回级别III级。
涉及地区和国家:中国。
在中国销售数量:411件。
21、东曹:含有碱性磷酸酶系列检测试剂
东曹(上海)生物科技有限公司报告:企业发现使用成分中含有碱性磷酸酶系列检测试剂测定接受低碱性磷酸酯酶治疗药物患者样本时,会导致夹心法项目检测结果出现假性高值,竞争法项目检测结果出现假性低值。公司决定召回相关产品,本次召回级别III级。
涉及地区和国家:全球。
在中国销售数量:所有AIA客户。
22、梅里埃:核酸提取试剂
梅里埃诊断产品(上海)有限公司报告:企业总部收到投诉,使用梅里埃仪器提取的核酸在做用户自定义下游PCR及RT-PCR实验时出现扩增性能问题;企业调查发现涉及批次试剂盒对提取体积大于400ul的双链核算存在影响。公司决定召回相关产品,本次召回级别III级。
涉及地区和国家:全球。
在中国销售数量:67盒。
23、富士:数字化乳腺X射线诊断系统
富士胶片(中国)投资有限公司报告:涉及产品在立体穿刺曝光过程中,在C臂旋转3.0—3.3秒之间,释放曝光开关,系统软件可能会报错,曝光无法继续,且无法自动或手动恢复。公司决定召回相关产品,本次召回级别为Ⅱ级。
涉及地区和国家:全球。
在中国销售数量:4台。
来源:上海药监局 赛柏蓝器械整理
为你推荐
 资讯
资讯 带状疱疹疫苗“遇冷”,百克生物2024年净利润腰斩
近日,国内疫苗龙头企业百克生物发布2024年年报,数据显示,其报告期内实现营收12 29亿元,同比下降32 64%;归属于上市公司股东的净利润2 32亿元,同比下降53 67%。对于营收...
2025-04-23 12:59
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
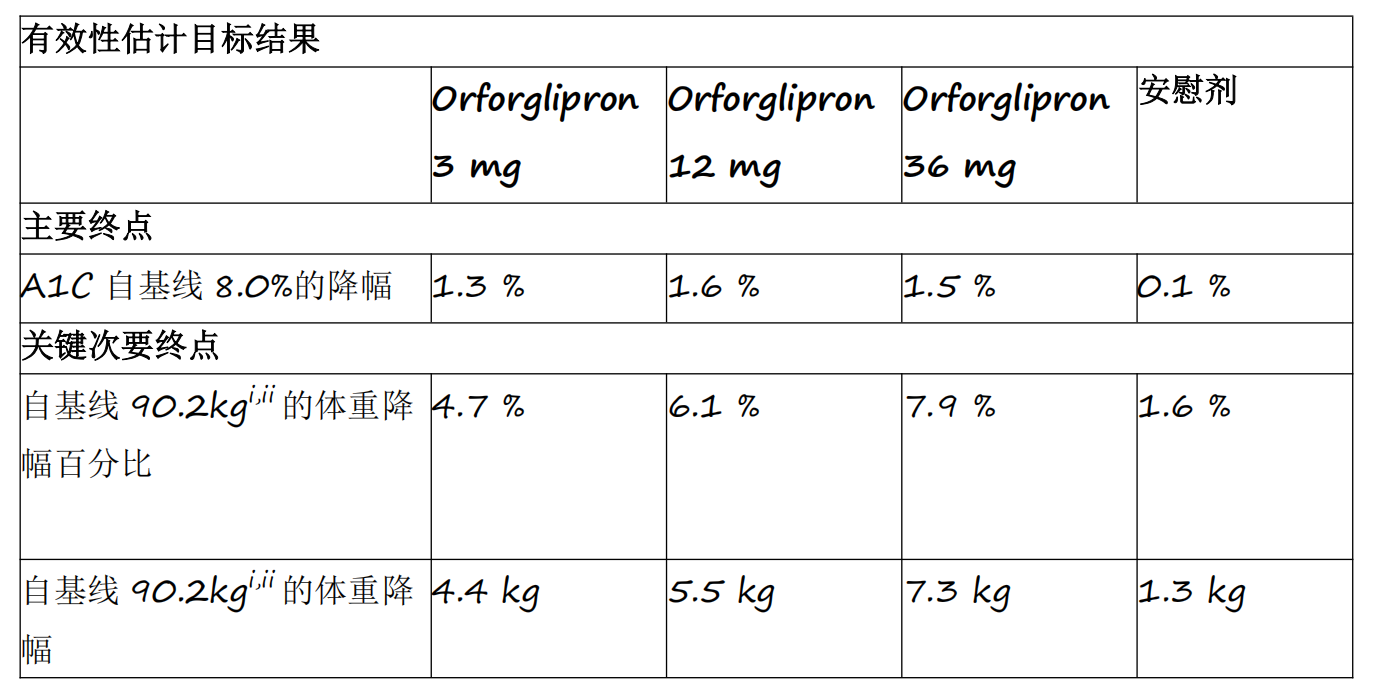
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12