为促进医疗器械产业发展,简化企业在调整产业结构和兼并重组过程中有关许可事项的办理流程,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》和《医疗器械生产监督管理办法》的有关规定,现将境内医疗器械生产企业跨省新开办企业时办理产品注册及生产许可的有关事宜公告如下:
一、已取得《医疗器械注册证》及《医疗器械生产企业许可证》的企业,且涉及多个跨省生产场地的,按照以下情形办理:
(一)对注册证持有企业,其住所在A省(自治区、直辖市,以下同),生产场地在A省和B省(如企业有多个跨省生产场地,除A省生产场地外,其余也统称为B省,以下同),且每个生产场地均能完整独立生产产品的企业,现按照有关规定在B省原生产场地新开办企业,继续生产同样产品,并取消A省生产场地的情形;或对注册证持有企业,其住所在A省,生产地址仅设在B省,现按照有关规定需办理在B省原生产场地新开办企业,继续生产同样产品的情形。
1.对于以上情形的第三类医疗器械,由A省企业向国家食品药品监督管理总局办理注册证上注册人名称登记事项变更和取消A省生产地址的登记事项变更(如有),办理时不需提交生产许可证。
注册变更后,由B省新开办企业向B省食品药品监督管理部门提出生产许可申请,B省食品药品监督管理部门根据第三类医疗器械注册证及注册变更文件,依据《医疗器械生产质量管理规范》及相关附录,对相关产品进行生产质量管理规范全项目检查,对符合规定条件的,核发医疗器械生产许可证。同时A省企业向A省食品药品监督管理部门申请注销原《医疗器械生产企业许可证》。
2.对于以上情形的第二类医疗器械,由B省新开办企业向B省食品药品监督管理部门提出(首次)注册申请。
B省新开办企业取得产品注册证后,向B省食品药品监督管理部门提出生产许可申请,B省食品药品监督管理部门依据《医疗器械生产质量管理规范》及相关附录,对相关产品进行生产质量管理规范全项目检查,对符合规定条件的,核发医疗器械生产许可证。同时A省企业向A省食品药品监督管理部门申请注销相关产品注册证书及原《医疗器械生产企业许可证》。
(二)对注册证持有企业,其住所在A省,生产场地在A省和B省,且每个生产场地均能完整独立生产产品的企业,现拟取消B省生产场地,在A省原生产场地继续生产同样产品的情形。
对于以上情形的医疗器械,由企业根据产品类别向相应食品药品监督管理部门办理注册证上生产地址登记事项变更,办理时不需提交生产许可证。
企业应根据医疗器械注册证变更情况,向A省食品药品监督管理部门申请变更医疗器械生产许可,A省食品药品监督管理部门应当按照新的《医疗器械生产监督管理办法》有关要求进行审核,发给新的《医疗器械生产许可证》,有效期自发证之日起计算。
(三)对注册证持有企业,其住所在A省,生产场地在A省和B省,且每个生产场地均能完整独立生产产品的企业,现拟除保留A省生产场地外,按照有关规定在B省原生产场地新开办企业,在A省和B省生产场地分别继续生产同样产品的情形。
对于以上情形的医疗器械,A省企业根据产品类别向相应食品药品监督管理部门办理注册证上生产地址登记事项变更,办理时不需提交生产许可证。B省新开办企业根据产品类别向相应食品药品监督管理部门提出(首次)注册申请。国家食品药品监管总局对该项注册申请不收取注册费。
B省企业取得产品注册证后,向B省食品药品监督管理部门提出生产许可申请,B省食品药品监督管理部门根据相关医疗器械注册证,依据《医疗器械生产质量管理规范》及相关附录,对相关产品进行生产质量管理规范全项目检查,对符合规定条件的,核发医疗器械生产许可证。同时A省企业向A省食品药品监督管理部门申请变更医疗器械生产许可,A省食品药品监督管理部门应当按照新的《医疗器械生产监督管理办法》有关要求进行审核,发给新的《医疗器械生产许可证》,有效期自发证之日起计算。
二、医疗器械生产企业在兼并、重组过程中涉及跨省办理产品迁入迁出的,按照以下情形办理:
对注册证持有企业住所在A省的,拟将A省企业的注册产品全部生产过程转移至B省,由B省企业根据产品类别向相应食品药品监督管理部门提出(首次)注册申请。
B省企业取得产品注册证后,向B省食品药品监督管理部门提出生产许可或变更申请,B省食品药品监督管理部门根据相关医疗器械注册证,依据《医疗器械生产质量管理规范》及相关附录,对相关产品进行生产质量管理规范全项目检查,对符合规定条件的,核发或变更医疗器械生产许可证,增加《医疗器械生产产品登记表》(以下简称《登记表》)所列品种。同时A省企业向A省食品药品监督管理部门申请办理或变更医疗器械生产许可证,核减《登记表》所列品种。
三、上述涉及(首次)注册申请的,除本条所列下述资料外,其余注册申报资料可提交A省企业的资料,并经A省企业同意用于B省企业注册申报,具体如下:
医疗器械(不含体外诊断试剂)注册申报资料中的证明性文件、医疗器械安全有效基本要求清单、生产制造信息、产品技术要求、产品注册检验报告、说明书和标签样稿、符合性声明应当为B省企业的。
体外诊断试剂注册申报资料中的证明性文件、生产及自检记录、产品技术要求、产品注册检验报告、说明书和标签样稿、符合性声明应当为B省企业的。
如果A省企业注册证无产品技术要求附件的,则核发的B省企业注册证“附件”栏将“产品技术要求”改为“注册产品标准”。该注册证延续注册时,按照《食品药品监管总局关于实施〈医疗器械注册管理办法〉和〈体外诊断试剂注册管理办法〉有关事项的通知》(食药监械管〔2014〕144号)中有关规定办理。
四、第一类医疗器械生产企业跨省设立生产场地的,应依据《医疗器械监督管理条例》的要求,及时办理备案。
五、医疗器械生产企业在省内跨区域兼并、重组等情形所涉及的产品注册及生产许可的办理参照执行。
特此公告。
来源:医谷网
为你推荐
 资讯
资讯 圣因生物完成超 1.1 亿美元 B 轮融资,加速 RNAi 疗法全球布局
本轮融资由知名产业机构领投,国际主权基金、中国生物制药、君联资本等十余家机构跟投,全球制药巨头礼来公司战略入局,高瓴创投、启明创投等现有股东持续加码支持,融资规模创...
2025-12-12 16:59
 资讯
资讯 投后估值达21.37亿元,实体瘤细胞治疗领军企业君赛生物递表港交所
君赛生物共有5款在研产品,其中核心产品也是进展最快的是GC101,正开展上市前的关键II期临床试验,有望成为国内首个获批上市的TIL细胞创新药
2025-12-12 09:24
 资讯
资讯 ESMO-IO | ORR达41.7%!君赛生物GC101 TIL治疗晚期后线非小细胞肺癌I期数据首次公布
这不仅是全球首个无需高强度清淋化疗、无需IL-2给药的TIL疗法治疗肺癌的临床研究,也是国内首个公开披露该领域数据的注册性临床研究。
2025-12-12 09:17
 资讯
资讯 君合盟生物启动重组 A 型肉毒毒素治疗成人上肢痉挛状态临床 III 期试验,并完成首例患者入组
该临床试验由复旦大学附属华山医院李放教授和上海市养志康复医院(即上海市阳光康复中心)靳令经教授联合牵头
2025-12-11 21:06
 资讯
资讯 Medidata发布全新调研报告:临床试验AI应用价值凸显,超七成用户反馈“达到或超预期”
基于对来自全球制药公司、生物科技公司及合同研究组织(CRO)中超200位核心决策者的深度调研,报告显示,目前AI在改善患者招募、优化数据管理、控制运营成本和提升试验效率等方...
2025-12-11 20:57
 资讯
资讯 近20年首个全新类别抗菌药物醋酸来法莫林纳入医保,开启中国成人社区获得性肺炎治疗普惠新篇章
该产品继2025年6月30日获得国家药品监督管理局批准用于治疗成人社区获得性肺炎(CAP)后又纳入国家医保目录
2025-12-11 20:50
 资讯
资讯 专注 “生物学 + AI” ,普瑞基准完成超亿元 D 轮融资,加速 AI 驱动新药研发
本轮融资由信立泰、广投资本、申宏中恒基金联合领投,老股东金谷汇枫、聚翊投资持续跟投
2025-12-10 15:55
 资讯
资讯 别把“嗜睡”当懒癌!新型促觉醒药翼朗清®获批,专注维持日间清醒
促觉醒药物翼朗清®(盐酸索安非托片)正式获得中国国家药品监督管理局(NMPA)批准,用于改善阻塞性睡眠呼吸暂停(OSA)伴有日间过度嗜睡(EDS)的成人患者的觉醒程度。
2025-12-10 11:04
 资讯
资讯 复星医药将其GLP-1产品全球化权益授权辉瑞,总里程碑付款近150亿人民币
12月9日晚间,复星医药发布公告称,公司控股子公司药友制药、复星医药产业与辉瑞共同签订《许可协议》,(其中主要包括)由药友制药就口服小分子胰高血糖素样肽-1受体(GLP-1R)...
2025-12-10 09:12
 资讯
资讯 Capricor Therapeutics公司宣布外泌体疗法Deramiocel在DMD三期中取得积极成果
近日,专注与外泌体疗法的Capricor Therapeutics(纳斯达克代码:CAPR)公司宣布其核心管线Deramiocel在杜氏肌营养不良症关键三期 HOPE-3 研究中取得积极成果。
2025-12-09 16:38
 资讯
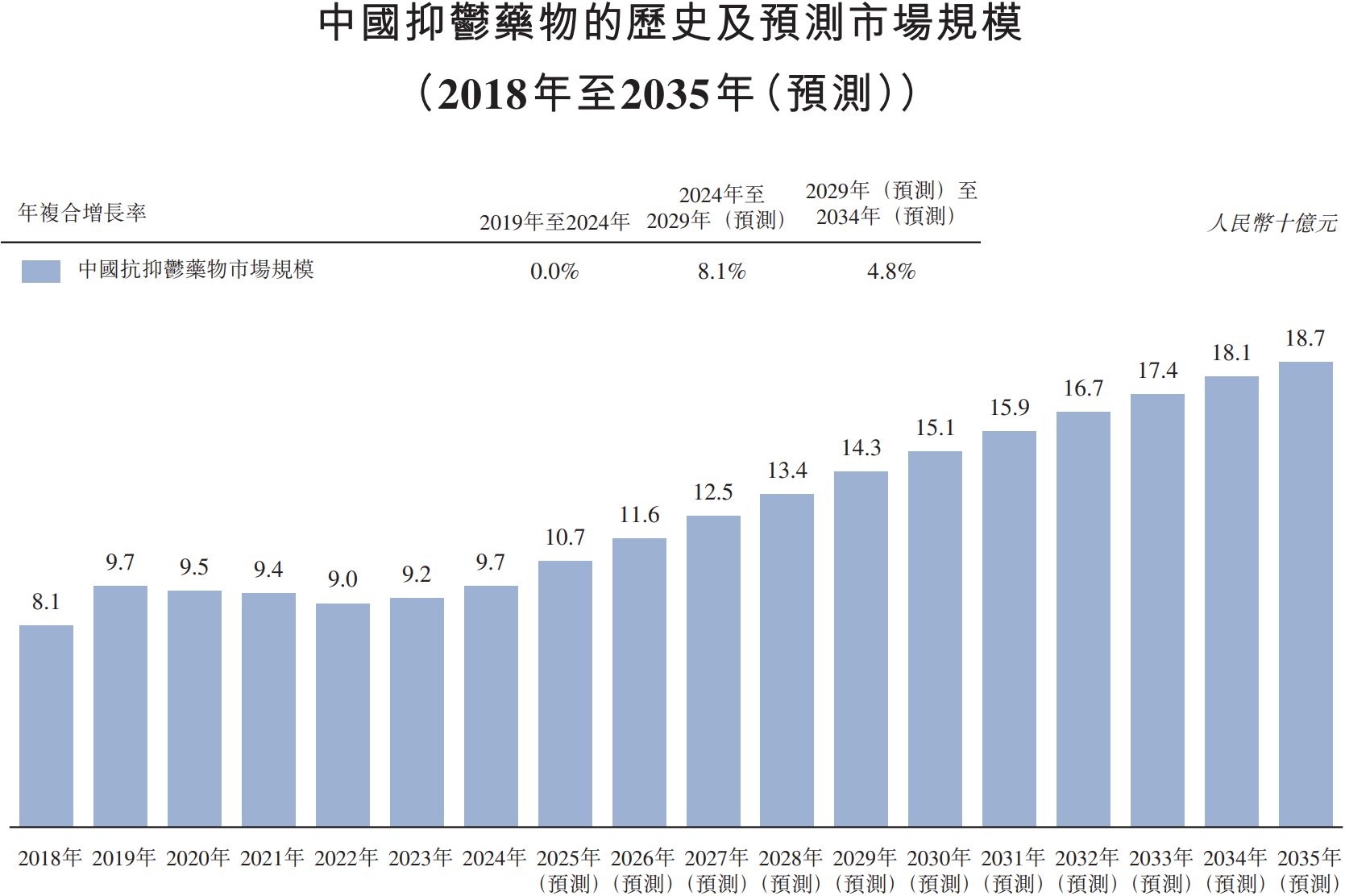
资讯 中药1类创新药剑指抑郁症治疗蓝海,远大医药GPN01360成功达到国内II期临床终点
国产抗抑郁症药物研发取得重大进展。近日,远大医药(0512 HK)的1 1类中药创新药GPN01360国内II期临床研究成功达到临床终点,产品表现出显
2025-12-08 18:27