10月20日,这一天对于23andMe是具有特殊意义的一天,就在这天,23andMe宣布通过FDA批向大众的基因检测服务,这意味着23andMe高调回归了直销模式的基因检测行业。
2013年,FDA叫停了 23andMe 的个人 DNA 检测服务,理由是其服务尚未取得监管部门的批准。FDA 表示,自 2009 年开始,已经与 23andMe 进行了 14 次会面和电视电话会议,并有数以百计的邮件交流。但尽管这样,FDA依然无法确定 23andMe 从分析或临床方面验证了旗下个人基因组服务的功效,并且其服务已经超过了当初获批的范畴。自此23andMe就走上了报证的历程,其间伴随着一轮又一轮的融资。就在本月,23andMe已经拿到1.15亿美元的融资,估值达11亿美元,这次投资由由Fidelity领投,Google、Casdin、药明康德跟投,值得注意的是,23andMe将借力药明康德进入中国市场(更多详情请见《23andme完成1.15亿E轮融资,估值11亿美元,药明康德加入》)。
两年前的叫停,对于这家以此为主要盈利业务的公司来说无疑是一个噩耗。两年之后,重新回归市场,23andMe此次提供修订后的个性化基因组服务,包括祖源、健康、非医学特征(如雀斑、头发卷曲、乳糖不耐受症等)以及疾病携带状况的信息报告。这项新服务价格为199美元,帮助消费者判断是否携带一些与遗传性疾病相关的基因突变,这些疾病包括囊纤维化、家族黑蒙性白痴以及镰状细胞贫血。
23andMe表示,目前这款经过改良的服务只面向新用户,针对老用户仍需耐心等待几个月。Emily Drabant Conley是商业发展与生命科学的副主管,她表示:“此次回归是基因技术DTC营销的一次重生。”
用“重生”这个词来形容这次回归绝对再合适不过了。23andMe之前的DNA测试能够检测出200多种疾病、测试者的特性以及健康状况等;现在则是对36个基因变异体进行检测,这些变异体都与囊性纤维化(遗传性胰腺病)、镰状细胞血症、布卢姆综合征(面部红斑侏儒综合征)等疾病有着密切的关系,能够通过变异体的检测来判断疾病的潜在风险。(通常这些做这些测试的人自身都不会有遗传病的症状,但是可能会有遗传给子女的风险。)虽然该测试需要199美元,是普通检测费用的两倍,但这是第一种也是唯一一种不需要取得中间人及中介机构(医生或者基因遗传咨询师)授权的基因测试。
已经提交了检测申请的客户可以登陆到23andMe的网站上,查看某一特定变异体检测的全过程以及相关研究结果的详细解析,同时网站上还提供基因咨询专家和疾病宣传控制小组的相关链接。
检测能够发现将近二十四个影响健康的遗传性因素和物理性状,比如说乳糖不耐受症、眼睛的颜色以及耳屎的类型。客户还能够了解更多关于他们祖先的信息,那样的话建立一个家谱或者是走亲访友就更方便了。
新用户只要现在下单,这些检测结果完成后就会立刻反馈给你(通常样本分析检测大概需要4到6周的时间)。老用户可能还需等待几个月时间进行升级。
自从2013年下半年FDA下令其禁止出具带有诊断性的健康报告之后,23andMe就开始了大调整。公司总裁Andy Page表示:“一开始,我们和FDA的交流出了点问题,有很多内容我们都不能正确地理解和消化。所以在监管环境和医学专业领域方面有所过失。”
Page说,在那之后公司就引进了更多有监管方面经验的行政经理来参与日常运营管理,75%的高层领导都有了全面的提升。公司的总经理表示,在FDA的指导下,他们在成千上万的人身上测试了新服务,以确保服务的可接受度。
来看看23andMe这次是通过什么样的努力终获FDA青睐的。
从FDA 的声明中可以看出,23andMe 此次给出了两种不同的学术研究结果来证明自己检测方式的正确性,第一种基于两个实验室 70 个完全不同的样本,其中还包括已知的疾病基因携带者。第二种则是在两个相同的实验室里检测 105 个样本。
其次,它使用了 302 个样本试验来说明,在不了解 23andMe 使用方式的情况下,普通用户可以依靠产品介绍完成标本采集。
不仅如此,它还在美国公民中随机抽取 667 名用户,代表处于不同年纪、性别、种族和教育背景的群体,通过他们的反应来证明自己产品的介绍和结果解读易于理解。
之所以有这么繁复的过程,是因为 FDA 对疾病基因携带者检测服务有着自己的一套标准,其中包括:
1.所有的家庭检测产品都需要详细的使用说明,证明用户在从未了解其产品的情况下可以看懂并正确操作。
2.检测结果清晰且适合普通用户阅读理解,告诉他们何种结果与用户何种期待相匹配。
3.检测不仅仅是售卖产品,还需要提醒用户,如何找到相关的遗传学专业人士,协助用户找到预防或者检测后服务。
FDA 还解释,当初叫停 23andMe 的基因检测服务主要是因为后者在接到警告信后依旧向用户提供健康服务,而且没有办法提供非常准确的信息来证明自己的检测正确并且对临床有意义。
即使有如此严格的标准,23andMe终守得云开见月明,我们来看一下23andMe CEO Anne Wojcicki发布的邮件原文吧:
今天是个人基因组检测历史上具有里程碑意义的一天。我兴奋的告诉大家,23andMe现在成为了第一家,而且是惟一一家符合FDA标准,能够直接给客户提供遗传服务,包括遗传报告的公司。
在接近两年的时间,与FDA共同努力后,获得了广泛的用户理解测试并重新进行完整设计之后,23andMe推出了一个全新的体验服务,包括了携带状态,健康,特质,祖先信息等相关内容的报告。我们也重新开发并改进了以往的分析工具,以此在遗传信息上与您的家人和朋友进行分享和比较,如果您参与到我们的研究中,我们将会为您提供新的见解。
作为我们早期的客户之一,您将会继续获得您当前的健康报告。新的体验将会包括许多重新设计的版本,这里面会包括您的相同的健康信息和先前的报告。同时我们还添加了一些新的特点和分析工具。
我们的团队将会在明年年初推出全新的方案。当您的账户更新的时候,我们会给您发送一封电子邮件。
如果您对新方案有任何疑问,你可以访问我们新的FAQ页面。此外,我们已经更新了隐私申明和服务条款,来支持相关的新功能,我们希望您能够及时阅读。
我们将继续致力于为您提供世界一流的服务,并且我们会进行一个持续的更新。基因革命的时代已经来临,我们很欣喜,像您这样的客户能够继续了解自己的DNA,而今天也仅仅只是一个开始。
23andMe CEO Anne Wojcicki从邮件中,Anne Wojcicki的兴奋之情溢于言表,经过两年的努力,这家硅谷的初创企业重新杀回了市场,据23andMe总裁Andy Page表示,23andMe还计划往后提供一系列全面的疾病检测,比如说乳腺癌或是阿兹海默症。
医谷链:
来源:医谷网
为你推荐
 资讯
资讯 康龙化成与礼来达成口服GLP-1小分子药Orforglipron生产合作协议
3月11日晚间,康龙化成官方微信发布消息,康龙化成与礼来公司共同宣布,达成关于首个申报注册的口服小分子GLP-1受体激动剂Orforglipron的生产合作协议。
2026-03-12 21:56
 资讯
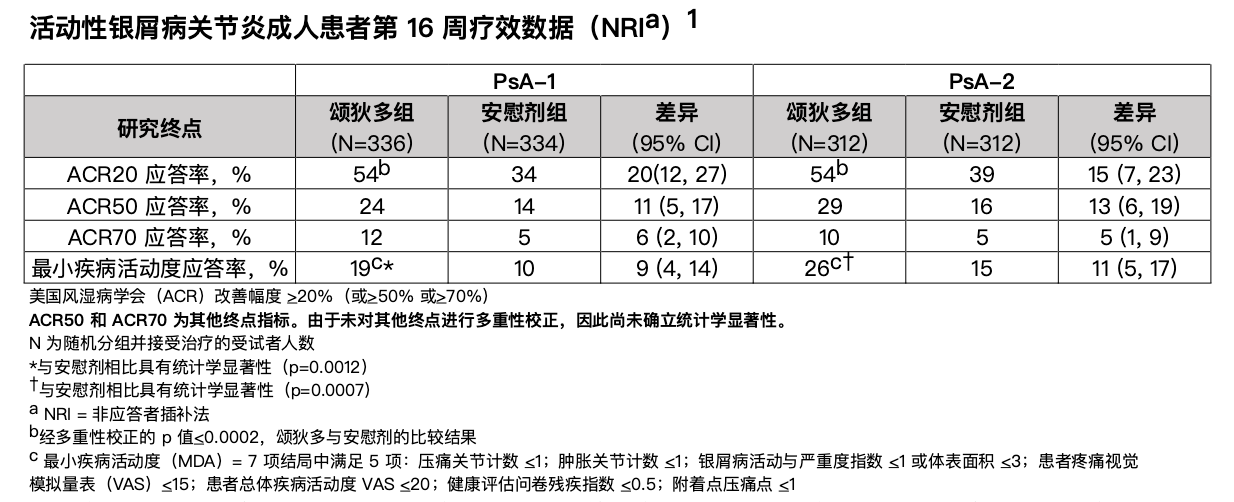
资讯 美国 FDA 批准颂狄多(氘可来昔替尼)用于治疗活动性银屑病关节炎成人患者
颂狄多是一种口服选择性酪氨酸激酶 2(TYK2)抑制剂,也是首个获批用于 PsA治疗 的 TYK2 抑制剂
2026-03-12 16:53
 资讯
资讯 百时美施贵宝宣布口服药物mezigdomide治疗复发或难治性多发性骨髓瘤Ⅲ期研究SUCCESSOR-2的积极结果
这是mezigdomide首项获得积极结果的Ⅲ期研究,也是百时美施贵宝CELMoD项目第二项获得积极成果的Ⅲ期研究
2026-03-11 21:15
 资讯
资讯 备思复联合帕博利珠单抗使顺铂耐受的肌层浸润性膀胱癌患者的复发或死亡风险降低近 50%
在 III 期临床研究 EV-304 中,该联合疗法显著改善患者总生存期与病理完全缓解率,超半数患者在手术时未检测到病灶
2026-03-11 13:17
 资讯
资讯 降 HbA1c 超 2.5%且多重获益,华东医药国产降糖新药HDM1005降糖2期数据揭晓
本次研究为一项在饮食和运动或二甲双胍治疗后血糖控制不佳的2型糖尿病受试者中评价HDM1005注射液有效性和安全性的多中心、随机、盲法、平行、安慰剂和阳性对照的Ⅱ期临床研究
2026-03-10 19:38
 资讯
资讯 艾凯生物完成A3轮超亿元融资,加速AI驱动iPSC细胞治疗与类器官平台升级
本轮融资由知壹投资与沃杰资本联合领投,联新资本持续追加投资,资金将重点用于推进AI驱动的iPSC细胞治疗产品临床转化,加速完善iPSC细胞治疗与类器官两大核心技术平台布局。
2026-03-10 18:22
 资讯
资讯 中科搏锐斩获数千万B轮融资,推动脑机接口全产业链产业化落地
本轮融资由国内知名投资机构三泽创投独家投资,凯乘资本担任长期独家财务顾问,所筹资金将全力支撑公司深化脑机接口全产业链布局,加速尖端技术的临床转化与产业化落地。
2026-03-10 18:03
 资讯
资讯 入选不足4月,和黄医药申请将达唯珂移出首版商保创新药目录
国家医疗保障局办公室今日发布通知,自2026年3月9日起,撤销氢溴酸他泽司他片(商品名:达唯珂)在全国各省级医药采购平台挂网资格,并根据企业申请,将该药品移出《商业健康保...
2026-03-09 22:09
 资讯
资讯 CDE:抗肿瘤药物生物等效性及药代动力学比对研究受试者人群选择考虑
本指导原则主要基于小分子化学药物及单抗类药物的研究经验,为抗肿瘤药物 BE PK 比对研究中受试者人群的选择考虑提供建议。
2026-03-07 10:59
 资讯
资讯 四家知名药企被暂停军队采购
近日,军队采购网发布一批“军队采购暂停名单”,其中涉及四家药企被列入暂停名单,具体为北京费森尤斯卡比医药有限公司、齐鲁制药有限公司、宜昌人福药业有限责任公司和江苏新...
2026-03-07 10:41