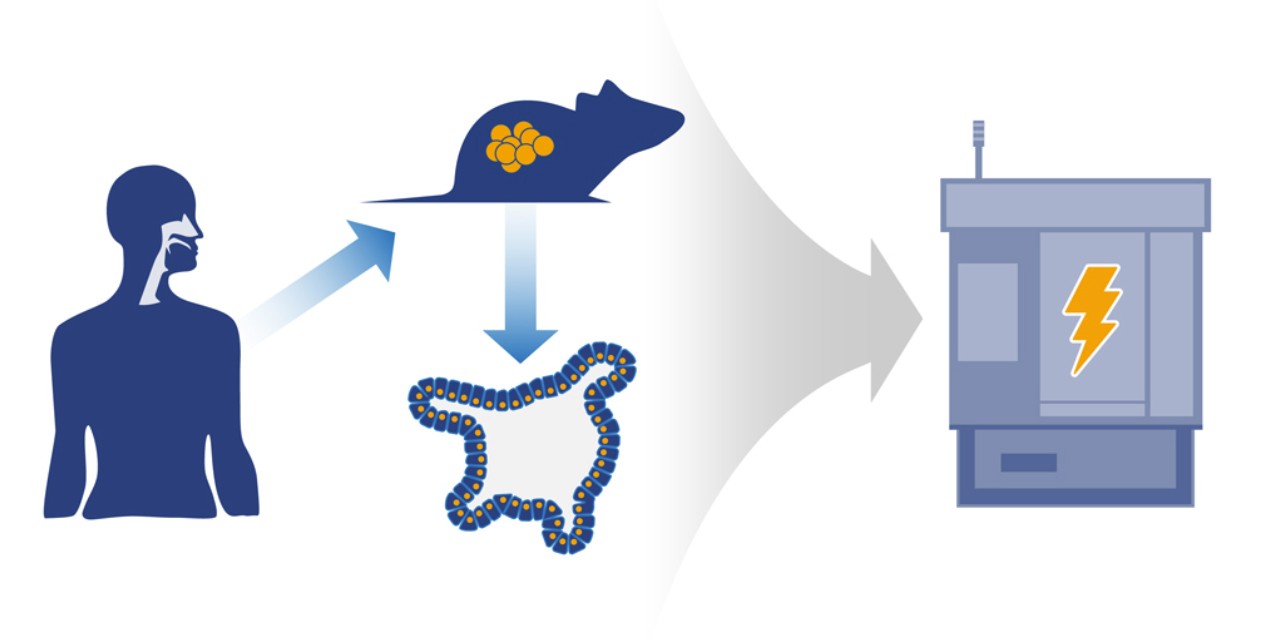
一直以来,光疗法都被用于治疗癌症,但是该疗法有一个缺陷,它只对那些光容易到达的组织起作用,比如皮肤等。然而,3月9日发表在《Nature Nanotechnology》杂志上的一项研究中,来自华盛顿大学医学院的研究人员运用小鼠癌症模型设计出一种新型光疗法可以直击身体“深处”的肿瘤。
在这项研究中,科学家们可将光直接投递到肿瘤细胞上,协同自由基光敏材料(可以被光激活)摧毁癌细胞。
华盛顿大学的生物医学工程教授Samuel Achilefu说:“光疗法疗效很好,几乎没有副作用。但是一直不能用于深处的肿瘤或转移性的肿瘤。简单来说,光疗法是通过光刺激感光材料,产生可以诱导细胞死亡的自由基。但是该疗法只有在光和氧气存在的情况下才能发挥很好的效果。这也是限制光疗法发展的最大的阻碍。”
研究人员利用的光源依赖于一种叫切伦科夫辐射(Cherenkov radiation)的现象。该现象在1934年由Pavel Cerenkov发现,他也因此获得了1958年的诺贝尔物理学奖。切伦科夫辐射是介质中运动的电荷速度超过该介质中光速时发出的一种以短波长为主的电磁辐射,其特征是蓝色辉光。该现象在医生用于诊断癌症的正电子发射计算机断层扫描(positron emission tomography ,PET)中也会产生。
Achilefu和第一作者Nalinikanth Kotagiri一直专注于一种叫FDG-PET的成像技术的研究。使用这项技术时,患者在进行PET扫描前会先静脉注射一种叫氟脱氧葡萄糖(fluorodeoxyglucose ,FDG)的放射性标记糖分子。肿瘤会摄取糖分子来支持它们快速生长,从而放射性的氟会让肿瘤在PET扫描时发出光,不管肿瘤在身体的哪个部位。
这样看来,FDG的加入达到了两个目的:第一,是维持成像剂的角色;第二,为光疗法提供光源。
Achilefu说:“既然FDG可以为我们提供光源,接下来的工作就是寻找一种在光刺激下可产生的有毒物质的材料。”在经过大量的筛选后,研究人员选择了由二氧化钛组成的纳米粒子。当接触光时,二氧化钛可在不需要氧气的条件下产生自由基。为了确自由基能否增加纳米粒子的效能,研究人员在纳米材料的表面添加了一种叫环戊二烯钛(titanocene)的药物。
Achilefu说:“Titanocene已作为化疗药物进入2期临床试验。它被证明是安全的,但是治疗效果不如安慰剂。它还有一个特点是可与低强度的光反应,产生自由基。因此,我们决定试试它能不能作为光疗法的药物发挥抗癌作用。”
研究人员在携带人肺部肿瘤和纤维肉瘤的小鼠模型中测试了不同的纳米粒子、Titanocene以及FDG光源的组合:FDG+纳米粒子、FDG+Titanocene以及FDG+纳米粒子+Titanocene。结果发现,FDG+纳米粒子+Titanocene组具有最显著的抗癌效果。治疗15天后,该组小鼠的肿瘤与未治理组相比小了8倍。
FDG+纳米粒子组的小鼠比未处理组小鼠(活15天)多活了15天。FDG+Titanocene组的小鼠也同样拥有30天的生存期。相比之下,FDG+纳米粒子+Titanocene组的小鼠生存期延长到了50天。
Achilefu说:“暴露在光源下,二氧化钛纳米颗粒就能够杀死癌细胞,但是添加了Titanocene后明显增加了治疗效果。它们可以产生不同种类的自由基。在我们的方法中,Titanocene的使用剂量也远远低于作为化疗药物使用的剂量。”
Kotagiri补充说:“该疗法的副作用应该是最小的。它用到的光、光感材料都是针对肿瘤的。该材料只有在光源存在的情况下才会有毒性,而光源又只存在于肿瘤部位。”目前,该研究小组正在计划一个小型的临床试验对该组合疗法的效果进行进一步的验证。
原文阅读
Innovative light therapy reaches deep tumors
来源:生物探索
为你推荐
 资讯
资讯 美的楼宇科技亮相2025CMEF,全维智变助力智慧医院绿色焕新
2025年4月8日-11日,第91届中国国际医疗器械博览会(CMEF)于上海国家会展中心拉开帷幕。在这场全球医疗健康科技的风向标盛会上,美的医疗携旗下万东医疗、楼宇科技、生物医疗等...
2025-04-10 11:41
 资讯
资讯 科赴支持权威协会发布中国首个常见轻微病症管理专家共识
近日,由中华医学会全科医学分会、中国医药教育协会药学服务专业委员会、中国健康促进与教育协会医防融合分会联合编撰的《常见轻微病症健康管理专家共识(2025版)》(以下简称...
2025-04-09 15:50
 资讯
资讯 Cytiva蛋白A层析填料新品发布 推动单抗药物纯化工艺降本增效
全新发布的MabSelect SuRe 70与MabSelect PrismA X蛋白A层析填料将大幅降低生产成本,提高生产效率
2025-04-09 13:23
 资讯
资讯 国家药监局要求进一步做好《药品生产许可证》发放有关事项
2025年7月1日以后发放的《药品生产许可证》,各省级局应统一以本行政区域内电子证照二维码形式管理,《药品生产许可证》正本、副本的纸质版和电子证照应分别标注二维码。
2025-04-08 21:34
 资讯
资讯 第91届CMEF开幕:盈康一生携AI+创新成果亮相 共建数智医疗生态
本届展会,盈康一生以“AI在海尔,因AI盈康”为主题,携旗下明星产品、AI创新场景解决方案亮相。
2025-04-08 15:54
 资讯
资讯 @医疗人士 生物相容、抗菌、精密注塑...梦寐以求的创新方案在哪?都给您归纳好了!
2025-04-08 15:10
 资讯
资讯 德国默克集团宣布与恒瑞医药再度达成合作,推进辅助生殖领域口服GnRH拮抗剂的商业化落地
根据协议条款,默克公司将向恒瑞支付1500万欧元首付款;在此基础上,恒瑞有权收取许可产品的里程碑付款及在许可区域的年度净销售额两位数百分比的销售提成。
2025-04-08 13:32
 资讯
资讯 恒瑞医药、瀚宇药业、贝达药业等医药企业对特朗普“对等关税”的回应
恒瑞医药(600276 SH)在互动平台上表示,公司海外销售业务占营业收入的比例很小,根据2024年年报数据,海外销售业务占比仅为2 56%,美国加征关税对公司业务影响非常有限。
2025-04-08 12:49
 资讯
资讯 诺和诺德与腾讯健康启动战略合作 构建数字化肥胖防控新生态
今日(4月7日),全球肥胖症治疗领域领导者诺和诺德,与腾讯健康宣布达成战略合作。在国家持续推进“体重管理年”行动的背景下,双方将依托基于微信平台的“腾讯健康”小程序与...
2025-04-07 17:52
 资讯
资讯 复星雅立峰自研国内首款无血清病毒培养工艺狂犬病疫苗上市
次新上市的产品采用无明胶、无右旋糖酐、无抗生素和防腐剂的纯净配方,可以系统性降低接种不良反应风险,填补了国内狂犬病疫苗市场空白。
2025-04-07 16:42
 资讯
资讯 去年亏超9亿,达安基因出现上市以来最大亏损
近日,达安基因发布了2024年年报,业绩报显示,其2024年实现营收8 53亿元,较上年同期减少3 28亿元,同比下降27 76%。
2025-04-07 14:27
 资讯
资讯 皮尔法伯集团与RedRidge Bio宣布达成药物发现及联合开发合作伙伴关系
近日,皮尔法伯集团与RedRidge Bio(以下简称RedRidge)宣布达成独家研发合作和许可协议,合作进行针对多靶点的双特异性抗体(BPA)候选药物识别及开发工作。
2025-04-07 14:20
 资讯
资讯 商务部对原产于美国、印度的进口相关医用CT球管发起反倾销立案调查,同时发起产业竞争力立案调查
产品描述为适用于16排及以上计算机断层扫描(CT)设备的进口医用X射线CT球管以及适配以上球管的管芯(包括单独管芯、球管半成品、完整球管等多种形式)。
2025-04-04 23:10