昨日,CFDA官网发布了关于征求《医疗器械生产质量管理规范体外诊断试剂附录》意见的函(食药监械监便函〔2015〕10号),向社会公开征求按照医疗器械管理的体外诊断试剂的生产实施细则内容。该征求意见函是继2月9日CFDA向社会公开征求《无菌医疗器械附录》和《植入性医疗器械附录》意见函的姊妹篇。
它的发布,表明CFDA为了配合即将于3月1日实施的《医疗器械生产质量管理规范》,而展开的规则密集制定活动。体外诊断试剂,植入性医疗器械、无菌医疗器械三者的共性之一,就是安全有效性要求十分高,在生产管理上有着极高的要求。根据CFDA推进医疗器械生产质量管理规范体系的思路,先难后易!如能先把三块难啃的骨头拿下,其他医疗器械的生产质量管理就将水到渠成。
因此,本次向社会公开征求意见,也许是三大附录向社会征求意见的最后一次。相关企业应该发出自己的声音,与其在规则实施之后满腹牢骚,还不如在规则制定之前提出意见!下附征求意见函全文,以飨读者!
医谷+
《医疗器械生产质量管理规范体外诊断试剂附录》全文
各省、自治区、直辖市食品药品监督管理局,有关单位:
根据新修订的《医疗器械生产质量管理规范》,我司组织对《体外诊断试剂生产实施细则(试行)》(国食药监械〔2007〕239号文附件2)进行了修订,形成了《医疗器械生产质量管理规范体外诊断试剂附录(征求意见稿)》(见附件)。
现公开征求意见,请于2015年2月25日前将意见和建议反馈我司。各省、自治区、直辖市食品药品监督管理部门应同时将书面意见和电子版反馈至我司,其他单位或人员的意见可以电子邮件或传真形式报送。
联 系 人:尹宏文、李一捷
联系电话:010-87559077、88331429
传 真:010-87559074
电子邮箱:hongwen1962@163.com
食品药品监管总局器械监管司
2015年2月16日
附件
体外诊断试剂(征求意见稿)
第一部分 范围和原则
1.1 本附录适用于按照医疗器械管理的体外诊断试剂。
1.2 本附录是对体外诊断试剂生产质量管理规范的特殊要求。
第二部分 特殊要求
2.1 体外诊断试剂生产、技术和质量管理人员应当具有医学、检验学、生物学、免疫学或药学等与所生产产品相关的专业知识,并具有相应的实践经验,以确保在其生产、质量管理中履行职责。
2.2 从事体外诊断试剂生产的全体人员,包括清洁、维修等人员均应当根据其产品和所从事的生产操作进行专业和安全防护培训。
2.3 凡在洁净室(区)工作的人员应当定期进行卫生和微生物学基础知识、洁净作业等方面培训。临时进入洁净室(区)的人员,应当对其进行指导和监督。
2.4 洁净室(区)内的人数应当与洁净室(区)面积相适应。
2.5 应当建立对人员的清洁要求,制定洁净室(区)工作人员卫生守则。人员进入洁净室(区)应当按照程序进行净化,并穿戴洁净工作服、工作帽、口罩、工作鞋。裸手接触产品的操作人员每隔一定时间应当对手再次进行消毒。消毒剂的种类应当定期更换。
2.6 应当制定人员健康要求,建立人员健康档案。直接接触物料和产品的操作人员每年至少体检一次。患有传染性和感染性疾病的人员不得从事直接接触产品的工作。
2.7 应当明确人员服装要求,制定洁净和无菌工作服的管理规定。工作服及其质量应当与生产操作的要求及操作区的洁净度级别相适应,其式样和穿着方式应当能够满足保护产品和人员的要求。洁净工作服和无菌工作服不得脱落纤维和颗粒性物质,无菌工作服应当能够包盖全部头发、胡须及脚部,并能阻留人体脱落物。
2.8 应当有整洁的生产环境。厂区的地面、路面周围环境及运输等不应对产品的生产造成污染。行政区、生活区和辅助区的总体布局合理,不得对生产区有不良影响。厂区应当远离有污染的空气和水等污染源的区域。
2.9 生产厂房应当设置防尘、防止昆虫和其他动物进入的设施。洁净室(区)的门、窗及安全门应当密闭,洁净室(区)的门应当向洁净度高的方向开启,安全门应当向安全疏散方向开启。
2.10 应当根据体外诊断试剂的生产过程控制,确定在相应级别的洁净室(区)内进行生产的过程,避免生产中的污染。空气洁净级别不同的洁净室(区)之间的静压差应当大于5帕斯卡,洁净室(区)与室外大气的静压差应大于10帕斯卡,并应当有指示压差的装置。相同级别洁净室间的压差梯度应当合理。
2.11 酶联免疫吸附试验试剂、免疫荧光试剂、免疫发光试剂、聚合酶链反应(PCR)试剂、金标试剂、干化学法试剂、细胞培养基、校准品与质控品、酶类、抗原、抗体和其他活性类组分的配制及分装等产品的配液、包被、分装、点膜、干燥、切割、贴膜、以及内包装等,生产区域应当不低于100,000级洁净度级别。
2.12 阴性、阳性血清、质粒或血液制品等的处理操作,生产区域应当不低于10,000级洁净度级别,并应当与相邻区域保持相对负压。
2.13 无菌物料等分装处理操作,生产区域应当不低于100级洁净度级别。
2.14 普通类化学试剂的生产应当在清洁环境中进行。
2.15 洁净室(区)空气洁净度级别应当符合下表规定:
2.16 洁净室(区)应当按照体外诊断试剂的生产工艺流程及所要求的空气洁净度级别进行合理布局,人流、物流走向应当合理。同一洁净室(区)内或相邻洁净室(区)间的生产操作不得互相交叉污染。
2.17 进入洁净室(区)的管道、进回风口布局应当合理,水、电、气输送线路与墙体接口处应当可靠密封,照明灯具不得悬吊。
2.18 洁净室(区)的温度和相对湿度应当与产品生产工艺要求相适应。无特殊要求时,温度应当控制在18~28℃,相对湿度控制在45%~65%。
2.19 洁净室(区)和非洁净室(区)之间应有缓冲设施。
2.20 洁净室(区)的内表面(墙面、地面、天棚、操作台等)应当平整光滑、无裂缝、接口严密、无颗粒物脱落,避免积尘,并便于清洁处理和消毒。
2.21 洁净室(区)的空气如循环使用应当采取有效措施避免污染和交叉污染。
2.22 洁净室(区)内的水池、地漏应安装防止倒灌的装置,避免对环境和物料造成污染。
2.23 产尘操作间应当保持相对负压或采取有效措施,防止粉尘扩散、避免交叉污染。
2.24 对具有污染性、传染性和高生物活性的物料应当在受控条件下进行处理,避免造成传染、污染或泄漏等。
2.25 生产激素类、操作有致病微生物、芽胞菌制品的,应当使用单独的空气净化系统,与相邻区域保持负压,排出的空气不能循环使用。
2.26 进行危险度二级及以上的病原体操作应当配备生物安全柜,空气应当进行过滤处理后方可排出。应当对过滤器的性能进行定期检查以保证其有效性。使用病原体类检测试剂的阳性血清应当有相应的防护措施。
2.27 对于特殊的高致病性病原体的采集、制备,应当按照有关部门颁布的行业标准《人间传染病微生物名录》、《微生物和生物医学实验室生物安全通用准则》《实验室生物安全通用要求》等相关规定,配备相应的生物安全设施。
2.28 生产聚合酶链反应(PCR)试剂的,其生产和检验应当在各自独立的建筑物中,防止扩增时形成的气溶胶造成交叉污染。其生产和质检的器具不得混用,用后应严格清洗和消毒。
2.29 对生产环境没有空气净化要求的体外诊断试剂,应当在清洁环境内进行生产。
清洁条件的基本要求:要有防尘、通风、防止昆虫、其他动物以及异物混入等措施;人流物流分开,人员进入生产车间前应当有换鞋、更衣、佩戴口罩和帽子、洗手、手消毒等清洁措施;生产场地的地面应当便于清洁,墙、顶部应平整、光滑,无颗粒物脱落;操作台应当光滑、平整、无缝隙、耐腐蚀,便于清洗、消毒;应当对生产区域进行定期清洁、清洗和消毒;应当根据生产要求对生产车间的温湿度进行控制。
2.30 易燃、易爆、有毒、有害、具有污染性或传染性、具有生物活性或来源于生物体的物料的管理应当符合国家相关规定。所涉及的物料应当列出清单,专区存放、专人保管和发放,并制定相应的防护规程。
2.31 动物室应当在隔离良好的建筑体内,与生产、质检区分开,不得对生产造成污染。
2.32 洁净室(区)空气净化系统应当保持连续运行,维持相应的洁净度级别。若停机后再次开启空气净化系统,应当进行必要的测试或验证,以确认仍能达到规定的洁净度级别要求。
2.33 应当确定所需要的工艺用水,工艺用水应当满足产品质量的要求。应当配备相应的制水设备,通过管道输送至洁净区的用水点,并有防止污染的措施。
2.34 应当制定工艺用水的管理文件,工艺用水的储罐和输送管道应当满足产品要求,并定期清洗、消毒。
2.35配料罐容器与设备连接的主要固定管道应当标明内存的物料名称、流向,定期清洗和维护,并标明设备运行状态。
2.36 洁净室(区)内使用的压缩空气等工艺用气均应当经过净化处理。与产品使用表面直接接触的气体,其对产品的影响程度应当进行验证和控制,以适应所生产产品的要求。
2.37 生产设备、容器具等应当符合洁净环境控制和工艺文件的要求。
2.38 与物料或产品直接接触的设备、容器具及管道表面应当光洁、平整、无颗粒物质脱落、无毒、耐腐蚀,不与物料或产品发生化学反应和粘连,易于清洁处理和消毒或灭菌。
2.39 应当按照物料的性状和储存要求进行分类存放管理,应当明确规定中间品的储存条件和期限。
物料应当在规定的使用期限内、按照先进先出的原则使用,无规定使用期限的,应当根据物料的稳定性数据确定储存期限。储存期内发现存储条件变化且可能影响产品质量时,应及时进行复验。
2.40 需要冷藏、冷冻的原料、半成品、成品,应当配备相应的冷藏、冷冻设备,并按规定监测设备运行状况、记录储存温度。
2.41 进入洁净室(区)的物品应当按程序进行净化处理。
2.42 在生产过程中,应当建立产品标识和生产状态标识控制程序,对现场各类物料和生产区域、设备、管路的状态进行识别和管理。
2.43 应当对每批产品中关键物料进行物料平衡核查。如有显著差异,必须查明原因,在得出合理解释,确认无潜在质量事故后,方可按正常产品处理。
2.44 应当制定批号管理制度,对主要物料、中间品和成品按规定进行批号管理,并保存和提供可追溯的记录。同一试剂盒内各组分批号不同时应尽量将生产日期接近的组分进行组合,应当在每个组分的容器上均标明各自的批号和有效期。整个试剂盒的有效期应以效期最短组分的效期为准。
2.45 不同品种产品的生产应当做到有效隔离,以避免相互混淆和污染。有数条包装线同时进行包装时,应当采取隔离或其他有效防止混淆的措施。
2.46 应当制定洁净室(区)的卫生管理文件,按照规定对洁净室(区)进行清洁处理和消毒,并作好记录。所用的消毒剂或消毒方法不得对设备、容器具、物料和产品造成污染。消毒剂品种应当定期更换,防止产生耐药菌株。
2.47 生产设备所用的润滑剂、清洗剂均不得对产品造成污染。
2.48 应当建立清场的管理规定。前一道工艺结束后或前一种产品生产结束后必须进行清场,确认合格后才可以入场进行其他生产,并保存清场记录。相关的配制和分装器具必须专用,使用后进行清洗、干燥等洁净处理。
2.49 应当建立可追溯性程序并形成文件,应当规定可追溯性的范围、程度、标识和记录。记录应当包括生产过程所用的原材料、生产设备、操作人员和生产环境等内容。
2.50 生产一定周期后,应当对关键项目进行再验证。当影响产品质量的主要因素,如工艺、质量控制方法、主要原辅料、主要生产设备等发生改变时,质检或用户反馈出不合格项时,应当进行相关内容的重新验证。
2.51 生产车间停产超过十二个月,重新组织生产前应当对生产环境及设施设备、主要原辅材料、关键工序、检验设备及质量控制方法等重新进行验证。
2.52 外购的标准品、校准品、质控品、生产用或质控用血液的采购应满足可追溯性要求。应当由企业或提供机构测定病原微生物及明确定值范围;应当对其来源地、定值范围、灭活状态、数量、保存、使用状态等信息有明确记录,并由专人负责。
2.53 应当对制备的校准品、参考品量值进行溯源。
2.54 生产和检验用的菌毒种应当标明来源,验收、储存、保管、使用、销毁应执行国家有关医学微生物菌种保管的规定和病原微生物实验室生物安全管理条例。应当建立生产用菌毒种的原始种子批、主代种子批和工作种子批系统。
2.55 生产用细胞应当建立原始细胞库、主代细胞库、工作细胞库。应当建立细胞库档案资料和细胞操作日志。自行制备抗原或抗体,应当对所用原料的来源和性质有详细的记录并可追溯。
2.56 应当对生产用需要灭活的血清或血浆建立病毒灭活处理的操作规程,并按照操作规程的要求,对生产用灭活前后的血清或血浆状态进行明显的区分和标识。
2.57 生产中的废液、废物等应当进行无害化处理,并符合相关的环保要求。
2.58 应当对检验过程中使用的标准品、校准品、质控品建立台帐及使用记录。应当记录其来源、批号、效期、溯源途径、主要技术指标、保存状态等信息,按照规定进行复验并保存记录。
2.59 留样应当在规定条件下储存。应当建立留样台帐,及时记录留样检验信息,留样检验报告应当注明留样批号、效期、检验日期、检验人、检验结果等。留样期满后应当对留样检验报告进行汇总、分析并归档。
2.60 研制条件,包括配合使用的设备、仪器和试剂应当满足研究所需,研制所用的设备、仪器和试剂应当保存使用记录。
2.61 研制过程中主要原料、中间体、重要辅料应当明确来源,其数量、使用量及其剩余量应当保存记录。
2.62 工艺研究、标准研究、稳定性研究、检验、临床试验等各个阶段的样品数量、贮存条件、留样、使用或销毁情况应当保存记录,样品试制量应当满足从事研究所需要的数量。
2.63 委托研究的,应当保存委托研究合同及有关证明文件。
第三部分 术语
3.1 下列术语的含义是:
物料:原料、辅料、包装材料、中间品等。
主要物料:试剂产品组成中在性能上起到主要作用的成分。
物料平衡:在适当考虑可允许的正常偏差的情况下,产品或物料的理论产量或理论用量与实际产量或用量之间持平。
来源:CFDA官网 中国医疗器械 医谷综合
为你推荐
 资讯
资讯 悦唯医疗完成近亿元A++轮投资,加速重症冠心病诊疗全流程创新器械研发与国产替代
此次融资将主要用于深化冠心病诊疗全流程创新器械和脉动式左心室辅助系统等新产品的研发,以及加速已获准上市的心脏稳定器等产品的市场推广。
2025-04-03 09:28
 资讯
资讯 海尔盈康一生启动孤独症儿童关爱行动,创新罕见病可持续公益新生态
本次活动聚焦孤独症儿童的诊疗,探讨交流AI赋能全流程防治康体系创新、前沿性生物科技诊疗技术等话题,旨在通过生态联盟的力量推动医学研究、科技创新与人文关怀的融合,让“星...
2025-04-03 09:11
 资讯
资讯 《NPJ digital medicine》刊发李冬梅教授团队成果:AI赋能高效识别眼睑肿物
亚太眼整形外科学会主席、中华医学会眼科分会眼整形眼眶病学组副组长李冬梅教授团队携手爱尔数字眼科研究所,在《NPJ digital medicine》(影响因子:12 4)学术期刊发表团队...
文/李林 2025-04-02 10:27
 资讯
资讯 默克全球执行副总裁周虹:合作与创新是默克未来五年战略的两大关键词
近日,德国默克医药健康全球执行副总裁、中国及国际市场负责人周虹带领医药健康中国及国际市场管理团队开启了2025年度首次“中国行”。
2025-04-01 17:11
 资讯
资讯 首个且唯一,阿斯利康PD-L1单抗获FDA批准治疗肌层浸润性膀胱癌
度伐利尤单抗联合吉西他滨和顺铂作为新辅助治疗,随后度伐利尤单抗作为根治性膀胱切除术后的辅助单药治疗,用于治疗肌层浸润性膀胱癌成年患者。
2025-04-01 14:37
 资讯
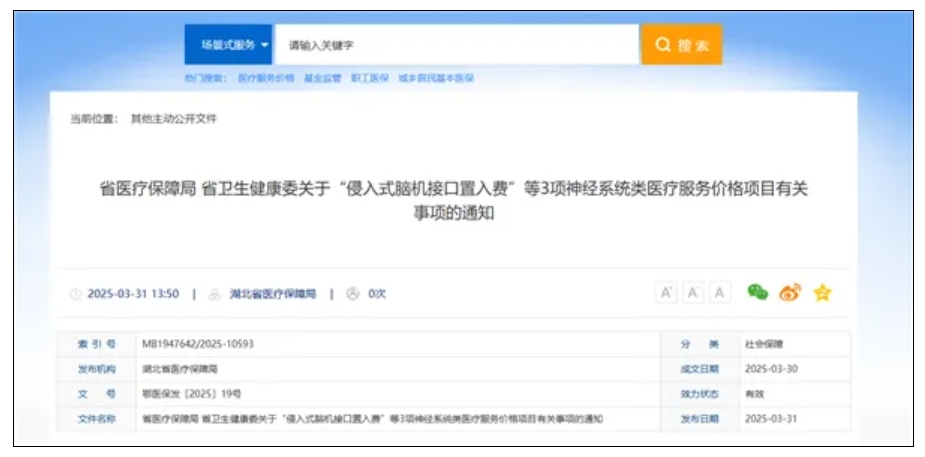
资讯 全国首个,湖北为脑机接口医疗服务定价
昨日(3月31日),据“湖北发布”消息,湖北省医保局发布全国首个脑机接口医疗服务价格,其中,侵入式脑机接口置入费6552元 次,侵入式脑机接口取出费3139元 次,非侵入式脑机...
2025-04-01 11:03
 资讯
资讯 一款国产创新流感药,获批
近日,据国家药监局官网信息显示,青峰医药下属子公司江西科睿药自主研发的1类创新药玛舒拉沙韦片(商品名:伊速达)正式获批上市,用于既往健康的12岁及以上青少年和成人单纯性...
2025-04-01 10:22
 资讯
资讯 26省联盟药品集采启动,聚焦妇科用药和造影剂
近日,山西省药械集中招标采购中心发布《关于做好二十六省联盟药品集中带量采购品种数据填报工作的通知》,开展相关采购数据填报工作。
2025-03-31 21:48
 资讯
资讯 优时比罗泽利昔珠单抗注射液(优迪革)中国获批,全球首个且唯一双亚型创新药治疗全身型重症肌无力
作为唯一人源化、高亲和力且具备创新修饰结构的IgG4单抗,关键Ⅲ期MycarinG试验证实罗泽利昔珠单抗注射液(优迪革®)较安慰剂显著改善全身型重症肌无力患者的多个临床终点与结局。
2025-03-31 15:58
 资讯
资讯 从手术麻醉到生命全周期护航,麻醉学科发展拓宽生命边界
3月26日,由中华医学会麻醉学分会、中国医师协会麻醉学医师分会等23家学协会共同举办的2025年中国麻醉周学术活动的启动仪式举办,该活动以“生命之重,大医精诚——守生命保驾护...
2025-03-31 15:30
 资讯
资讯 欧狄沃联合逸沃成为中国目前唯一获批的肝细胞癌一线双免疫联合疗法
欧狄沃联合逸沃对比仑伐替尼或索拉非尼,可显著改善不可切除肝细胞癌一线患者的总生存期(OS),客观缓解率(ORR)可改善近3倍,中位缓解持续时间(mDOR)达30个月
2025-03-31 13:45
 资讯
资讯 罗氏制药榜首 “现金牛” 产品罗可适(奥瑞利珠单抗)在华获批:开启多发性硬化症一年两次治疗新时代
罗氏制药今日(3月31日)宣布,其旗下创新药罗可适®(Ocrevus®,通用名:奥瑞利珠单抗注射液 ocrelizumab injection)正式获得中国国家药品监督管理局批准,每六个月静脉输...
2025-03-31 13:39
 资讯
资讯 三生有幸,医者仁心:三生制药向全体医药工作者致敬!
3月30日是国际医师节,由三生制药公益支持的以“三生有幸,医者仁心”为主题的公益活动,携手20位医生代表,以寄语海报的形式,共同向全体医护人员表达诚挚的祝福与关爱。
2025-03-30 17:38
 资讯
资讯 新版药典自2025年10月1日起实施
3月25日,国家药监局官网发布《国家药监局 国家卫生健康委关于颁布2025年版的公告(2025年第29号)》,2025年版《中国药典》自2025年10月1日起施行。
2025-03-30 17:07