如今,不少研究者认为电刺激治疗领域正在扩大,对迷走神经或其他周围神经的脉冲刺激或可为许多疾病提供治疗,比如糖尿病、高血压、心血管疾病、代谢疾病以及自身免疫疾病。
卡特琳是居住在阿姆斯特丹的一位70岁的健身教练,她于五年前加入了一项临床试验。她的脖子下方有个植入的装置,该装置受到外在磁铁作用时可以发射电脉冲,通过刺激迷走神经而改善她的风湿性关节炎(一种自身免疫疾病)症状。
这项临床试验暗示着二十多年来关于神经和免疫系统的关联研究进入了新时代。
1998 年,正研究一种称为 CNI-1493 的实验药物的研究人员偶然发现,相比静脉注射,向大鼠大脑中直接注射该药物,能够更有效地降低大鼠全身范围的TNF-α(肿瘤坏死因子,一种炎性因子标志物)水平,进而抑制炎症反应。
于是,研究人员猜测CNI-1493可能是作用于神经细胞的信号传导而影响了免疫系统的反应。后续实验表明,通过切断神经,该药物的有效作用也会消失。而且,经过电脉冲刺激治疗的小鼠,可以通过降低TNF-α的水平,有效拮抗药物所致的败血性休克。
这说明迷走神经除了能够调节心跳、呼吸和消化道肌肉的收缩,也可以控制炎症。这个发现大大拓展了迷走神经电刺激的治疗领域,意味着该技术或许能够取代药物,达到相同或者更好的治疗效果。
那么这背后的分子机制是什么呢?
研究人员通过使用神经递质抑制剂,或者在不同位置损伤迷走神经纤维,来判断电刺激起作用的位置和机制。这些实验表明,当迷走神经被电击时,脉冲信号传向腹部,然后通过另一条神经纤维进入脾脏。
这条神经纤维通过释放出神经递质——去甲肾上腺素,直接与脾脏中的T细胞进行通信。神经元和T细胞的交界面类似于两个神经细胞之间的突触,T细胞就像神经元一样起作用。
T细胞激活后释放出的另一种神经递质——乙酰胆碱,可与脾脏中的巨噬细胞结合,进而抑制巨噬细胞产生炎症蛋白,遏制炎症。
这无疑是一项令人惊讶的发现。不过,早在此之前,就有研究人员在多种动物的不同器官中观察到了神经元—T细胞突触结构。不同的是,这类神经元属于交感神经。
2014年,日本的神经免疫学家证实了一点:受到交感神经信号刺激的T细胞,更倾向于在淋巴结中停留,而不是进入血液循环,从而降低了在身体其他组织中引发炎症的可能性。然而,在多种自身免疫疾病状态下,这类神经信号往往被破坏。
美国的神经生物学家发现,患有自身免疫疾病的大鼠的交感神经通路活性变得异常,在人类中也有类似的情况。由于过度释放去甲肾上腺素,导致交感神经受损。随着疾病进展,功能异常的交感神经与多种免疫细胞的亚群形成突触连接,并最终导致炎症反应不减反增。
尽管有研究人员质疑迷走神经与T细胞的关联是否真的存在,仍不可否认迷走神经电刺激技术治疗自身免疫疾病的潜力。
多种自身免疫疾病中都存在交感神经功能异常激活,而迷走神经的功能活性却被抑制。电刺激技术对迷走神经的刺激,可能使得两类神经系统之间的平衡得到部分重置。
人类的迷走神经系统含有十万多个神经纤维细胞,它们伸入不同的组织器官中,形成了庞大的网络结构。而激活不同神经纤维所需的电流强度也显然不同,可能有50倍的差距。其中,参与降低炎症反应的神经纤维有着较低的阈值。
相比用于治疗癫痫的电刺激强度,只需很小的剂量即可长时间控制炎症。人的临床试验证实了电刺激对炎症反应的控制,受试者血液中的 TNF-α 和白介素 6 有显著降低,在关闭植入装置 14 天后,这种改善消失,在重新开启装置后得到恢复。该项研究发表在 2016 年 7 月的PNAS上。
然而,这种技术在临床使用中还需克服另一个难点。与其他动物不同,人类基因组还编码一种非功能性乙酰胆碱受体蛋白。美国加州大学圣地亚哥分校的研究人员发现,如果人体内这类受体蛋白异常高表达,将导致巨噬细胞对乙酰胆碱信号失去反应而继续释放TNF-α,使得迷走神经电刺激失效。
之前的临床试验显示,部分人对电刺激迷走神经技术没有反应,这可能就是与体内异常表达的受体蛋白有关。通过检测病人体内这类受体蛋白的表达水平,有助于筛选出适用该技术的病人。
去年十月,一项本领域相关的研究项目得到美国国立卫生研究院的资助。制药公司GSK也对该领域表现出了浓厚兴趣,并已投资展开研发。迷走神经电刺激疗法是否能达到预期效果,仍有待观察。尤其是目前接受治疗的人数较少,而且人们对早期试验取得的效果常常过于乐观。
尽管如此,有关神经系统与免疫系统的关联探索及相关疗法的试验,为患者开辟出了新的治疗方案。或许不远的将来,用电刺激疗法取代药物不再只是梦想。
参考文献
Nature545,20–22(04 May 2017)
来源:DeepTech深科技(微信号 mit-tr)
为你推荐
 资讯
资讯 “和合共生,健康共护”四价HPV疫苗男性适应证上市暨“HPV男女共防计划”启动新闻发布会成功举办,共筑HPV预防新生态
今日(1月18日),默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)举办的“和合共生,健康共护”四价HPV(人乳头瘤病毒)疫苗男性适应证上市暨“HPV男女共防计划”启动...
2025-01-18 18:31
 资讯
资讯 四同药品价格治理已基本实现,正建设全国挂网药品价格一览表
目前,我们正在建设全国挂网药品价格一览表,全量汇总展示各地挂网价格信息并对首涨、高涨幅等异常价格行为予以标识,敦促各地持续纠正不合理的挂网高价。
2025-01-18 12:15
 资讯
资讯 2025年全国80%左右医保统筹地区基本实现即时结算,2026年底全部实现即时结算
1月16日,国家医疗保障局办公室正式对外发布《关于推进基本医保基金即时结算改革的通知》。根据通知,以全国统一的医保信息平台为支撑,2025年全国80%左右统筹地区基本实现即时...
2025-01-18 11:20
 资讯
资讯 2024年底,60岁及以上人口3.1亿,占全国人口的22.0%
年末全国人口(包括31个省、自治区、直辖市和现役军人的人口,不包括居住在31个省、自治区、直辖市的港澳台居民和外籍人员)140828万人,比上年末减少139万人。全年出生人口954...
2025-01-17 14:56
 资讯
资讯 赛诺菲荣膺“杰出雇主2025”桂冠,连续五年傲立榜首
作为10多年来首个且唯一连续五年荣获此殊荣的企业,赛诺菲再次彰显了其在企业文化、人才战略、多元发展及员工培养等方面的卓越成就。
2025-01-17 11:02
 资讯
资讯 又一款国产三代EGFR-TKI抑制剂获批上市
昨日(1月16日),据国家药监局官网显示,奥赛康药业的1类创新药利厄替尼片(limertinib ASK120067,商品名:奥壹新)获批上市,用于治疗既往接受表皮生长因子受体酪氨酸激酶抑制...
2025-01-17 10:31
 资讯
资讯 增辉生命,默沙东中国再度荣膺“中国杰出雇主”
1月16日,由全球权威的杰出雇主调研机构(Top Employers Institute)颁布的“杰出雇主2025”榜单正式揭晓
2025-01-16 22:48
 资讯
资讯 国家市场监督管理总局发布《医药企业防范商业贿赂风险合规指引》
本指引所称的商业贿赂, 是指采用财物或者其他手段贿赂交易相对方的工作人员、 受交易相对方委托办理相关事务的单位或者个人、 利用职权或者影响力影响交易的单位或者个人,...
2025-01-14 23:38
 资讯
资讯 阿斯利康与宜联生物达成临床研究合作,共同探索联合治疗创新方案
双方将共同启动一项多中心、开放性、I Ib期研究,旨在评估两款药物联合治疗在实体肿瘤患者中的安全性、有效性和药代动力学。
2025-01-14 18:36
 资讯
资讯 NVIDIA与多家行业顶尖机构达成深度合作,共促医疗健康产业蓬勃发展
在日前举办的摩根大通医疗健康大会上,NVIDIA 宣布与多家行业领先机构达成合作,这类新的合作旨在通过加速药物发现、提升基因组研究,以及利用代理式和生成式 AI 开创先进医...
2025-01-14 13:26
 资讯
资讯 老牌上市药企终止PD-1项目,计提资产减值准备1.75亿元
近日,丽珠医药集团发布公告称,对公司及下属子公司截至2024年12月31日合并报表范围内存在减值迹象的资产进行了减值测试,并对其中存在减值迹象的资产相应计提了减值准备。
2025-01-14 10:13
 资讯
资讯 尊享e生2025升级:首次全场景放开外购药械,医院药品覆盖数量再增
1月13日,众安保险举办“与10光,共生长”尊享e生十周年产品升级发布会,正式发布尊享e生2025版,并推出众安健康险未来将主打的两大产品系列——面向健康人群的“尊享系列”,以...
2025-01-13 20:17
 资讯
资讯 PLA材料的医美应用:安全与效果的双重考验
聚乳酸PLA,作为医美行业面部填充剂历经了3个时代大约20多年的发展,大体可分为1 0、2 0、3 0三个不同的时代;即1 0-结晶片状;2 0-普遍表面粗糙的多孔微球或实心微球;3 ...
2025-01-13 19:53
 资讯
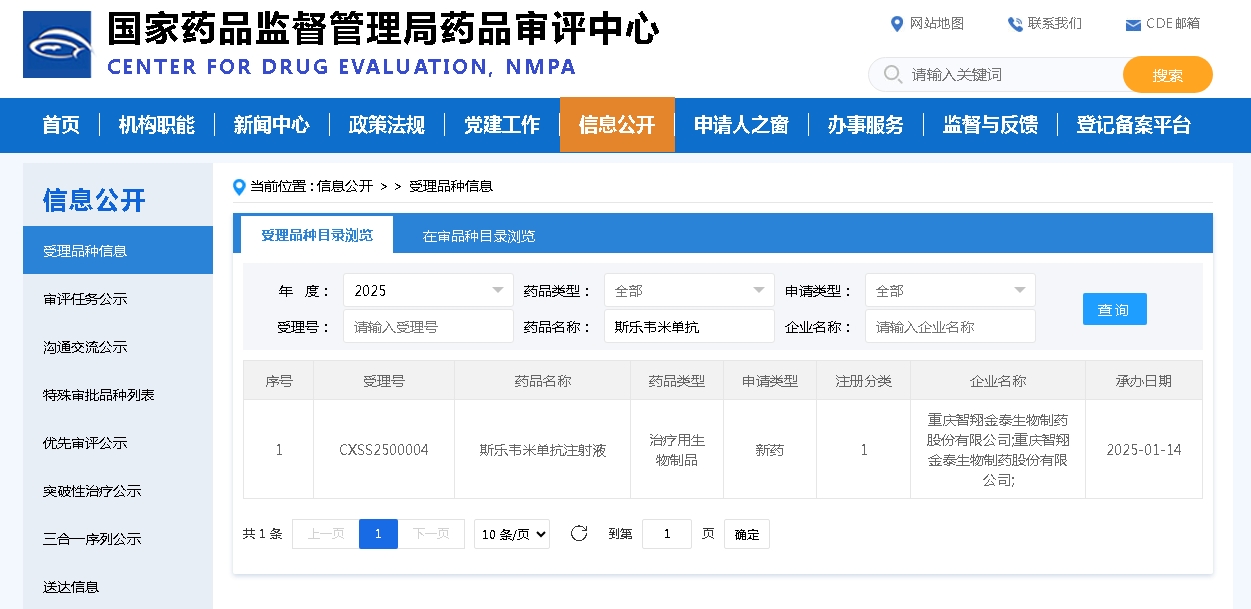
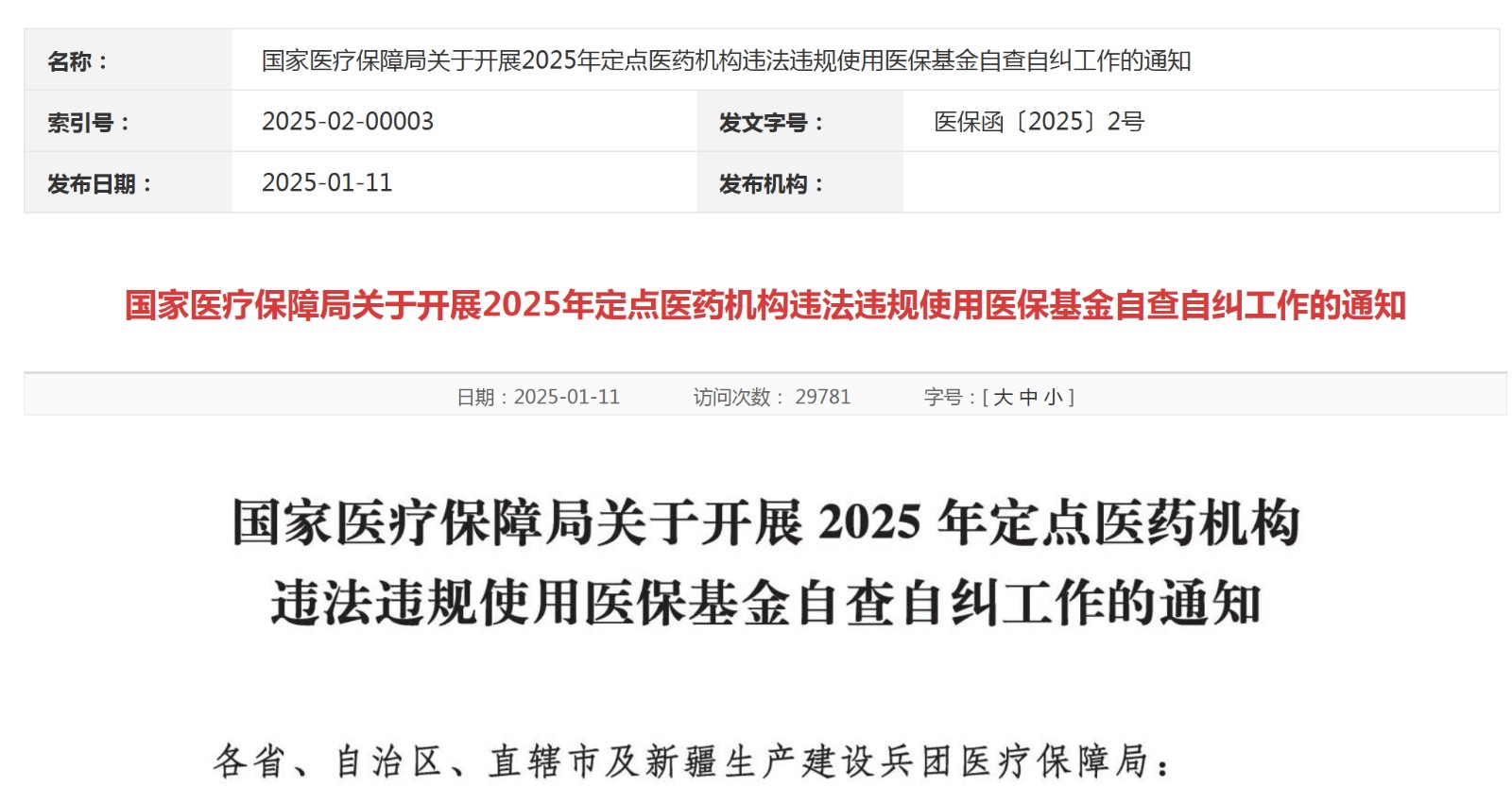
资讯 国家医保局:开展2025年定点医药机构违法违规使用医保基金自查自纠工作,肿瘤类、重症医学类、麻醉类、零售药店典型问题清单
2025年3月底前,各级医保部门根据本地化问题清单,对辖区内所有定点医疗机构和定点零售药店2023-2024年医保基金使用情况开展自查自纠。2025年4月起,国家医保局将对全国定点医药...
2025-01-13 17:32
 资讯
资讯 好大夫正式牵手蚂蚁集团,共同推进“AI+医疗”创新
蚂蚁集团收购好大夫在线尘埃落定。1月11日,在2025年好大夫峰会上,双方在收购完成后首度携手亮相。好大夫在线创始人王航现场表示,共同的使命和愿景让双方走到了一起,后续好大...
2025-01-11 18:05