3月17日,国际学术期刊《自然》(Nature)在线发表了中国科学院上海生命科学研究院生物化学与细胞生物学研究所分子生物学国家重点实验室/国家蛋白质科学中心(上海)许琛琦研究组和分子生物学国家重点实验室李伯良研究组的合作研究成果《通过调节胆固醇代谢增强CD8+T细胞的抗肿瘤反应》(Potentiating the antitumour response of CD8+T cells by modulating cholesterol metabolis)。该成果发现“代谢检查点”可以调控T细胞的抗肿瘤活性,鉴定了肿瘤免疫治疗的新靶点——胆固醇酯化酶ACAT1以及相应的小分子药物前体,为开发新的肿瘤免疫治疗方法奠定了基础。
人体的免疫系统负责保卫机体健康,其中T细胞在肿瘤的监控和杀伤中起着至关重要的作用。然而肿瘤细胞能通过多种机制来抑制T细胞的抗肿瘤活性,从而逃避免疫系统的攻击。在临床上,可以通过提高T细胞的活性来治疗肿瘤。目前,基于T细胞的肿瘤免疫治疗已经取得巨大的成功,具有广泛的应用前景。但是现有的治疗方法只对部分病人有效,并有一定的副作用。因此科学家需要开发新的肿瘤免疫治疗方法来改善疗效并让更多的病人受益。
许琛琦研究团队和李伯良研究团队从全新角度去研究T细胞的抗肿瘤免疫功能。科研人员认为通过调控T细胞的“代谢检查点”可改变其代谢状态,使其获得更强的抗肿瘤效应功能。科研人员发现T细胞代谢通路中的胆固醇酯化酶ACAT1是一个很好的调控靶点,抑制ACAT1的活性可以大大提高CD8+T细胞(又名杀伤性T细胞)的抗肿瘤功能。因为ACAT1被抑制后,杀伤性T细胞膜上的游离胆固醇水平提高,从而让T细胞肿瘤抗原免疫应答变得更加高效。同时,科研人员还利用ACAT1的小分子抑制剂avasimibe在小鼠模型中治疗肿瘤,发现该抑制剂具有很好的抗肿瘤效应;并且avasimibe与现有的肿瘤免疫治疗临床药物anti-PD-1联用后效果更佳。该项研究开辟了肿瘤免疫治疗研究的一个全新领域,证明细胞代谢对肿瘤免疫应答起到了关键作用,同时发现ACAT1这一新的药物靶点,揭示ACAT1小分子抑制剂的应用前景,为肿瘤免疫治疗提供了新思路与新方法。
该项研究得到了生化与细胞所研究员刘小龙、清华大学教授刘万里、武汉大学教授宋保亮、中山大学教授周鹏辉、美国德州大学安德森癌症中心教授孙少聪以及美国达特茅斯医学院教授Ta-Yuan Chang 的大力帮助,并得到国家自然科学基金委、国家科技部、中国科学院先导专项及上海市科委的经费支持。该研究工作还得到国家蛋白质科学研究(上海)设施复合激光显微镜系统、生化与细胞所动物分析技术平台、细胞分析技术平台以及分子生物学技术平台的大力支持。
来源:中国科学院
为你推荐
 资讯
资讯 CDE:晚期胃癌新药临床试验设计指导原则
胃癌(Gastric cancer, GC) 是我国高发的消化系统恶性肿瘤, 其新发病例数和死亡病例数分别位列我国恶性肿瘤发病和死亡的第 5 位和第 3 位。
2025-02-21 21:19
 资讯
资讯 首款依视路星趣控眼镜于上海眼镜展全球首秀 专为近视管理设计 延缓中国儿童青少年近视进展
依视路星趣控眼镜提供符合人体工程学设计的镜架,满足不同年龄段的孩子在面部结构和尺寸上的显著差异,尺码范围广,覆盖38号至50号,为3-5岁儿童,6-9岁和10-12岁青少年年龄段提...
2025-02-21 17:33
 资讯
资讯 百林科完成A+轮战略融资数亿元,多家投资机构联合投资
百林科成立于2021年9月10日,是一家专注于疫苗、抗体药物、重组蛋白、细胞治疗、基因治疗、血液制品以及其他生物制品关键工艺设备与耗材研发和制造的高科技企业。
2025-02-21 13:30
 资讯
资讯 深研生物完成超3亿元B+轮融资,越秀产业基金领投
深研生物成立于2014年,是一家专注于细胞与基因治疗(CGT)领域的高新技术企业,致力于为核心技术与设备的自主研究和开发提供整体解决方案。
2025-02-21 13:23
 资讯
资讯 阿斯利康以1.6亿美元收购珐博进中国,获得罗沙司他在中国的独家权利
昨日(2月20日)晚间,阿斯利康在其官微宣布与珐博进有限公司达成协议,将以约1 6亿美元收购珐博进中国。
2025-02-21 10:20
 资讯
资讯 快速崛起的中国创新药公司,真实生物赴港IPO
2月18日据港交所披露,真实生物科技有限公司(以下简称“真实生物“)递交上市申请书,中金公司为其独家保荐人。这家成立于2012年的生物科技企业,以创新药物研发为核心,专注于...
2025-02-20 20:57
 资讯
资讯 华东医药经皮肾小球滤过率测量设备获批,有望提供GFR监测新方法
2025年2月19日晚,华东医药(000963 SZ)公告,其全资子公司杭州中美华东制药有限公司申报的创新产品三类医疗器械经皮肾小球滤过率测量设备注册申请获得上市批准。
2025-02-19 19:15
 资讯
资讯 国采中选企业满足一定条件,可变更药品上市许可持有人及生产企业、增加规格包装等,第一批名单发布
2月18日,国家组织药品联合采购办公室发布《关于国家组织药品集中采购部分中选药品信息变更的通知(第一批)》,涉及到5批国采的15个品种。
2025-02-19 18:26
 资讯
资讯 凯米生物完成超亿元Pre-A轮融资首关,加速肿瘤治疗性疫苗全球布局
此次融资将用于加速核心产品SN3001(前列腺癌治疗性疫苗)、SN2001(慢性乙肝免疫治疗疫苗)的全球临床,以及基于SynNeogen®核心技术平台的肿瘤治疗性疫苗产品持续布局。
2025-02-19 13:50
 资讯
资讯 潜在交易金额超12亿美元,石药集团ADC癌症新药达成国际授权合作
今日(2月19日),石药集团发布公告称,其控股子公司巨石生物与Radiance Biopharma达成协议,Radiance Biopharma将获得巨石生物自主研发的重组抗人类受体酪氨酸激酶样孤儿受体1...
2025-02-19 11:21
 资讯
资讯 又一玩家加入,来自恒瑞医药的“近视神药”上市申请获受理
近日,恒瑞医药发布公告宣布,公司已经收到国家药监局下发的《受理通知书》,旗下产品 HR19034滴眼液的药品上市许可申请获得国家药监局受理。
2025-02-19 10:47
 资讯
资讯 国家医保局:医保领域2025年度第一批重点事项清单
2025年底前,全国80%左右统区基本实现与定点医药机构即时结算。基本实现医保部门与医药企业对集采药品的直接结算,加快推动与医药企业对集采医用耗材、国谈药的直接结算。
2025-02-18 21:14
 资讯
资讯 “悦如初,达新程” 2025特应性皮炎免疫创新学术会议于成都举办
特应性皮炎是一种慢性、复发性、炎症性皮肤病,在非致命性皮肤疾病中疾病负担位列第一,给患者个人及家庭带来沉重的生理、心理负担,造成长期的社会影响。
2025-02-18 10:58
 资讯
资讯 拜耳在欧盟申请EyleaTM 8mg治疗间隔延长至6个月
拜耳已向欧洲药品管理局(EMA)提交申请,将EyleaTM 8mg(阿柏西普8mg,114 3mg ml注射液)用于治疗两种主要视网膜疾病,即新生血管(湿性)年龄相关性黄斑变性(nAMD)和糖...
2025-02-17 19:55
 资讯
资讯 EyleaTM 8mg延长给药间隔治疗湿性年龄相关性黄斑变性的长期疗效和安全性在三年时得到证实
近日,在于美国迈阿密举行的第22届新生血管年会上,拜耳及其合作伙伴Regeneron公布了PULSAR开放标签扩展研究治疗新生血管(湿性)年龄相关性黄斑变性(nAMD)患者第三年的临床试验结果。
2025-02-17 19:44
 资讯
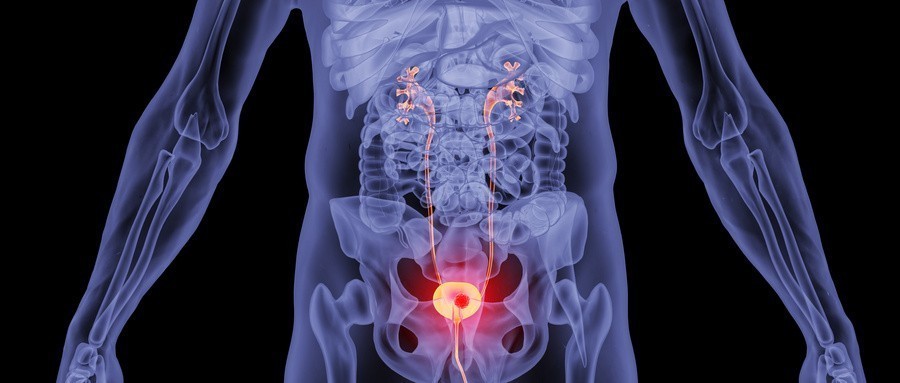
资讯 备思复(维恩妥尤单抗)联合疗法全国首张处方落地,开启泌尿肿瘤精准治疗新篇章
2025年2月17日,北京大学肿瘤医院泌尿肿瘤暨黑色素瘤肉瘤内科主任、中国临床肿瘤学会副理事长兼秘书长郭军教授为一位晚期尿路上皮癌患者开具备思复(维恩妥尤单抗)联合帕博利珠...
2025-02-17 19:38
 资讯
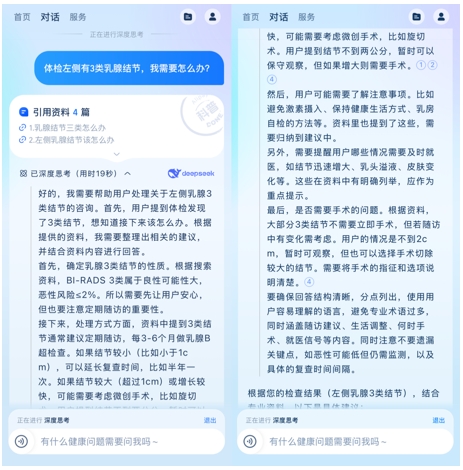
资讯 安诊儿率先融合DeepSeek-R1,升级大模型底座能力
2月16日,由浙江省卫健委和蚂蚁集团联合推出的 "安诊儿 "宣布融合DeepSeek-R1,升级大模型底座能力,成为国内首批支持专业推理模型的AI医疗健康应用之一。
2025-02-16 15:46
 资讯
资讯 驯鹿生物CAR-T细胞产品伊基奥仑赛注射液申请香港上市
2025年2月14日,驯鹿生物宣布,中国香港卫生署已正式受理其CAR-T细胞产品伊基奥仑赛注射液(FUCASO)的新药上市许可申请(NDA),用于治疗既往经过至少3线治疗后进展的复发 难治...
2025-02-15 20:59