今天是2015年的最后一天,在大家兴致勃勃满具情怀迎接新的2016时,而明天的医药行业,却是几家欢喜几家愁,有些药企自今晚零点过后,就再也见不到明日的太阳。
12月30日晚,CFDA连续发布了《关于切实做好实施药品生产质量管理规范有关工作的通知》(以下简称“通知1”)和《关于全面监督实施新修订《药品经营质量管理规范》有关事项的通知》(以下简称“通知2”), 根据《关于切实做好实施药品生产质量管理规范有关工作的通知》,自2016年1月1日起,未通过新版 GMP认证 的药品生产企业(或生产车间)一律停止生产。
《通知1》明确,自2016年1月1日起,未通过《药品生产质量管理规范(2010年修订)》(简称药品GMP)认证的药品生产企业(或生产车间)一律停止生产。2015年12月31日前完成生产的药品,可继续销售。
是不是有这样一种可能,反正天高皇帝远,侥幸偷偷开工呢。
《通知1》强调,各省(区、市)食品药品监督管理局要对行政区域内应停产企业(或生产车间)逐一进行现场检查,确认其保持停产状态;一旦发现未按规定停产的,按照《中华人民共和国药品管理法》及相关规定严肃查处。
未通过GMP认证的药企也并不是完全被逼到了死胡同。
《通知1》明确表示,未通过药品GMP认证的药品生产企业,不予换发《药品生产许可证》。如果正在进行技术改造,可再给一年的过渡期,要求在 2016年12月31日前向所在地省(区、市)食品药品监督管理局同时提出换发《药品生产许可证》申请和药品GMP认证申请。通过药品GMP认证后,予以核发《药品GMP证书》和《药品生产许可证》。
同时,对于未能按期通过药品GMP认证、主动放弃全厂(或部分剂型)生产改造的药品生产企业,可在2016年12月31日前提出药品技术转让注册申请。这对于没有能力过新版GMP的药企来说,是一条出路。此外,也有药企另辟蹊径,《开始转攻保健品》,面对日益增长的保健品市场,这不失为一种好的选择。
那对于已经通过GMP认证的企业,是否就高枕无忧了。
《通知2》提到了各省级食品药品监管部门要切实落实监管责任,加强对已通过新修订药品GSP认证企业的日常监管,定期组织开展现场检查,积极采取飞行检查、公开曝光等方法,督促企业持续按照新修订药品GSP和相关规定开展经营活动。发现存在严重违法违规行为的,必须撤销其《药品经营质量管理规范认证证书》,及时公开相关信息,并依法立案查处;对屡查屡犯的,必须吊销其《药品经营许可证》。
此外,《通知1》中提到,2016年1月1日起,各省(区、市)食品药品监督管理局负责所有药品GMP认证工作。对于通过认证的企业,由各省(区、市)食品药品监督管理局核发《药品GMP证书》,自《公告》发布之日起,国家食品药品监督管理总局不再受理药品GMP认证申请。
同时,《通知2》提出,新开办药品批发企业必须具备药品现代物流条件,新开办药品零售企业的法定代表人或企业负责人必须具备执业药师资格,新增药品零售连锁门店必须配备执业药师。凡不符合上述要求的,一律不得擅自变通标准许可开办。
对于执业药师的配备而言,虽说有从业药师过渡政策,暂时能保住老药店,但是从新开药店的数量来看,缓解执业药师缺口仍具有一定难度。
明天,又是新的一年来到了,医谷小编在这里给大家做一个温馨提示,新的一年,除了GMP认证,电子监管码也来了,按照今年年初CFDA下发的一号文,CFDA将继续强化电子监管码的管理作用,根据要求,2015年12月31日前,境内药品制剂生产企业、进口药品制药厂商须全部纳入中国药品电子监管网,并须按照国食药监办〔2012〕283号文的要求,完成生产线改造,在药品各级销售包装上加印(贴)统一标识的中国药品电子监管码即所谓的赋码,通过中国药品电子监管平台核注核销。2016年1月1日后生产的药品制剂应做到全部赋码。此外,所有药品批发、零售企业也须全部入网,对所经营的已赋码药品“见码必扫”,及时核注核销、上传信息。
总之,回望2015,诸多不易,展望2016,大家且行且珍惜。
附件1:品药品监管总局关于切实做好实施药品生产质量管理规范有关工作的通知
食药监药化监〔2015〕277号
2015年12月30日
各省、自治区、直辖市食品药品监督管理局:
国家食品药品监督管理总局发布了《关于未通过药品生产质量管理规范(2010年修订)认证企业停止生产和下放无菌药品认证有关事宜的公告》(2015年第285号,以下简称《公告》),为保证《公告》要求落到实处,现将有关事宜通知如下:
一、监督未通过认证企业停产
(一)自2016年1月1日起,未通过《药品生产质量管理规范(2010年修订)》(以下简称药品GMP)认证的药品生产企业(或生产车间)一律停止生产。2015年12月31日前完成生产的药品,可继续销售。2015年12月31日前已完成最终包装的药品,经企业所在地省(区、市)食品药品监督管理局核准后,可继续进行检验,合格后方可销售。
(二)2015年12月31日前已通过药品GMP认证现场检查并已公示的药品生产企业(或生产车间),2016年1月1日后,可继续生产。但是,其产品应在取得《药品GMP证书》后方可销售。
(三)各省(区、市)食品药品监督管理局要对行政区域内应停产企业(或生产车间)逐一进行现场检查,确认其保持停产状态;一旦发现未按规定停产的,按照《中华人民共和国药品管理法》及相关规定严肃查处。要对停产企业的原辅料、包装材料等采取切实有效的管控措施,特别要加强对停产的麻醉药品、精神药品、医疗用毒性药品和放射性药品等特殊药品生产企业的监督管理,防止相关原辅材料流入非法渠道。
(四)未通过药品GMP认证的药品生产企业,不予换发《药品生产许可证》。如果正在进行技术改造,可再给一年的过渡期,要求在 2016年12月31日前向所在地省(区、市)食品药品监督管理局同时提出换发《药品生产许可证》申请和药品GMP认证申请。通过药品GMP认证后,予以核发《药品GMP证书》和《药品生产许可证》。
(五)未能按期通过药品GMP认证、主动放弃全厂(或部分剂型)生产改造的药品生产企业,可以按照《国家食品药品监督管理局、国家发展改革委、工业和信息化部、卫生部关于加快实施新修订药品生产质量管理规范促进医药产业升级有关问题的通知》(国食药监安〔2012〕376号)规定,在2016年12月31日前提出药品技术转让注册申请,且一个剂型的药品仅限于一次性转让给一家企业,受让方必须是通过相应剂型药品GMP认证的药品生产企业。逾期提出申请的,食品药品监督管理部门不予受理。
(六)各省(区、市)食品药品监督管理局要密切关注药品市场供应变化,对于可能出现的药品短缺问题,要及时研判,配合有关部门积极应对、妥善处理。对企业停产可能引发的社会稳定等问题,要及时报告地方政府。
二、药品GMP认证下放
(一)2016年1月1日起,各省(区、市)食品药品监督管理局负责所有药品GMP认证工作。对于通过认证的企业,由各省(区、市)食品药品监督管理局核发《药品GMP证书》;对于未通过认证的企业,也应公布现场检查发现的严重缺陷项目、主要缺陷项目。
(二)自《公告》发布之日起,国家食品药品监督管理总局不再受理药品GMP认证申请。对于已经受理的认证申请,将继续组织完成现场检查、审核发证。
(三)各省(区、市)食品药品监督管理局要按照《食品药品监管总局关于对取消和下放行政审批事项加强事中事后监管的意见》(食药监法〔2015〕65号)要求,完善监管体系,加强能力建设,加强事中事后监管,保证认证工作质量。
(四)各省(区、市)食品药品监督管理局要通过国家食品药品监管信息平台(数据重构项目)及时、准确上传认证结果信息或做好数据对接,统一对外发布有关信息。
三、加强监督管理
药品GMP认证下放以后,各省(区、市)食品药品监督管理局要切实履行监管责任,保证药品安全有效。
(一)坚持统一标准。根据国家食品药品监督管理总局印发的《无菌药品检查指南》、《药品生产现场检查风险评定指导原则》、《药品GMP现场检查缺陷项目整改要求》等六个技术指南文件,各省(区、市)食品药品监督管理局要认真对照梳理,严格遵照执行,不得制定与上述技术指南相抵触的规定。要进一步健全认证管理体系,完善认证工作程序,使用规定的信息化平台,确保在统一的质量管理体系下开展检查工作,保证检查质量。
(二)落实属地监管。要严把认证发证关,通过强化检查督促持续合规。必须坚持高标准、严要求,认真组织检查,严格审核把关,各省不得再下放认证事权,确保监督实施药品GMP的一致性、公正性、权威性。
(三)强化监督责任。要加强事中事后监管,加大跟踪检查、飞行检查力度,要提高监督检查的针对性、有效性,提高监督检查发现问题的能力。在督促企业规范生产、持续合规的同时,督促日常监管责任的落实。对认证发证把关不严、未发现企业重大缺陷的,未及时查处违法违规行为的,未落实日常监管责任的,要严肃问责。
(四)建立职业化的检查员队伍。要加强检查员队伍建设和检查能力建设,建立一支与监管对象相适应的职业化检查员队伍,特别是要加强疫苗、血液制品等高风险品种检查员的配备,保证检查员数量与生产企业相匹配。要规范检查员的聘用、培训和考核,检查员必须通过专业技能考试后方能上岗,并进行持续培训。
(五)严厉查处违法违规行为。要对违法犯罪行为,保持高压严打态势,对于严重违法生产行为,坚决依法吊销生产许可;对违反药品GMP、存在严重缺陷的,坚决停止其药品生产,收回其药品GMP证书。企业在确证已经改正错误、纠正违规行为,能够保证持续合规的前提下,方可提出药品GMP复查申请。食品药品监督管理部门方可组织再检查、再认证,合格后发还药品GMP证书。
(六)落实经费保障。要完善监督经费保障机制,健全检查机构,改善条件设施,给予检查员适当待遇,为公平公正开展检查工作提供保障。要严格按照《药品检查工作纪律与廉政准则》要求,强化廉政教育,严肃检查纪律,树立公正廉洁、权威高效的药品检查队伍形象。
在工作中如有问题,请及时联系国家食品药品监督管理总局药品化妆品监管司。
联系人:
叶家辉,010-88330812
周乐,010-88330842
附件2:品药品监管总局办公厅关于全面监督实施新修订《药品经营质量管理规范》有关事项的通知
食药监办药化监〔2015〕176号
2015年12月30日
各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局:
2015年12月30日,总局发布了《关于未通过新修订〈药品经营质量管理规范〉认证企业停止经营的公告》(2015年第284号,以下简称《公告》)。为落实《公告》要求,现将有关事项通知如下:
一、各省级食品药品监管部门要组织对未通过新修订药品经营质量管理规范(药品GSP)认证的药品经营企业逐一核查,督促其切实停止药品经营活动。对《药品经营许可证》到期,仍未通过认证的企业,必须取消其药品经营资格,依法注销其《药品经营许可证》。
二、各省级食品药品监管部门要切实落实监管责任,加强对已通过新修订药品GSP认证企业的日常监管,定期组织开展现场检查,积极采取飞行检查、公开曝光等方法,督促企业持续按照新修订药品GSP和相关规定开展经营活动。发现存在严重违法违规行为的,必须撤销其《药品经营质量管理规范认证证书》,及时公开相关信息,并依法立案查处;对屡查屡犯的,必须吊销其《药品经营许可证》。
三、严格审批新开办药品经营企业。新开办药品批发企业必须具备药品现代物流条件,新开办药品零售企业的法定代表人或企业负责人必须具备执业药师资格,新增药品零售连锁门店必须配备执业药师。凡不符合上述要求的,一律不得擅自变通标准许可开办。
四、继续认真做好认证检查工作。对后续申请药品GSP认证企业,必须坚持统一标准,严格现场检查,确保认证标准的一致性。要严格履行监管职责,不得随意下放认证检查权限。
实施药品GSP是保障流通环节药品质量的基本制度规范,各级食品药品监管部门要高度重视,统一思想,提高认识,坚持“四个最严”要求,采取有效措施,切实把药品GSP的要求落实到药品流通的各个环节,确保药品质量安全。
食品药品监管总局办公厅
2015年12月30日
来源:医谷网
为你推荐
 资讯
资讯 带状疱疹疫苗“遇冷”,百克生物2024年净利润腰斩
近日,国内疫苗龙头企业百克生物发布2024年年报,数据显示,其报告期内实现营收12 29亿元,同比下降32 64%;归属于上市公司股东的净利润2 32亿元,同比下降53 67%。对于营收...
2025-04-23 12:59
 资讯
资讯 重庆常用药联盟接续集采中选结果
近日,重庆常用药联盟接续集采中选情况公布,该联盟由重庆牵头,联合湖北、广西、海南、贵州、云南、青海、宁夏、新疆及新疆生产建设兵团等十省(区、市)开展的药品集中带量采...
2025-04-21 18:48
 资讯
资讯 全周期智控慢病,诺和诺德与京东健康开启战略合作
2025年4月21日,全球领先的生物制药公司诺和诺德与京东健康在北京正式签署战略合作协议,标志着双方在糖尿病和体重管理领域的合作进入新阶段。依托诺和诺德百年深耕慢病领域的专...
2025-04-21 15:57
 资讯
资讯 康方生物1类新药依若奇单抗上市申请获批,用于中重度斑块状银屑病成人患者
该药是我国第一个且唯一获批上市的IL-12 IL-23“双靶向”单克隆抗体新药,是康方生物自身免疫性疾病领域首个获批上市的一类新药。
2025-04-21 13:39
 资讯
资讯 阿斯利康乳腺癌1类创新药卡匹色替片中国获批
该药适用于联合氟维司群用于转移性阶段至少接受过一种内分泌治疗后疾病进展,或在辅助治疗期间或完成辅助治疗后12个月内复发的激素受体(HR)阳性、人表皮生长因子受体2(HER2)...
2025-04-21 11:02
 资讯
资讯 辉瑞宣布终止一款口服GLP-1减肥药的临床开发
近日,辉瑞在其官网宣布,决定终止开发口服胰高血糖素样肽-1受体(GLP-1R)激动剂Danuglipron(PF-06882961),原因系在一项有关用药剂量的临床试验中,一名患者出现了可能由该...
2025-04-21 10:29
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
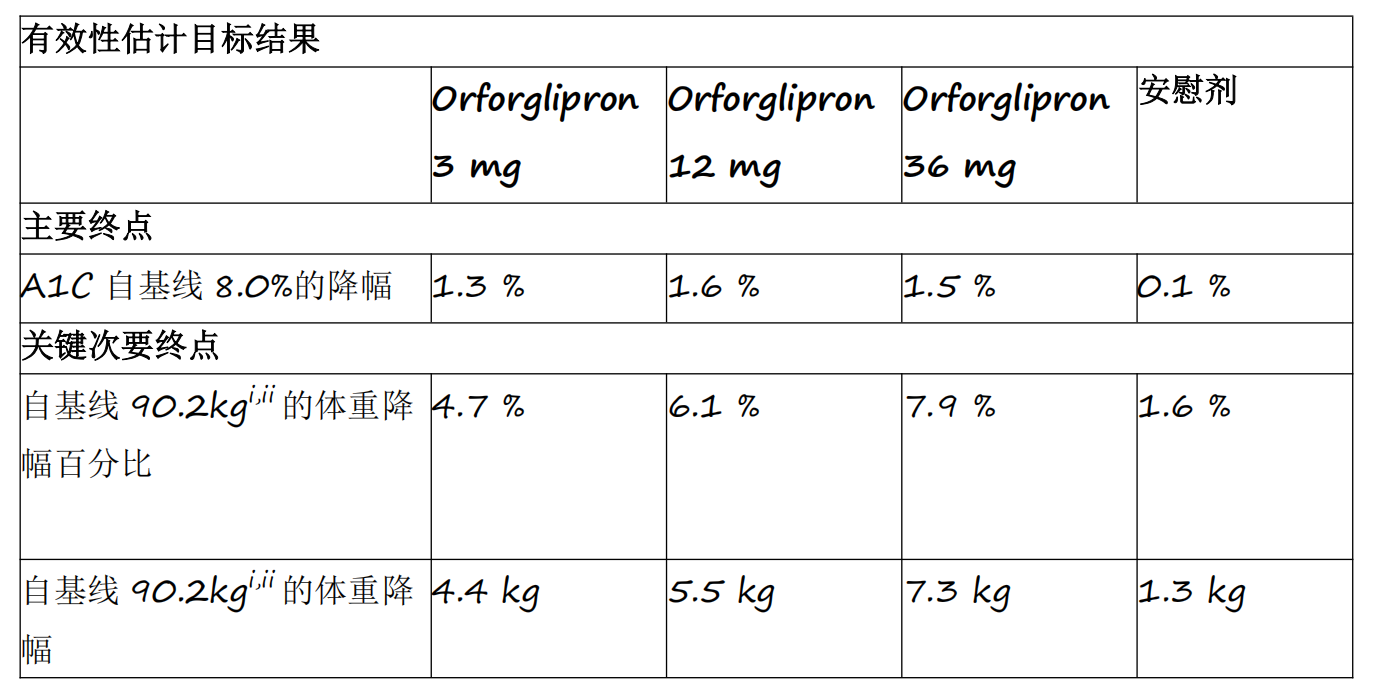 资讯
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12