最近,Cell出版社推出旗下新子刊《Trends in Cancer》,作为创刊号的一部分,该杂志邀请世界领先的癌症研究学者,列出了目前癌症研究领域所面临的八大问题。
1、对于致癌突变的了解,如何才能指导治疗?
科学家们花了几十年时间,来了解可导致细胞分裂失控的精确基因突变。现在癌症患者可以通过自己肿瘤的基因测序,来确定他们疾病的遗传根源,我们已经靶定了其中许多遗传学改变,但我们仍然还没有获得绝大部分的基因组数据。
2015年,奥巴马总统在国情咨文演讲中宣布了美国精密医学计划(PMI)。该计划包括聚焦癌症,目的是确定癌症的新临床表现,以使打靶治疗更加有效,研究潜在的抗性,并开发数据库,汇总患者的健康数据,以帮助医生做出更好的临床决策。
美国国家癌症研究所代理所长Douglas Lowy说:“肿瘤学的精准医学计划集中在治疗。然而,我们也需要认识到,预防和筛查是关键领域,这本身不属于PMI,但却是我们期待取得实质性进展的领域。”
2、我们可以将不同的癌症归纳为一组共同特质吗?
在2000年,研究人员Robert Weinberg和Douglas Hanahan在一篇具有里程碑意义的综述(DOI: 10.1016 / s0092-8674(00)81683-9)中提出了“癌症的特征”。定义一种癌症的几个基本原理包括:逃避细胞死亡、充分自我生长的能力、对抗生长信号的不灵敏性、组织侵袭和转移、无限制的细胞分裂潜力和血管发育。
这篇综述是Cell发表的论文中下载和引用最多的,此后又有新的研究增加了2个新兴的标志:异常的细胞新陈代谢和逃避免疫系统。
Weinberg在Whitehead生物医学研究所和麻省理工学院研究癌症的分子机制,他指出:“癌症是一种单一的疾病(可能从一组共同的标志得出结论),这个概念当然是一个幻想。而癌症形成的一般原理,可以广泛地推广到许多类型的肿瘤,癌症的详细行为可以致使每个肿瘤都是一个独特的实体——大自然的独特发明。”
3、为什么我们要关注肿瘤微环境?
癌细胞不是孤立存在的。它们共同起作用。它们共同选择血管和细胞外组织。发育良好的癌症就像一个不受欢迎的器官,从身体的其他部分窃取资源。肿瘤生长的周围环境是肿瘤的一个重要组成部分,决定着它的生存,这种想法迫使研究者们重新思考癌症的形成与发展。
这个领域的先锋者、劳伦斯伯克利国家实验室的Mina Bissell指出:“在过去三十多年的时间里,研究人员表明,即使强有力的癌基因也不足以形成肿瘤,只是在某些情况下。它们需要与免疫系统合作,并需要许多其他步骤和事件,使细胞变得真正的恶性。组织的结构,是理解‘为什么癌症是一种器官特异性疾病’的关键所在。”
Bissell认为,如果精密医学获得成功,我们需要进一步研究支持乳腺癌肿瘤与肝脏肿瘤的不同环境。她希望,我们可以通过使用肿瘤相关微环境包围的类器官,完善和最大化癌症的三维模型。这样的研究可以帮助我们测试使肿瘤休眠或甚至防止其转移的某种疗法。
4、表观遗传学在癌症中发挥作用吗?
癌症通常根据导致它们的突变而被定义,但是突变并不是改变基因的唯一途径。我们知道,癌症因新兴的表观遗传学领域而不断发生变化,表观遗传学旨在了解DNA的物理变化——不改变遗传密码但却改变编码的信息(例如,向DNA序列中添加一种化合物,这样,这些基因就不再表达)。
Van Andel研究所的研究主任和首席科学官Peter Jones说:“癌症表观遗传学被许多意外的结果改变,这些结果发现,在人类癌症中最常突变的许多基因是表观遗传修饰,从而清楚地将癌症的遗传学和表观遗传过程联系起来。”
他说:“的确,在没有检测到突变的情况下,一些儿童肿瘤似乎有甲基化的改变。这些研究结果强烈支持这一概念,即表观遗传学误调节直接参与了肿瘤的发生。”
癌症治疗的未来可能涉及表观遗传疗法,目前正在进行测试用于特定的淋巴瘤。早期已经在血液肿瘤中(而不是实体肿瘤)获得了成功,但是希望它们能够与免疫疗法相结合,来提高其他患者的反应。
5、免疫疗法将是对抗癌症的一个转折点吗?
癌症免疫疗法——利用免疫系统来对抗癌细胞,是一个安静的领域,直到研究人员开始证明它可以治疗那些对传统疗法无效的患者。癌细胞能够逃避免疫系统,这些免疫策略唤醒了T细胞。到目前为止,这种治疗方法在血液肿瘤和黑色素瘤中的效果最好。
这个领域的主要贡献者、翰霍普金斯大学医学院和Sidney Kimmel综合癌症中心的Suzanne Topalian指出:“一些患者开始治疗时,他们的预期寿命以月计算,但是今天他们仍然活着。现在这些药物在一线治疗设置中显示出活性,在那里它们可以取代或成为常规化疗和激酶抑制剂的一种附属物。”
免疫治疗仍面临着一些重大的挑战,例如,如何选择最有可能受益于治疗的患者,以及如何确定与其他治疗方法相结合的治疗传递顺序。研究人员特别看好这些联合疗法,在这些疗法中,患者同时接受免疫疗法、传统化疗和放疗。
6、p53是否还能实现自己的承诺?
编码p53蛋白的基因,是肿瘤中最常见的突变基因。p53的正常活动可阻止癌细胞,有几种不同类型的p53突变,可导致肿瘤的生长和侵袭性。这诱惑着研究人员,因为p53代表了一个可能的治疗靶点,可以对许多癌症产生广泛的影响。不幸的是,蛋白质的复杂性被证明比研究人员预期的更具挑战性。
英国癌症研究所所长Karen Vousden说:“十年前,p53的功能似乎很清楚,因为它能激活新生肿瘤细胞中的细胞周期阻滞和细胞凋亡,从而防止肿瘤的发展。然而,在过去的10年里,我们已经认识到p53基因许多不同的作用——从在干细胞重新编程中的作用,到对代谢和免疫反应的控制。”
她补充说,这些复杂性给研究人员提供了更多的选择,将它的功能用于治疗。目前的药物可打开肿瘤细胞中的p53。这种药物可以很好地起作用,但是会引起毒副作用和耐药性。将来的方法可以更专注于靶定导致p53最初功能丧失的缺陷。
7、癌症细胞代谢的差异可被利用吗?
癌细胞利用能量的方式与正常细胞不同,因为肿瘤需要不同种类的燃料才能持续生长。近年来,癌症的这一特性引起了科学界的极大兴趣,因为研究人员认为,可能有潜在的治疗方法会破坏癌症细胞的能量消耗。
癌症的代谢治疗方法面临的一个主要问题是,正常细胞也依赖于相同的代谢途径。这意味着,利用癌细胞代谢的治疗,可能有化疗样的副作用。
Memorial Sloan Kettering癌症中心的总裁和首席执行官Craig Thompson指出:“然而,也有一些乐观的理由。我们对于合成代谢(癌细胞的燃料)不断扩大的知识,将允许我们使用不致突变的药物,发掘增殖细胞的代谢依赖性。”
8、小鼠模型仍与人类癌症研究有关吗?
我们距离“来源于患者细胞的癌症三维类器官,可以在实验室培养皿中更忠实地复制人类癌症”,已经为时不远。在小鼠癌症治疗的几十年里,这个新的时代重新定义了临床前步骤,让我们可以在人类组织中测试潜在的疗法。
但是小鼠癌症模型已经带来了许多开创性的疾病见解,随着遗传操作的最新进展,目前没有其他实验系统能比得上实验室小鼠的可定制性。科学家现在可以制备出人源化的小鼠,具有致癌基因的人类版本,同时研究多个突变。
荷兰癌症研究所的课题组长Anton Berns表示:“小鼠模型是在体内环境中检验癌症相关概念的极好模型,但我们应该认识到,老鼠是不小的人类。但是为了研究在人类肿瘤中发现的复杂遗传学,我们还需要积累相当的基本经验,小鼠是回答这些问题的选择系统。”
来源:源正细胞
为你推荐
 资讯
资讯 福建省医保局印发单列门诊统筹支付医保药品目录(2024年版)
根据2024年6月发布的《福建省医保药品单列门诊统筹支付管理办法(试行)》,为了让参保患者无需住院、在门诊就医也能用上国家谈判药品、享受医保待遇,将适用于门诊治疗、使用周...
2025-04-20 13:34
 资讯
资讯 首批中国消费名品名单,医药健康企业有哪些?
近日,工业和信息化部办公厅发布首批中国消费名品名单,分为中国消费名品名单和中国消费名品成长企业名单。首批中国消费名品名单共包括93个企业品牌和43个区域品牌。中国消费名...
2025-04-20 11:17
 资讯
资讯 携手共绘“个性化近视手术”新蓝图:爱尔眼科与爱尔康启动100家医院全光塑技术战略合作
双方将以技术共享为核心,以人才培养为支撑,以科研协作为纽带,全力推进屈光手术标准化诊疗体系建设,加速前沿技术在临床领域的普及应用
文/ 屈慧莹 2025-04-19 23:35
 资讯
资讯 CDE:简化港澳已上市传统口服中成药内地上市注册审批申报资料及技术要求
允许香港、澳门特区本地登记的生产企业持有,并经香港、澳门特区药品监督管理部门批准上市且在香港、澳门特区使用15年以上,生产过程符合药品生产质量管理规范(GMP)要求的传统...
2025-04-18 18:54
 资讯
资讯 君德医药完成近亿元A轮融资,加速推进创新药械组合平台建设与产品上市
本轮融资主要用于首个减重口服器械的注册及生产销售,以及加速多个核心创新药械组合技术平台的产品管线研发进程。
2025-04-18 14:34
 资讯
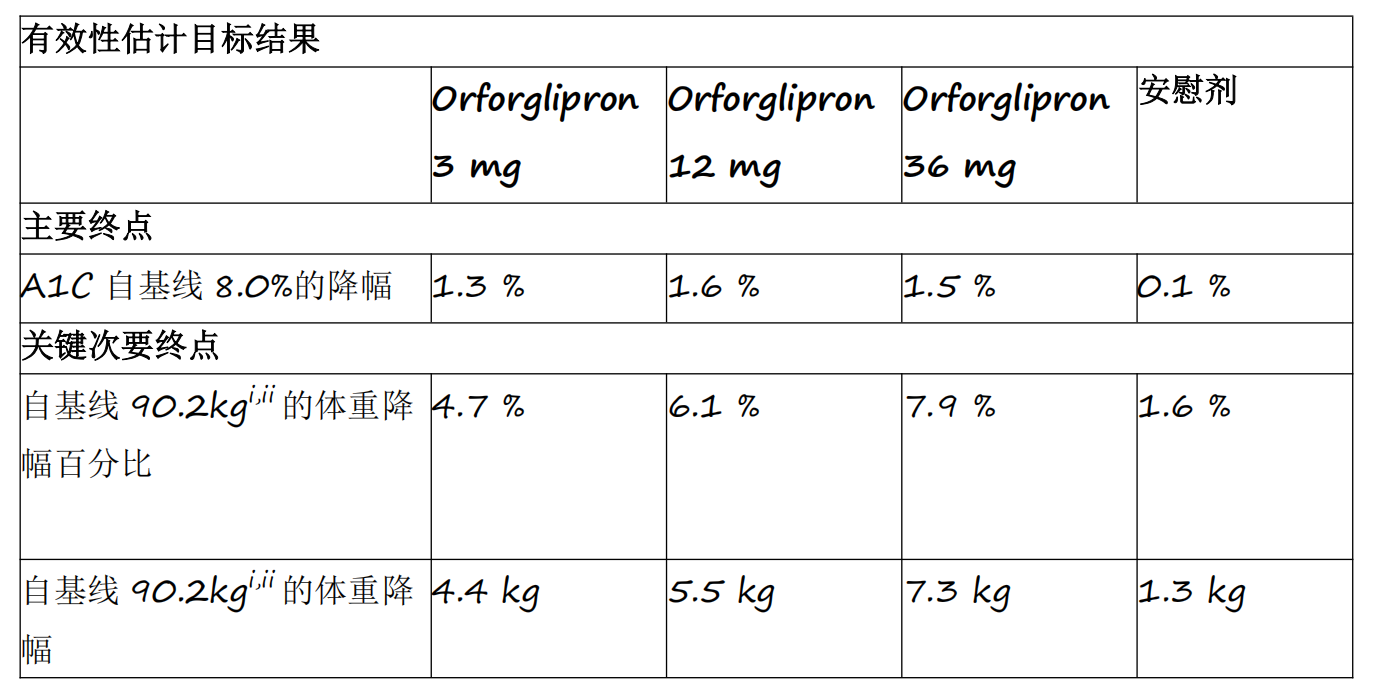
资讯 礼来首个小分子口服GLP-1RA药物orforglipron 3期临床研究成功
Orforglipron是首个成功完成3期临床研究的小分子GLP-1类药物,各剂量组平均A1C降幅为1 3%至1 6%
2025-04-18 14:12
 资讯
资讯 WSOPRAS 2025落幕:中国眼整形闪耀国际舞台,李冬梅教授代表爱尔眼科获2027年大会主办权
4月10日至12日,世界眼整形重建外科学会(WSOPRAS)2025年国际峰会在土耳其伊斯坦布尔盛大举行。
文/李林 2025-04-18 09:27
 资讯
资讯 华东医药2024年报出炉,营收超400亿,创新产品密集上市
报告显示,2024年公司合计实现营业收入419 06亿元,同比增长3 16%;实现归母净利润35 12亿元,同比增长23 72%,实现扣非归母净利润33 52亿元,同比增长22 48%。
2025-04-17 21:18
 资讯
资讯 讯飞医疗与爱奥乐医疗联合首发AI血压计,开启高血压管理新时代
4月11日,在备受瞩目的乌镇健康大会上,讯飞医疗与爱奥乐医疗联合首发AI血压计,作为行业首款搭载医疗大模型的AI血压计,引领家用医疗器械从单一检测工具进化为全周期健康管理解...
2025-04-17 20:34
 资讯
资讯 又一款常用药物被暂停采购资格
近日,上海阳光采购网发布通知,因未按要求调整药价,自2025年4月15日24时起暂停仁和堂药业有限公司盐酸地芬尼多片(25mg*12片 板 盒,铝塑)采购资格。
2025-04-17 15:29
 资讯
资讯 超16亿元,达仁堂“清仓”中美史克
日前,达仁堂发布公告称,公司拟分别向赫力昂(中国)、Haleon CH SARL(简称“赫力昂(英国))转让所持有的中美天津史克制药有限公司(简称“中美史克”)4 6%股权份额、7...
2025-04-17 15:08
 资讯
资讯 上海发布10款重点监控品种
根据上海此前发布的相关规则,医疗机构根据市场供需情况在阳光采购平台采购药品是,“红黄绿线”议价将实时提醒采购产品的价格是否存在问题,从而保证临床需求,并避免不合理调价。
2025-04-16 22:15
 资讯
资讯 马斯克称今年将首次在人体植入“盲视”设备,让失明者重见光明
4月初,马斯克在多个场合宣布,公司计划于今年底首次在人体内植入名为“Blindsight(盲视)”的脑机接口设备,目标是让完全失明者重见光明。
2025-04-16 14:28
 资讯
资讯 诺令生物完成数亿元人民币C轮融资,加速出海步伐和多元化产品布局
本轮融资将主要用于核心产品“便携式一氧化氮(NO)吸入治疗仪”的产能扩充、全球化推广,以及围绕NO缓释与发生技术的创新管线研发
2025-04-15 17:12
 资讯
资讯 扬帆出海正当时:Cytiva 为中国生物药企绘制全球合规航海图
峰会聚焦法规解读、国际监管环境、中国生物药企业出海案例等关键议题,通过专家分享和深入解读,为中国生物药企提供全球化战略指导和合规支持;
2025-04-15 17:00